靶向沉默ANXA3对大鼠吗啡镇痛耐受及炎症反应的影响
2020-02-26梁冰方洁
梁冰,方洁
河南中医药大学第一附属医院麻醉科,郑州 450000
吗啡对各种急慢性疼痛及癌症疼痛具有显著的镇痛效果,已被广泛应用于临床。但长期反复使用吗啡会导致吗啡镇痛效能降低,产生吗啡耐受现象,而且可能伴随痛觉过敏以及触发疼痛等多种并发症。此外,研究发现,吗啡可激活背根神经节和脊髓中胶质细胞,释放趋化因子及炎性因子,导致其镇痛效能降低[1-2],极大地限制了吗啡在临床上的应用。因此,深入研究吗啡镇痛耐受的分子机制,寻找能降低吗啡镇痛耐受的药物或者分子,对于改善吗啡镇痛耐受具有重要意义。
ANXA3是Annexins家族成员之一,在细胞发育及信号转导过程中具有重要作用。研究发现,ANXA3在活化的小胶质细胞中表达升高,且在切断轴突后的舌下神经核中表达上调[3]。有研究发现,ANXA3在慢性压迫损伤诱导的神经疼痛模型中表达明显升高,抑制ANXA3能缓解大鼠热痛觉过敏[4],而过表达ANXA3可促进神经元细胞死亡[5]。以上研究结果均提示ANXA3在神经系统中发挥重要作用,但其对吗啡镇痛耐受的作用尚未见报道。本研究通过鞘内注射ANXA3 siRNA,观察ANXA3对吗啡镇痛效能、脊髓腰膨大内炎性因子产生、细胞外信号调节激酶(external signal regulated kinase,ERK)和c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)磷酸化的影响,探讨了ANXA3对吗啡镇痛耐受的作用及可能的机制。
1 材料与方法
1.1 实验动物及材料 30只SPF级雄性SD大鼠购自河南中医药大学第一附属医院动物室,体重200~225 g。热痛觉测试仪(Life Sciences公司,美国);盐酸吗啡(沈阳第一制药厂);肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β和IL-6酶联免疫吸附测定(ELISA)试剂盒(R&D公司,美国);RNA提取试剂Trizol(Invitrogen公司,美国);PrimeScriptTMRT reagent Kit反转录试剂盒(TaKaRa,日本);SYBR荧光PCR试剂(Qiagen公司,德国);磷酸化ERK(p-ERK)和磷酸化JNK(p-JNK)抗体(CST公司,美国);GAPDH和β-actin(Abcam公司,美国);辣根过氧化酶标记的二抗(北京中杉金桥公司)。本实验过程符合单位及国家有关实验动物管理和使用规定。
1.2 方法
1.2.1 鞘内置管术 参照Yaksh等[6]的方法对所有大鼠进行鞘内置管手术。SD大鼠按照60 mg/kg的剂量经腹腔注射2%戊巴比妥钠麻醉后,钝性分离L5-6棘突两侧的肌肉,暴露L5-6椎间隙。将已经消毒并充满生理盐水的PE10导管轻柔地向上置入,深度2.0~2.5 cm。将导管缝扎固定在皮下筋膜上,经皮下隧道自颈部引出,露出2 cm固定于颈部,整个过程中需注意防止导管折叠。采用生理盐水冲洗导管,热熔封口。术后依次缝合伤口。24 h后,将20 μl的2%利多卡因缓慢注射到大鼠体内,10 s后,大鼠的左右后肢不能抬高,针刺无退缩反射,10 min后左右肢体运动恢复正常,说明导管放置正确。术后所有大鼠均单笼饲养,5 d后开始实验。此外,本研究进行了预实验,证实连续7 d鞘内注射15 μg盐酸吗啡溶液能够成功制备大鼠吗啡耐受模型。
1.2.2 实验分组 30只大鼠采用随机数字表法分为3组,每组10只。①吗啡组:鞘内注射10 μl DEPC溶剂,30 min后鞘内注射10 μl盐酸吗啡溶液(生理盐水配置,浓度为1.5 g/L);②阴性对照组:鞘内注射10 μl生理盐水,30 min后鞘内注射10 μl盐酸吗啡溶液;③ANXA3 siRNA组:鞘内注射含有10 μg ANXA3 siRNA的溶液10 μl,30 min后鞘内注射10 μl盐酸吗啡溶液。每天上午8:30给药,连续给药7 d。
1.2.3 足底辐射热痛觉测试仪测定大鼠热缩足反射潜伏期(PWL) 将大鼠置于透明测定装置内安静30 min,大鼠可在装置内自由活动。测试前预热热痛觉测试仪使其红外光聚焦于3 mm玻璃板高度并预热3 min。光源照射在大鼠左足后爪中外1/3交界处时计时,至大鼠因疼痛将后爪挪开停止计时并精确到0.01 s,记录此次大鼠的PWL,单次辐射最长时间为15 s(截止时间)。每只大鼠重复测量5次,间隔5 min,去掉最大值和最小值,取平均值即为该大鼠的PWL。分别于第1、3、5、7天,在每次给药前和给药后30 min测定大鼠的PWL。计算最大可能镇痛效应百分数(%MPE)%。%MPE=(给药后PWL-基础PWL)/(截止时间PWL-基础PWL)×100%。
1.2.4 标本收集 在实验第7天给药后1 h,将各组大鼠用戊巴比妥钠麻醉,在冰上迅速分离并留取脊髓腰膨大,液氮冻存,用于测定炎性因子及相关蛋白的表达水平。
1.2.5 RT-PCR测定ANXA3、TNF-α、IL-1β和IL-6 mRNA表达水平 采用Trizol试剂提取脊髓组织总mRNA,采用酶标仪测定A260/A280并计算mRNA的浓度。按说明书将5 μg的RNA反转录合成cDNA。然后用SYBR Green进行RT-PCR,每组设3个复孔。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃45 s,35个循环;72 ℃ 10 min。以GAPDH为内参照,采用2-ΔΔCt法计算目的基因的相对表达水平。
1.2.6 Western blotting检测ANXA3、p-ERK、p-JNK蛋白表达水平 将脊髓组织置于RIPA裂解液中匀浆,提取组织中的蛋白。4 ℃、12 000 r/min离心25 min收集上清液,采用BCA试剂盒测定各组蛋白浓度。取蛋白(50 μg/孔)进行SDS-PAGE电泳,分离蛋白,将蛋白转至PVDF膜上。室温下采用5% BSA封闭1 h,加入抗ANXA3、p-ERK、p-JNK和β-actin抗体,4 ℃过夜孵育,洗膜后加入二抗反应1 h。PVDF膜采用发光试剂ECL显色,X线胶片曝光。扫描胶片,采用Image J软件分析各条带的光密度值。
1.2.7 ELISA检测TNF-α、IL-1β和IL-6蛋白浓度将脊髓组织经匀浆、超声处理。离心后收集上清液储存于-80 ℃。按照试剂盒说明书测定TNF-α、IL-1β和IL-6蛋白浓度。
1.3 统计学处理 采用SPSS 11.0软件进行统计分析。数据以表示,大鼠%MEP结果采用重复测量资料的方差分析,其他指标则采用单因素方差分析,进一步两两比较,方差齐采用LSD检验,方差不齐则采用Dunnett T3检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠的%MPE水平比较 第1天,各组大鼠%MPE水平差异无统计学意义。第3、5、7天,阴性对照组与吗啡组%MPE水平无明显差异;ANXA3 siRNA组的%MPE水平均高于阴性对照组(P<0.05)。3组%MPE均随时间延长而逐步降低(P<0.05,表1)。
表1 各组大鼠%MPE水平变化(%,±s,n=10)Tab.1 The change of %MPE level in each group of rats (%, ±s, n=10)
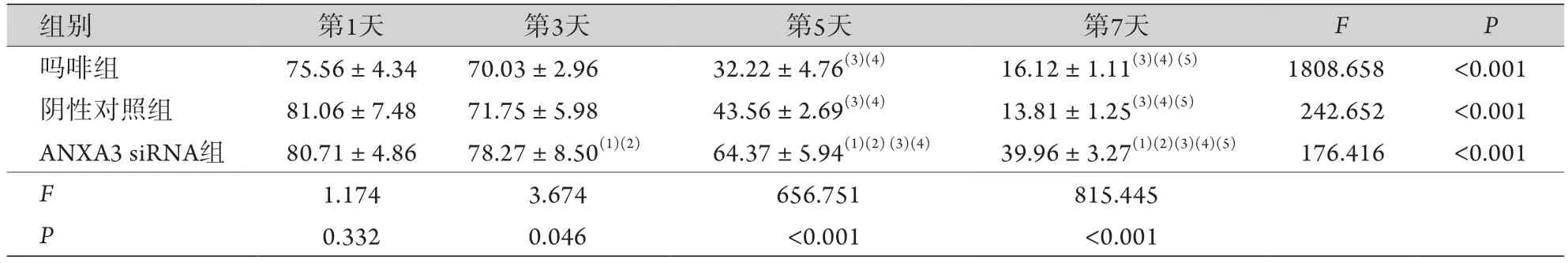
表1 各组大鼠%MPE水平变化(%,±s,n=10)Tab.1 The change of %MPE level in each group of rats (%, ±s, n=10)
与吗啡组比较,(1)P<0.05;与阴性对照组比较,(2)P<0.05;与第1天比较,(3)P<0.05;与第3天比较,(4)P<0.05;与第5天比较,(5)P<0.05。
组别 第1天 第3天 第5天 第7天 F P吗啡组 75.56±4.34 70.03±2.96 32.22±4.76(3)(4) 16.12±1.11(3)(4) (5) 1808.658 <0.001阴性对照组 81.06±7.48 71.75±5.98 43.56±2.69(3)(4) 13.81±1.25(3)(4)(5) 242.652 <0.001 ANXA3 siRNA组 80.71±4.86 78.27±8.50(1)(2) 64.37±5.94(1)(2) (3)(4) 39.96±3.27(1)(2)(3)(4)(5) 176.416 <0.001 F 1.174 3.674 656.751 815.445 P 0.332 0.046 <0.001 <0.001
2.2 各组大鼠脊髓组织ANXA3 mRNA和蛋白表达水平比较 吗啡组、阴性对照组及ANXA3 siRNA组ANXA3 mRNA相对表达水平分别为1.01±0.03、1.14±0.08和0.47±0.09,阴性对照组与吗啡组比较无明显差异;与阴性对照组比较,ANXA3 siRNA组ANXA3 mRNA表达水平降低,差异有统计学意义(P<0.05)。吗啡组、阴性对照组及ANXA3 siRNA组ANXA3蛋白相对表达水平分别为0.99±0.02、1.15±0.21和0.38±0.05,阴性对照组与吗啡组比较无明显差异;与阴性对照组比较,ANXA3 siRNA组ANXA3蛋白表达水平降低,差异有统计学意义(P<0.05,图1)。
2.3 各组大鼠脊髓组织TNF-α、IL-1β和IL-6 mRNA相对表达水平及蛋白浓度比较 与吗啡组比较,阴性对照组TNF-α、IL-1β及IL-6 mRNA相对表达水平无明显差异;与阴性对照组比较,ANXA3 siRNA组TNF-α、IL-1β及IL-6 mRNA相对表达水平降低,差异有统计学意义(P<0.05)。与吗啡组比较,阴性对照组TNF-α、IL-1β及IL-6蛋白浓度无明显差异;ANXA3 siRNA组TNF-α、IL-1β及IL-6蛋白浓度较阴性对照组明显降低,差异有统计学意义(P<0.05,表2)。
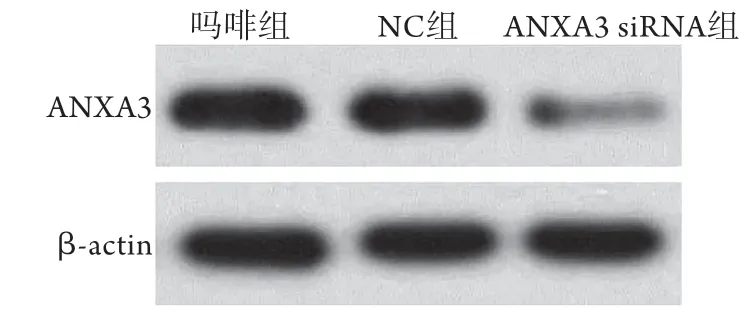
图1 各组大鼠脊髓组织ANXA3蛋白表达水平Fig.1 The expression levels of ANXA3 protein in each group of rats NC.阴性对照
表2 各组大鼠脊髓组织TNF-α、IL-1β和IL-6的mRNA相对表达水平及蛋白浓度比较(±s,n=10)Tab.2 The relative expression level and protein concentration of TNF-α, IL-1β and IL-6 in each group (±s, n=10)
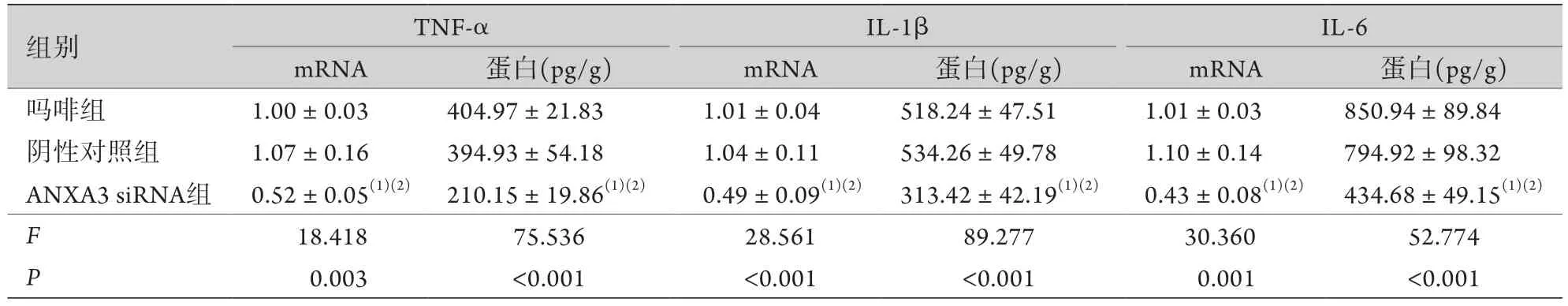
表2 各组大鼠脊髓组织TNF-α、IL-1β和IL-6的mRNA相对表达水平及蛋白浓度比较(±s,n=10)Tab.2 The relative expression level and protein concentration of TNF-α, IL-1β and IL-6 in each group (±s, n=10)
与吗啡组比较,(1)P<0.05;与阴性对照组比较,(2)P<0.05。
组别 TNF-α IL-1β IL-6 mRNA 蛋白(pg/g) mRNA 蛋白(pg/g) mRNA 蛋白(pg/g)吗啡组 1.00±0.03 404.97±21.83 1.01±0.04 518.24±47.51 1.01±0.03 850.94±89.84阴性对照组 1.07±0.16 394.93±54.18 1.04±0.11 534.26±49.78 1.10±0.14 794.92±98.32 ANXA3 siRNA组0.52±0.05(1)(2)210.15±19.86(1)(2) 0.49±0.09(1)(2)313.42±42.19(1)(2) 0.43±0.08(1)(2) 434.68±49.15(1)(2)F 18.418 75.536 28.561 89.277 30.360 52.774 P 0.003 <0.001 <0.001 <0.001 0.001 <0.001
2.4 各组大鼠脊髓组织p-ERK、p-JNK蛋白相对表达水平比较 阴性对照组p-ERK蛋白相对表达水平(1.07±0.12)与吗啡组(1.03±0.02)比较无明显差异;与阴性对照组比较,ANXA3 siRNA组p-ERK蛋白相对表达水平(0.55±0.04)明显降低,差异有统计学意义(P<0.05,图2A)。阴性对照组p-JNK蛋白相对表达水平(1.15±0.04)与吗啡组(0.99±0.03)比较无明显差异;ANXA3 siRNA组p-JNK蛋白表达水平(0.68±0.07)明显低于阴性对照组,差异有统计学意义(P<0.05,图2B)。
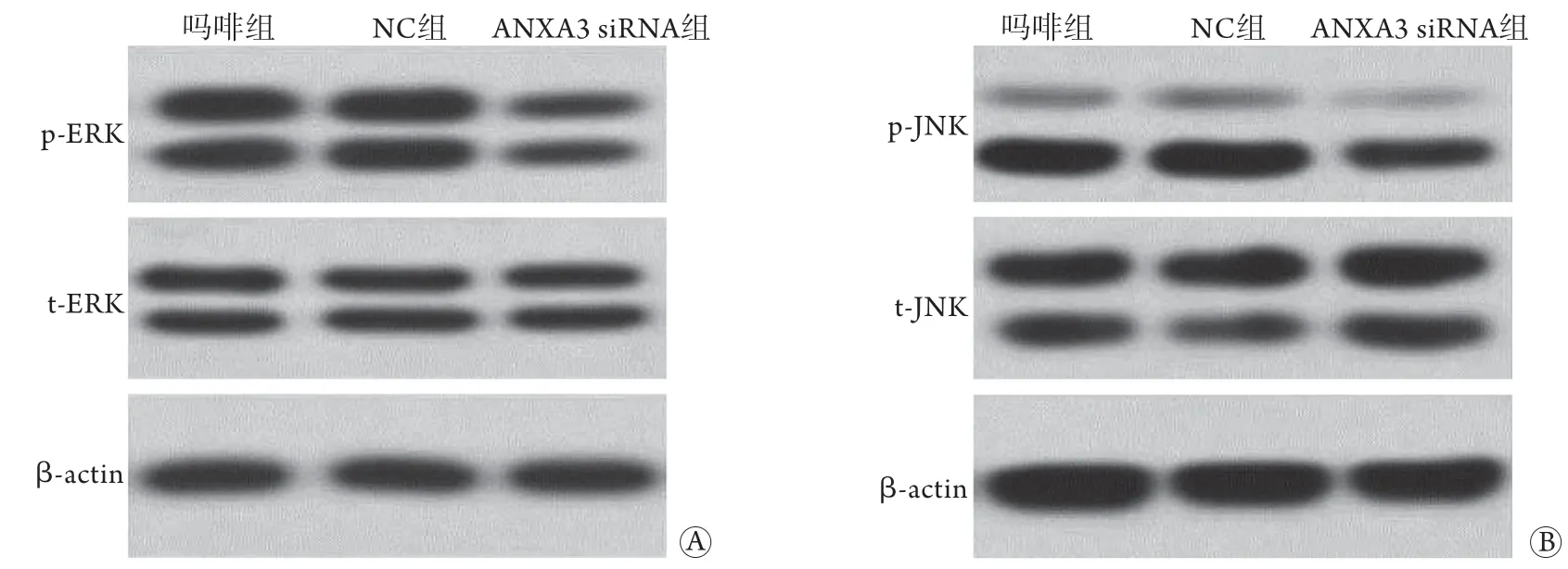
图2 各组大鼠脊髓组织p-ERK蛋白(A)、p-JNK蛋白(B)的表达水平Fig.2 The expression level of p-ERK protein (A) and p-JNK protein (B) in each group
3 讨 论
吗啡镇痛的耐受性使其在临床上的应用受到了明显限制[7],因此深入研究吗啡镇痛耐受的机制、提高其镇痛效能是基础和临床研究共同关注的问题。本研究采用连续7 d鞘内注射吗啡建立大鼠吗啡镇痛耐受动物模型,探讨了ANXA3在吗啡镇痛耐受中的作用及其可能机制。
热痛觉过敏是吗啡镇痛耐受的一种并发症[8]。前期有学者研究发现,ANXA3缺失能缓解神经疼痛模型大鼠的热痛觉过敏[4]。本研究采用%MPE值评价吗啡镇痛的效能,结果表明沉默ANXA3(ANXA3 siRNA组)使吗啡镇痛耐受性降低,吗啡镇痛效能增加,表明ANXA3在吗啡镇痛耐受及其并发症中均具有重要作用。
炎症反应在吗啡镇痛耐受中也发挥重要作用。有研究发现,在吗啡镇痛耐受模型中,促炎因子TNF-α及IL-1β表达水平明显升高[9-10]。采用中和抗体或者酶抑制剂阻断炎性因子产生能够有效缓解吗啡耐药性[11]。有研究发现,ANXA3能上调TNF-α及IL-6表达,促进炎症反应发生[12]。本研究发现,沉默ANXA3后TNF-α、IL-1β及IL-6水平明显降低,说明在吗啡镇痛耐受模型中,ANXA3能抑制炎性因子的产生,与上述研究结果一致。
ERK和JNK信号通路与病理性疼痛密切相关[13]。研究发现,大鼠注射吗啡后,其中枢及周围神经系统中ERK和JNK信号通路显著激活[14-15]。阻断ERK信号通路能降低神经病理性疼痛的发生并增强吗啡的镇痛效能[16]。抑制JNK信号通路能明显减弱吗啡镇痛耐受[17]。JNK缺失大鼠的吗啡镇痛效果及热痛觉过敏明显低于野生型大鼠[18]。本研究发现,沉默ANXA3能抑制ERK及JNK信号通路的激活,其蛋白磷酸化水平(p-ERK、p-JNK)明显下调,提示ANXA3可能通过调控ERK和JNK信号通路参与吗啡镇痛耐受性的调节。
综上所述,本研究结果显示,吗啡耐受可诱导ANXA3表达上调,沉默ANXA3可降低吗啡镇痛耐受并抑制炎性因子的产生。此外,ANXA3缺失抑制ERK及JNK信号通路的激活,提示ANXA3可能通过调控ERK及JNK信号通路在吗啡镇痛耐受的形成中发挥作用,为其在神经性疼痛中的应用及防治吗啡镇痛耐受的药物靶点提供了新的理论依据。
