吐温20对界面大豆分离蛋白的取代及其对乳液稳定性的影响
2020-02-26颜东琼章绍兵和文昭
颜东琼,章绍兵,和文昭
(河南工业大学 粮油食品学院,郑州450001)
大豆蛋白含有平衡的氨基酸组成和丰富的赖氨酸,能增加总膳食蛋白质摄入量并减少碳水化合物或脂肪摄入量和降低胆固醇等,可预防肥胖、糖尿病和肾脏疾病等,与小麦蛋白营养互补,是人类饮食中重要的食物蛋白之一[1]。大豆中的生物活性成分逐渐在食品中得到应用,并加工制成各种保健品,同时也普遍应用于轻工业和化妆品中[2-3]。
20世纪80年代末,表面活性剂被发现加入牛奶制品(搅打奶油和冰淇淋)中可以促进脂肪球的聚结。为了探寻其中的机制,蛋白质(主要是牛奶蛋白质)和表面活性剂的界面相互作用逐渐受到研究者的重视。Dalgleish等[4]发现吐温60与酪蛋白的摩尔比高达90∶1时,界面蛋白质仅部分被取代,当吐温60浓度进一步增加时,酪蛋白吸附层的厚度和油滴电位均降低。有研究表明[5-6],当体系中表面活性剂和蛋白质浓度比达到或超过一定程度时,界面蛋白质才能够被表面活性剂部分或完全取代,但是蛋白质种类不同其被取代的难易程度有差异。大豆分离蛋白是一种优质的植物蛋白资源,不仅具有较高的营养价值,还具有较好的乳化性、凝胶性和起泡性。Diftis等[7]研究了大豆分离蛋白-葡聚糖混合物和表面活性剂之间的相互作用,发现干燥加热的大豆分离蛋白-葡聚糖混合物与低分子表面活性剂竞争吸附导致吸附在油滴表面的大豆分离蛋白减少。
尽管前人已对模拟乳液体系中表面活性剂取代界面蛋白质的能力及微观过程开展了较多研究,但通常仅局限于分析表面活性剂类型、蛋白质种类或表面活性剂与蛋白质浓度比对界面蛋白取代率的影响,没有探究乳液中盐离子浓度及乳液体系的pH等关键环境因素对界面蛋白取代率的影响规律。本文以大豆分离蛋白和吐温20为研究对象,分析影响界面蛋白取代率及乳液稳定性的关键因素(吐温20添加量、乳液pH及离子强度、吐温20添加次序等),为进一步探索表面活性剂取代界面蛋白质的机制提供理论依据。
1 材料与方法
1.1 试验材料
大豆分离蛋白:实验室自制(蛋白质含量为82.3%,N=5.71)。大豆油:中粮黄海粮油工业有限公司。其他试剂均为分析纯。
TG1850-WS离心机;FA25高速乳化均质机;BT-9300S激光粒度分布仪;KDN-1凯氏定氮仪;FV3000激光扫描共聚焦显微镜,奥林巴斯(中国)有限公司。
1.2 试验方法
1.2.1 大豆蛋白乳液制备及单因素试验设计
参照李伟伟[8]的方法制备大豆蛋白乳液。精确称取1 g大豆分离蛋白,溶解于80 mL 0.2 mol/L磷酸盐缓冲溶液中,室温下磁力搅拌2 h制备蛋白溶液,取20 mL大豆油与蛋白溶液混合,在高速乳化均质机10 000 r/min下乳化4 min,得到大豆蛋白乳液。通过改变吐温20添加量、调节pH及NaCl浓度、改变吐温20添加次序,分析关键环境因素对吐温20取代大豆分离蛋白的影响。
1.2.2 大豆蛋白乳液粒径测定
选用激光粒度分布仪测定大豆蛋白乳液粒径,设定物质折射率实部1.472,物质折射率虚部0.1,介质折射率1.333。用滴管吸取大豆蛋白乳液用蒸馏水稀释内循环缓慢滴加至遮光率5%~7%之间,采用自动测试模式测定粒径。以乳液粒径D3,2为指标进行分析。
1.2.3 界面吸附蛋白浓度及界面蛋白取代率的测定
参照Zhang等[9]的方法,稍作修改。将大豆蛋白乳液振荡后,取25 mL于离心管中,室温下12 000 r/min离心30 min。用注射器小心移取下层清液至另一个新的离心管中,再次离心(12 000 r/min,30 min),收集下层清液。用凯氏定氮法测定清液中蛋白质含量(N=5.71)。界面吸附蛋白浓度(Γ)按照公式(1)计算。
(1)
式中:Γ为界面吸附蛋白浓度,mg/m2;MP/O为吸附蛋白与油质量比;SSA为油滴的比表面积。
SSA按照公式(2)计算。
(2)
式中:D3,2为乳液粒径;ρoil为大豆油密度,0.917 g/cm3。
界面蛋白取代率按公式(3)计算。
(3)
式中:M0为未加吐温吸附蛋白的质量,g;M1为加吐温后吸附蛋白的质量,g。
1.2.4 大豆蛋白乳液的微观结构观察
采用激光扫描共聚焦显微镜观察大豆蛋白乳液的微观结构。借鉴Heilig等[10]的方法稍作改动。将均质前吐温20添加量(w吐温20/v乳液,下同)分别为0%和1%的乳液离心去除水层,4℃放置1 d后取乳化层稀释10倍后,取1 mL加入10 μL异硫氰酸荧光素(FITC),混合均匀,取8 μL到载坡片上并盖上盖玻片,观察时倒置于激光扫描共聚焦显微镜的卡槽上。FITC的激发波长为488 nm,图像分辨率为1 024×1 024。
1.2.5 数据统计
所有试验重复3次,数据均以“平均值±标准差”表示,数据处理采用SPSS软件。
2 结果与讨论
2.1 吐温20添加量对取代界面大豆分离蛋白的影响
在1.2.1制备的大豆蛋白乳液中分别添加0%~2%的吐温20,混合均匀,水浴恒温振荡器100 r/min振荡1 h,考察吐温20添加量对取代界面大豆分离蛋白的影响,结果见图1、图2。

注:图中不同字母表示具有显著性差异(P<0.05),下同。
图1 吐温20添加量对Γ的影响
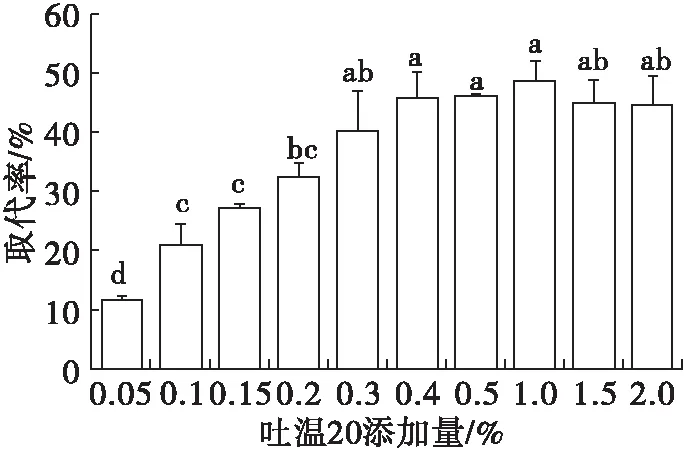
图2 吐温20添加量对界面蛋白取代率的影响
Chabrand等[11]报道,在水剂法(AEP)期间形成的大豆蛋白乳液的Γ较高,为14.65 mg/m2。Tcholakova等[12]指出,1~2 mg/m2的Γ是形成单层油滴的最小覆盖率,以确保乳液的稳定。Puppo[13]、Guo[14]等分别报道,大豆分离蛋白乳液中的饱和Γ为3.03 mg/m2,甘薯蛋白乳液中的饱和Γ为1.81 mg/m2。由图1可知,不添加吐温20大豆蛋白乳液的Γ为5.90 mg/m2,说明大豆油滴界面覆盖了多层蛋白质。随着吐温20添加量的加大,大豆蛋白被吐温20从界面取代下来,油水界面蛋白含量降低,在吐温20添加量为1%时,Γ最小,为3.02 mg/m2,接近大豆蛋白乳液中油滴表面单层的饱和覆盖量(1~2 mg/m2)。这说明油滴表面蛋白因为吐温20作用后已经从多层吸附变为单层吸附。由图2可知:吐温20添加量在0.05%~1%时,随着吐温20添加量的增加,大豆蛋白被吐温20从界面上取代下来,取代率逐渐增大;在吐温20添加量为1%时,取代率最高,为48.87%,再加大吐温20添加量,取代率基本不变。说明吐温20不能完全将大豆蛋白从界面取代下来,这与Yi等[15]报道中即使在最高表面活性剂添加水平(1%吐温20)下,仍然存在一些吸附的酪蛋白(0.07 mg/m2)结果相似。但两者取代后的Γ差异比较大,可能与蛋白分子形状不同有关,大豆蛋白是球蛋白,结构紧密,而酪蛋白是线状蛋白,分子柔性好,表面疏水性强,可能更容易与吐温20结合而被取代。
2.2 pH对取代界面大豆分离蛋白的影响
在1.2.1制备的大豆蛋白乳液中不添加和添加0.5%的吐温20,将乳液pH分别调至3、7、9和11,水浴恒温振荡器100 r/min振荡30 min,考察pH对吐温20取代界面大豆分离蛋白的影响,结果见图3、图4。
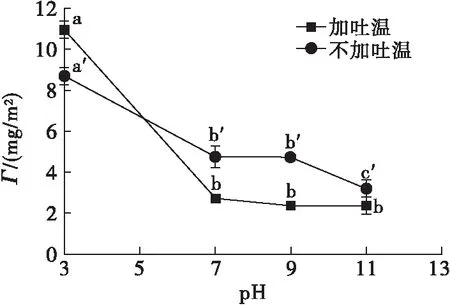
图3 pH对Γ的影响
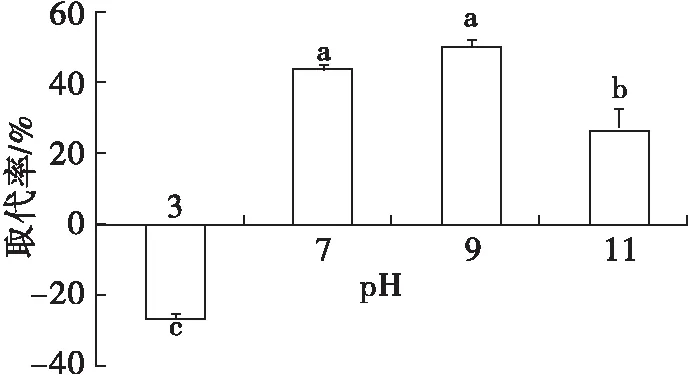
图4 pH对界面蛋白取代率的影响
由图3可知,对于不添加吐温20的大豆蛋白乳液,随着pH升高Γ逐渐降低。分析原因可能是酸性pH接近大豆蛋白的等电点,大豆蛋白分子之间的相互排斥作用较弱,导致Γ显著增加,此外pH 3时水相中蛋白质可能会发生变性而疏水性增强[16],从而更容易吸附到界面上;而碱性条件远离大豆蛋白的等电点,分子间排斥作用强,导致Γ降低。加入吐温20后,中性或碱性条件下大豆蛋白乳液的Γ均显著降低,但pH 3时Γ却不降反升,可能有两个方面的原因:①在酸性条件下,蛋白分子形成的界面膜更加致密牢固,即使加入吐温20,对界面蛋白的取代作用十分有限;②pH 3时水相中蛋白质发生变性,分子展开后疏水基团和界面上的吐温20相互作用增强,导致Γ增加[17]。由图4可知,在中性或碱性条件下,界面蛋白易被吐温20取代,可能由于在高pH条件下界面上蛋白质分子之间相互排斥作用加剧,导致形成的界面膜机械强度低,因而容易被小分子表面活性剂通过竞争吸附所取代。在pH为7~9时,取代率都比较高,而pH为11时取代率降低,这是由于pH 11条件下,未加吐温20时乳液的Γ(3.21 mg/m2)就已经很低。
2.3 离子强度对吐温20取代界面大豆分离蛋白的影响
按照1.2.1方法,采用10 mmol/L磷酸盐缓冲液溶解大豆分离蛋白,避免磷酸盐浓度过大对NaCl作用产生干扰,在不添加吐温20和吐温20添加量为0.5%的乳液中分别加入NaCl,使NaCl浓度在0~0.9 mol/L,水浴恒温振荡器100 r/min振荡30 mim,考察离子强度对吐温20取代界面大豆分离蛋白的影响,结果见图5、图6。
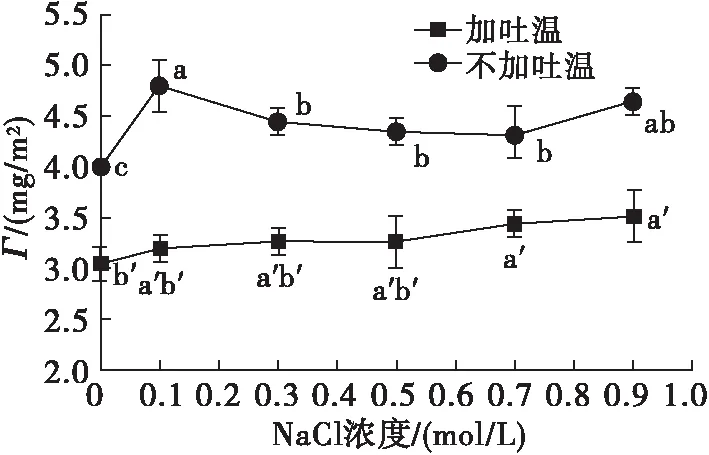
图5 NaCl浓度对Γ的影响
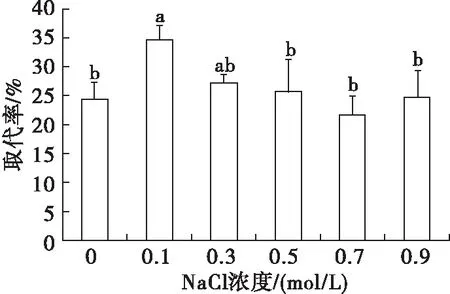
图6 NaCl浓度对界面蛋白取代率的影响
由图5可知,不添加吐温20时添加0.1 mol/L NaCl的乳液Γ较大,而加大NaCl浓度后Γ减小(可能与盐溶作用增强有关)。与不添加NaCl相比,添加NaCl的乳液Γ升高,可能是因为提高离子强度会掩蔽蛋白质自身所带的电荷[18],减少界面上分子间静电排斥所致。加入0.5%吐温20后,Γ随NaCl浓度的增大有轻微增加趋势,但变化不显著,与未添加吐温20的乳液相比前者Γ均显著下降。由图6可知,在NaCl浓度为0.1 mol/L时,界面蛋白取代率最高,无NaCl或NaCl浓度过高都没有获得较高的取代率。
2.4 均质前添加吐温20对吐温20取代界面大豆分离蛋白的影响
按1.2.1方法均质前在蛋白溶液中添加0%~2%吐温20制备大豆蛋白乳液,水浴恒温振荡器100 r/min振荡30 min,考察均质前添加吐温20对吐温20取代界面大豆分离蛋白的影响,结果见图7、图8。

图7 均质前添加吐温20对Γ的影响
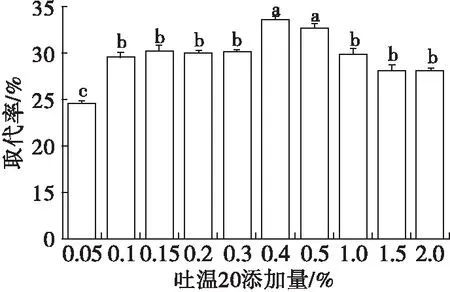
图8 均质前添加吐温20对界面蛋白取代率的影响
由图7可知,均质前添加吐温20,Γ显著降低,但增大吐温20添加量后Γ无显著性差异,这与图1中均质后增大吐温20添加量能使Γ逐渐降低的结果不同。由图8可知:吐温20添加量在0.05%~0.3%时,界面蛋白取代率较低;吐温20添加量在0.4%~0.5%时,取代率较高,再加大吐温20添加量到1%~2%,取代率反而变小,这与图2中吐温20高添加量时取代率基本保持不变的结果有所差异。与均质后添加吐温20试验结果相比(界面蛋白最高取代率为48.87%),均质前添加吐温20界面蛋白的最高取代率仅有33.93%。这说明吐温20添加次序显著影响乳液界面蛋白的取代程度。
2.5 大豆蛋白乳液的粒径及储藏稳定性
在1.2.1制备的大豆蛋白乳液中分别添加0%、0.05%、0.15%、0.2%、1.0%的吐温20,混合均匀,水浴恒温振荡器100 r/min振荡30 min。按1.2.1方法均质前在蛋白溶液中分别添加0%、0.05%、0.15%、0.2%、1.0%的吐温20制备大豆蛋白乳液,水浴恒温振荡器100 r/min振荡30 min。考察吐温20添加次序对乳液粒径的影响,结果见图9。

图9 吐温20添加次序对乳液粒径的影响
由图9可知,均质前添加吐温20,吐温20添加量对新鲜乳液粒径无显著影响。而均质后添加少量吐温20就能使乳液粒径显著变小,吐温20添加量超过0.15%后,再加大吐温20添加量,粒径无明显变化。吐温20在乳化过程中会和蛋白质进行界面竞争吸附,如果制备O/W型乳液时在均质前添加吐温20,由于小分子表面活性剂的界面吸附速度快于蛋白质分子,形成的吐温20-蛋白质复合界面膜近油相表面可能以吐温20分子为主,而近水相表面则以蛋白质分子为主。如果在均质后添加吐温20,乳化过程中只有蛋白质分子参与界面膜的形成,随着后期吐温20分子的界面取代作用,形成的吐温20-蛋白质复合界面膜近水相表面可能会覆盖大量的吐温20分子。这些吐温20分子有效降低了油滴之间界面蛋白的疏水相互作用,从而阻止了油滴的相互聚集。这可能是均质后添加吐温20使乳液粒径显著变小的主要原因。
图10、图11分别为均质前后添加吐温20的大豆蛋白乳液的储藏稳定性情况。

注:从左到右吐温20添加量分别为0%、0.2%、0.5%、1.0%、2.0%。
图10 均质前添加吐温20的乳液储藏期情况
注:从左到右吐温20添加量分别为0%、0.05%、0.15%、0.2%、1.0%。
图11 均质后添加吐温20的乳液储藏期情况
由图10可知,均质前不同吐温20添加量样品之间的短期乳化稳定性差异较大,吐温20低添加量下乳液稳定性比吐温20高添加量时好,吐温20的存在显著降低了乳液稳定性。
由图11可知:新鲜乳液均未出现分层情况;乳液放置4 h后开始分层;放置8 h后,有明显分层,继续放置至24 h,乳液基本无变化。由试验结果可知,均质后无论添加吐温20与否,乳液的短期储藏稳定性差异较小,各样品分层都较快,这可能是因为制备乳液时吐温20未参与高压均质所致。
综合以上结果可知,不论是均质前还是均质后添加吐温20,大豆蛋白乳液的界面蛋白都会被部分取代,但是添加次序对乳液稳定性的影响显著不同。推测其原因可能是:均质前添加吐温20,由于吐温20分子在均质时快速吸附到界面(蛋白质吸附慢),油滴界面膜很难拥有相对完整的蛋白质吸附层,这将导致乳液快速发生分层(图10);均质后添加吐温20,吐温20分子对油滴界面蛋白质的取代是从界面膜近水相表面开始,虽然部分蛋白会被取代,但最终界面膜近油相表面仍可能保持相对完整的蛋白质吸附层,乳液不至于很快失稳分层(图11)。Kaltsa等[19]研究了不同比例乳清蛋白(WPI)与吐温20稳定的O/W型乳液的相分离(均质前添加),发现两周之内,不同混合比例形成的乳液稳定性都较好,吐温20含量的高低并不影响乳液稳定性。这与本试验结果存在差异,原因可能与乳化剂种类及乳化方式不同有关。
2.6 大豆蛋白乳液的微观结构
FITC可与蛋白质分子的游离氨基发生亲核反应,通过共价结合形成稳定显绿色荧光的偶联物[10]。用0.01%FITC分别染色均质前吐温20添加量为0%和1%的大豆蛋白乳液,其激光共聚焦图片见图12。

注:(a)为吐温20添加量0%;(b)为吐温20添加量1%。
图12 大豆蛋白乳液的激光共聚焦图片
由图12可知,未加入吐温20的大豆蛋白乳液油滴四周有明显的光晕,说明油滴的界面层含有较多的蛋白质。而加入1%吐温20后,在相同染色条件下油滴四周几乎看不到光晕,说明界面吸附蛋白含量较未加入吐温20的样品显著减少,说明吐温20能将部分蛋白从界面取代下来。
3 结 论
吐温20添加量、乳液中NaCl强度及乳液体系的pH等均能影响界面蛋白的取代率,但吐温20不能将大豆分离蛋白完全从界面取代,这可能与大豆蛋白具有较紧密的构象有关。吐温20添加次序对界面蛋白的取代率及乳液稳定性的影响显著不同。均质后添加吐温20,界面蛋白的最高取代率为48.87%,而均质前添加吐温20,界面蛋白的最高取代率为33.93%。在当前大豆蛋白乳液制备条件下,均质后添加吐温20几乎不影响乳液稳定性,而均质前添加吐温20则随着吐温20添加量增加乳液失稳更快。通过激光扫描共聚焦显微镜观察发现,加入吐温20后的乳液界面吸附蛋白层明显变薄。
