超声改性豌豆蛋白乳状液稳定性的研究
2020-02-26丁芳芳田少君常慧敏章绍兵
丁芳芳,田少君,常慧敏,章绍兵
(河南工业大学 粮油食品学院,郑州450001)
豌豆是仅次于大豆的第二大食用豆科植物,含有20%~30%的蛋白质[1]。豌豆蛋白氨基酸组成符合FAO/WHO的建议模式,与大豆蛋白相比,具有相似或者更高的必需氨基酸含量[2-3],其赖氨酸含量较高,不易致敏,是近年来新兴的一种优质植物蛋白。但豌豆蛋白在大规模商业生产时,蛋白质发生热变性,功能性质(溶解性、乳化性等)变差,不利于豌豆蛋白的利用。目前我国大多数厂家商业生产加工豌豆的重点仍是豌豆淀粉的提取,豌豆蛋白仅作为副产品[4],造成豌豆蛋白资源的浪费。
超声波产生的空化作用对蛋白分子可产生机械性断键,从而影响蛋白的功能特性,使蛋白质分散液均匀分布,显著改善乳状液的粒径,提高乳化性[5]。Sui等[6]在超声功率150 W、超声时间24 min条件下处理大豆蛋白,乳状液表现出更好的乳化活性和乳液稳定性。Mccarthy等[7]研究发现,超声处理1%豌豆蛋白可形成较小液滴的乳状液。目前,对豌豆蛋白研究较多的是其凝胶性质,对不同条件(pH、温度、酶解、高压和超声等)下豌豆蛋白的乳化性也有报道,然而对豌豆蛋白乳状液在冷藏期间的物理稳定性鲜少研究。
本课题采用超声对豌豆蛋白进行改性,并将改性产物制备成乳状液进行冷藏,进一步测定乳状液体系的稳定性,包括粒径、Zeta电位以及储藏期间絮凝状态等理化性质,并从改性前后豌豆蛋白二级结构的变化,分析乳化性提高的原因,旨为豌豆蛋白乳状液的制备及在食品中的应用奠定基础。
1 材料与方法
1.1 实验材料
豌豆蛋白粉,山东烟台东方蛋白科技有限公司(蛋白质湿基含量77.82%);玉米油,山东三星玉米产业科技有限公司;其他试剂均为化学纯或分析纯。
K1160全自动凯氏定氮仪;磁力搅拌器;恒温水浴振荡器;722S可见分光光度计;PHS-3C型精密酸度计;LGJ-25型冷冻干燥机;超声波细胞粉碎机;高速剪切乳化机,德国 Fluko流体机械制造公司;BT-9300激光粒度分布仪;傅里叶红外光谱仪,美国Nicolet公司;APV-2000 高压均质机,德国APV仪器公司;正置落射荧光显微镜。
1.2 实验方法
1.2.1 豌豆蛋白基本指标的测定
粗蛋白质含量测定,GB/T 5009.5—2010,半微量凯氏定氮法;粗脂肪含量测定,GB/T 5009.6—2003,索氏抽提法;水分含量测定,GB/T 5009.3—2010,直接干燥法;灰分含量测定,GB/T 22427.1—2008。
1.2.2 超声改性豌豆蛋白
用蒸馏水配制一定质量浓度的豌豆蛋白溶液,调pH至7,室温下磁力搅拌2 h,置于超声波细胞粉碎机中用直径为0.6 cm的超声波探头插入溶液中间深度处理,并确保在超声过程中探头处于液面以下同一高度,工作参数为工作 4 s、间歇 2 s、温度控制在20℃以下,设置超声功率和超声时间,为减少热效应采用冰水浴进行控温。超声处理结束后,一部分豌豆蛋白溶液使用蒸馏水稀释至5 mg/mL测定其乳化活性和乳化稳定性,另一部分豌豆蛋白溶液经冷冻干燥用于结构的测定。
1.2.3 豌豆蛋白乳化性的测定
根据Pearce等[8]的方法稍加改进进行测定。配制质量浓度为5 mg/mL的样品溶液,取玉米油和上述样品溶液(体积比1∶6),置于高速剪切乳化机中10 000 r/min均质2 min,分别在放置0、10 min时,从测试管底部取样50 μL,用0.1%SDS稀释100倍,涡旋振荡10 s,以SDS溶液为空白并测定500 nm处的吸光度。乳化活性(EAI)用0时刻吸光度A500表示,乳化稳定性(ESI)用下式计算。
ESI=At/A×100%
式中:A和At分别表示乳液放置0、10 min的吸光度。
1.2.4 豌豆蛋白乳状液冷藏稳定性的测定
使用蒸馏水稀释最佳超声改性条件制备的豌豆蛋白、未超声处理的豌豆蛋白至质量浓度为5 mg/mL,分别与大豆油以体积比6∶1混合,于10 000 r/min剪切2 min,然后50 MPa高压均质循环2次。得到的乳状液加入0.02%叠氮钠作为抑菌剂,于4℃贮藏15 d内分别测定在储藏期间的Zeta电位、粒径变化趋势,并对其微观结构进行观察。
1.2.4.1Zeta电位分析
根据 Chanamai 等[9]的方法,略有改动。取10 μL豌豆蛋白乳状液,以蒸馏水将乳状液稀释至质量分数0.05%,采用激光粒度分布仪测定豌豆蛋白乳状液(25℃)的Zeta电位。
1.2.4.2 粒径分析
选用激光粒度分布仪测定粒径,设定实部折射率1.43,虚部折射率0.1。用胶头滴管吸取乳状液缓慢滴加至遮光率为8%~10%,参考实时粒径变化分析选取测量值,以乳状液粒径D50为指标。
1.2.4.3 微观结构的观测
取出一定量冷藏15 d的豌豆蛋白乳状液,用适量蒸馏水稀释,在显微镜下放大400倍观察并分析豌豆蛋白乳状液的颗粒分布。
1.2.5 傅里叶红外光谱(FTIR)分析
取2 mg样品和200 mg KBr混合,研磨均匀后制作透明薄片,以纯KBr为参照样,室温干燥环境进行傅里叶红外光谱扫描,扫描范围400~4 000 cm-1。对豌豆蛋白的红外吸收曲线进行二级求导,光谱数据用Peakfit4.12软件进行分析。参考Wang等[10]的方法对豌豆蛋白二级结构进行鉴定:α-螺旋结构,1 650~1 658 cm-1;β-折叠结构,1 600~1 640 cm-1;β-转角结构,1 660~1 700 cm-1;无规卷曲结构,1 640~1 650 cm-1。
1.2.6 数据统计与分析
实验重复3次,结果表示为“平均值±标准差”。采用IBM SPSS Statistics 20软件对数据进行单因素方差分析,如果方差分析差异性显著(P<0.05),则使用Duncan’s进行多重比较。采用Origin8.5软件进行图表制作。
2 结果与讨论
2.1 单因素实验
2.1.1 超声时间的影响
固定豌豆蛋白质量浓度为30 mg/mL、超声功率为300 W,考察超声时间对豌豆蛋白乳化性的影响,结果见图1。
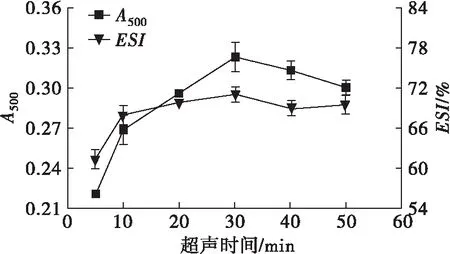
图1 超声时间对豌豆蛋白乳化性的影响
从图1可以看出,超声时间在5~30 min的范围内,豌豆蛋白乳化活性逐渐升高,在30 min达到最大,且乳化活性呈明显增加的趋势,而乳化稳定性增加幅度较小。当超声时间超过30 min后,乳化活性和乳化稳定性稍下降。在一定超声时间范围内,可溶性蛋白含量增加,乳化能力增强,但超声时间过长,蛋白质变性程度增大,不溶性蛋白含量增多,乳化活性和乳化稳定性随之降低,这与邵悦等[11]的研究结果一致。
2.1.2 豌豆蛋白质量浓度的影响
固定超声时间为30 min、超声功率为300 W,考察豌豆蛋白质量浓度对豌豆蛋白乳化性的影响,结果见图2。

图2 豌豆蛋白质量浓度对豌豆蛋白乳化性的影响
从图2可以看出,豌豆蛋白质量浓度在30 mg/mL 时乳化活性和乳化稳定性均达到最大,之后随着豌豆蛋白质量浓度的增加略有下降。可能是因为在乳状液形成过程中,油水界面上蛋白质迅速吸附,两相的界面张力降低,促进乳状液液滴的形成,并起到油滴保护膜的作用,防止油滴被破坏,使乳状液处于稳定状态[12],因此随豌豆蛋白质量浓度的增加,乳状液稳定性增加,但当达到豌豆蛋白的饱和浓度后,多余的蛋白由于彼此间的电荷排斥反而会破坏乳状液的稳定性[2],致使乳化性稍微下降。
2.1.3 超声功率的影响
固定豌豆蛋白质量浓度为30 mg/mL、超声时间为30 min,考察超声功率对豌豆蛋白乳化性的影响,结果见图3。
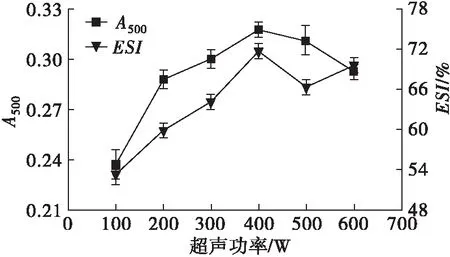
图3 超声功率对豌豆蛋白乳化性的影响
从图3可以看出,豌豆蛋白的乳化活性和乳化稳定性均随着超声功率的增大而增加,在超声功率400 W时达到最大。这可能是因为超声功率增大时,蛋白质结构的完整性被破坏,造成空穴,蛋白质分子结构变得疏松,乳化性提高。但在超声功率超过400 W后,蛋白质高级结构遭到破坏[5],使原来分子内部的疏水基团暴露于分子表面,从而乳状液溶解度降低,乳化性随之降低。
2.2 正交实验
在单因素实验基础上,以豌豆蛋白质量浓度、超声功率和超声时间为因素,以豌豆蛋白的乳化活性为指标,进行L9(34)正交实验。正交实验因素水平见表1,正交实验设计及结果见表2,方差分析见表3。
由表2可知,影响豌豆蛋白乳化活性的各因素主次顺序为A>C>B,即豌豆蛋白质量浓度>超声时间>超声功率。其中,豌豆蛋白质量浓度和超声时间对豌豆蛋白乳化活性具有极显著和显著影响。超声改性最佳条件为A2B3C3,即豌豆蛋白质量浓度30 mg/mL、超声时间40 min、超声功率500 W时乳化活性最好。在最佳工艺条件下,3次重复性验证实验得到豌豆蛋白乳化活性(A500)为0.331,乳化稳定性为72.52%。
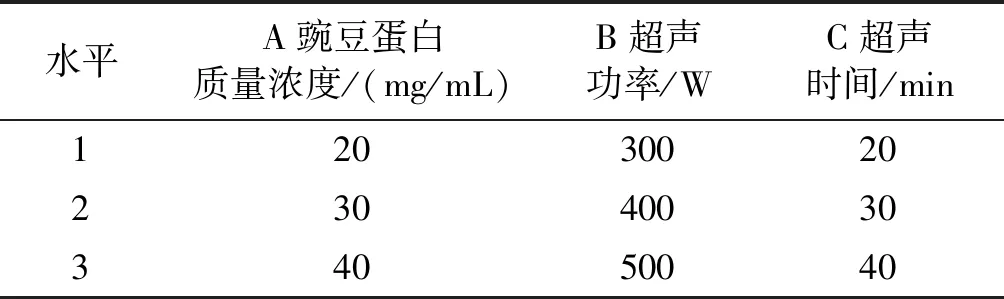
表1 正交实验因素水平
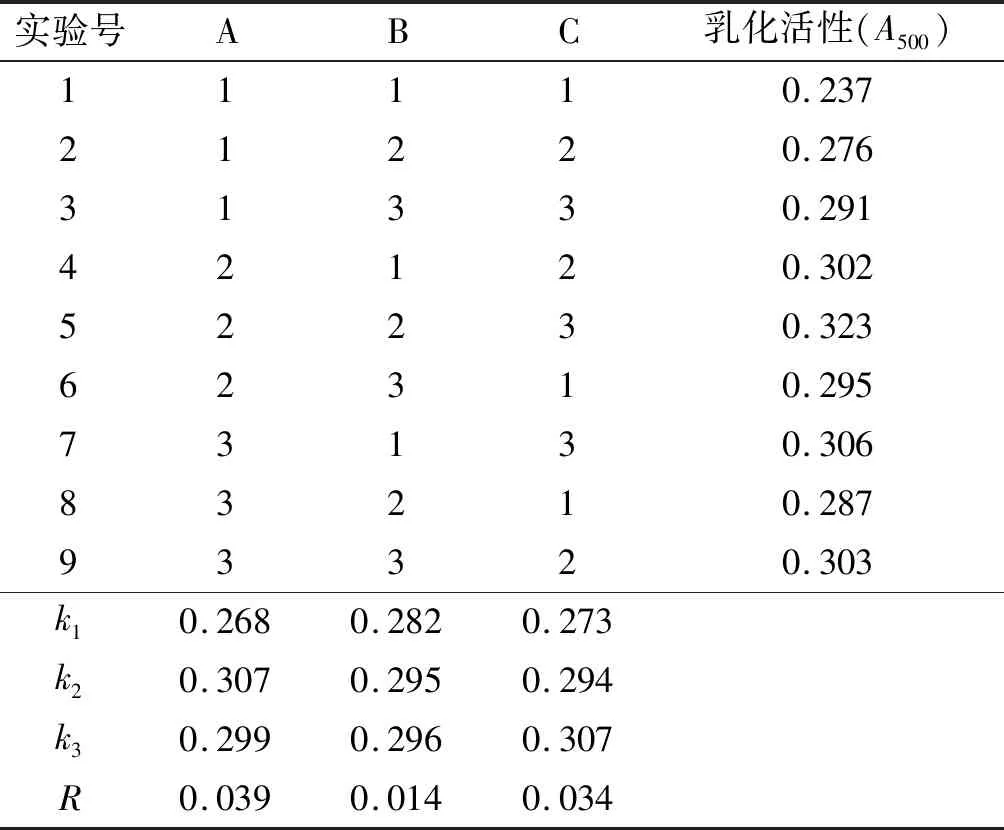
表2 正交实验设计及结果

表3 方差分析
注:F0.05(3,3)=9.28,F0.01(3,3)=29.46,*表示P<0.05,**表示P<0.01。
2.3 豌豆蛋白乳状液的冷藏稳定性
2.3.1Zeta电位的变化(见图4)
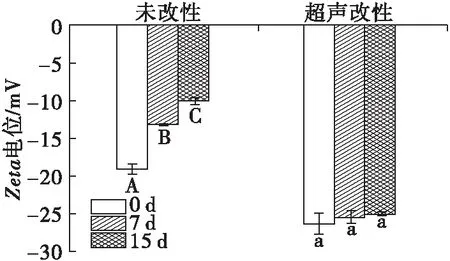
注:不同字母表示差异显著。
一般来说,当乳状液Zeta电位绝对值大于25 mV时,乳状液具有良好的静电排斥作用,能有效阻止乳状液在储藏期间发生液滴聚集现象。由图4可以看出:乳状液液滴表面都带负电荷;未改性豌豆蛋白乳状液Zeta电位绝对值为19 mV,超声改性豌豆蛋白乳状液Zeta电位绝对值为27 mV。分析原因是经超声改性后,暴露较多的带电基团,蛋白质分子携带电荷量增加,因此制得的乳状液具有更大的Zeta电位绝对值,乳状液稳定性增高[13]。4℃储藏期内,Zeta电位绝对值都有所降低,是由于离子相互作用使得液滴周围吸附蛋白质,导致所有样品Zeta电位的升高,从而引起静电斥力的降低。Taha等[14]研究发现由于蛋白质聚集体的形成,Zeta电位绝对值降低,这与本实验研究结果一致。对比发现冷藏期间未改性豌豆蛋白乳状液Zeta电位变化显著(-19 mV到-10 mV),超声改性豌豆蛋白乳状液Zeta电位变化较小(-27 mV到-25 mV),表明超声改性豌豆蛋白乳状液冷藏稳定性较好。
2.3.2 粒径的变化(见表4)
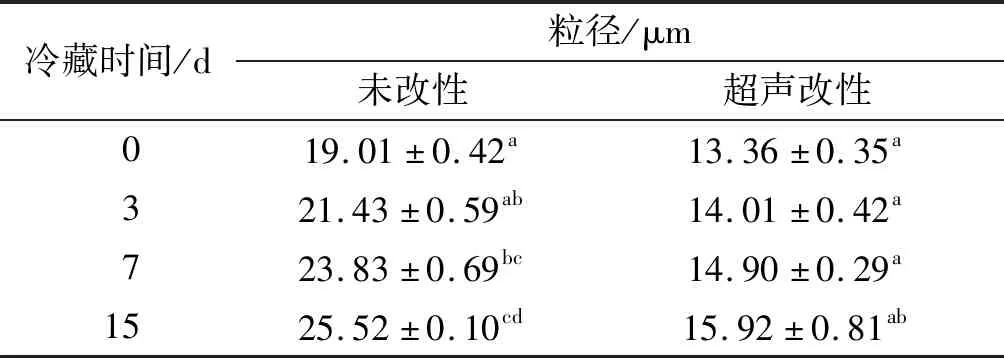
表4 超声改性前后豌豆蛋白乳状液冷藏期间粒径的变化
注:不同字母表示差异显著。
由表4可以看出,未改性豌豆蛋白乳状液粒径为19.01 μm,超声改性豌豆蛋白乳状液粒径减小至13.36 μm。因超声可产生空化,破坏蛋白质的疏水和静电相互作用,防止聚集物形成,促进小颗粒形成,从而促使蛋白质吸附在均质化过程的油滴表面。粒径的减小是因为具有较小尺寸的蛋白质更快地扩散到油滴表面,并且更容易重新排列以减少界面张力。Zhu等[15]研究超声作用核桃蛋白使得乳状液乳化活性指数和乳化稳定性增加,样品形成较小的液滴,这与本实验结果一致。随着冷藏(4℃)时间延长,乳状液粒径都有所增加,这是因为乳状液界面的静电屏蔽导致液滴间的排斥力降低,液滴发生部分聚集,使得乳状液平均粒径增加,储藏稳定性变差[16]。未改性豌豆蛋白乳状液平均粒径增加显著,超声改性豌豆蛋白乳状液平均粒径增长速度缓慢。结果表明超声改性豌豆蛋白能够显著降低乳状液在冷藏期间的粒径变化率。
2.3.3 乳状液的微观结构(见图5)
由图5可以看出,未改性豌豆蛋白乳状液冷藏15 d后发生明显絮凝,乳状液彼此聚集粘连成一团。超声改性豌豆蛋白乳状液相对稳定,有少量液滴发生聚集,液滴分散均匀,大小均一,呈现颗粒分明的状态。实验发现,乳状液粒径越小、Zeta电位绝对值越大,乳状液的絮凝现象越不明显。从微观角度证实了乳化性越高,液滴粒径越小,乳状液越稳定的结论。
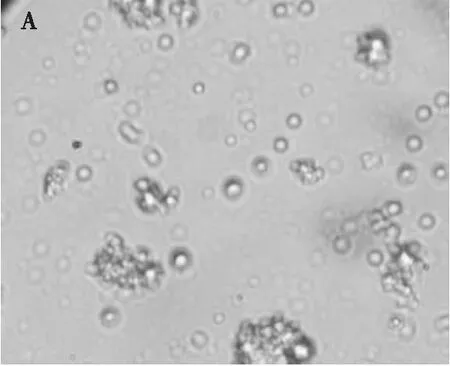
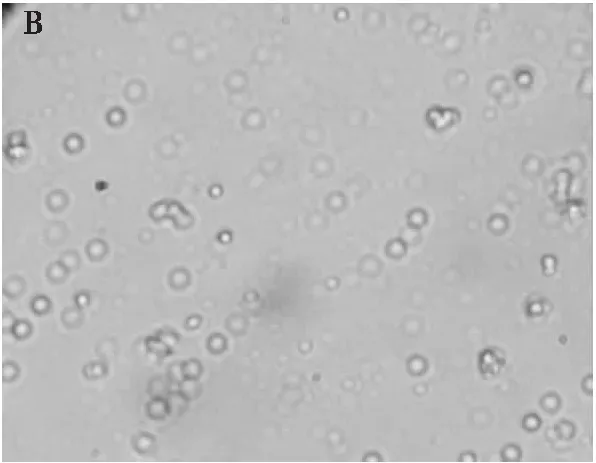
图5 未改性豌豆蛋白乳状液(A)与超声改性豌豆蛋白乳状液(B)的微观结构
2.4 超声改性前后豌豆蛋白的二级结构(见表5)

表5 超声改性前后豌豆蛋白的二级结构 %
由表5可以看出,经超声改性后,豌豆蛋白β-折叠和无规卷曲含量增加,而α-螺旋和β-转角含量减小,这与常慧敏等[17]的研究结果一致。β-折叠和无规卷曲含量与表面疏水性呈正相关,表明蛋白质变得更加疏松与伸展。α-螺旋和β-转角含量减少,增加了分子柔性,从而表现为乳状液中蛋白质能迅速吸附至油水界面,稳定更大的界面面积,与前文的乳状液粒径减小、Zeta电位绝对值增大和未发生明显絮凝现象相一致。表明超声处理能改善豌豆蛋白的功能特性,进而增加乳状液的稳定性。
3 结 论
正交实验优化得到豌豆蛋白超声改性最佳工艺条件为超声功率500 W、超声时间40 min、豌豆蛋白质量浓度30 mg/mL,在此条件下超声改性豌豆蛋白乳化活性(A500)为0.331,乳化稳定性为72.52%。超声改性豌豆蛋白乳状液表现为较小的粒径、较大的Zeta电位绝对值,无明显的絮凝现象,表明超声改性豌豆蛋白具有良好的冷藏稳定性。豌豆蛋白经超声改性后,β-折叠和无规卷曲含量增加,α-螺旋和β-转角含量减小,蛋白质结构发生伸展和重组,分子柔性增强。二级结构的变化说明超声改性改善了豌豆蛋白的乳化性。
