mTORC2在运动调节机体骨骼肌糖代谢中的作用研究进展
2020-02-26韩校傅力
韩校 傅力
天津医科大学医学技术学院康复医学系(天津300070)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一组高度保守的丝氨酸/苏氨酸(Ser/Thr)激酶,且为机体重要的能量感受器,参与机体细胞生长、代谢、存活以及自噬等重要生理过程[1]。此外,研究发现餐后胰岛素水平升高时,mTOR 也与肝脏、脂肪以及骨骼肌组织的代谢变化密切相关[2-5]。因此,mTOR信号传导途径失调可能会促进癌症、糖尿病发生发展以及衰老过程。本文主要针对mTOR结构、在代谢过程中的重要作用及其信号传导途径进行探讨。
1 mTORC2结构及其活性调节
在哺乳动物中,mTOR存在哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)和哺乳动物雷帕霉素靶蛋白复合物2(mammalian target of rapamycin complex 2,mTORC2)两种不同功能的复合物形式(见图1)[4]。Raptor是mTORC1的主要组成成分,在mTORC1亚细胞定位过程中发挥重要作用[6-8]。mTORC2的特殊组成成分 包 括Rictor[9]和mSin1[10]。mLST8 是mTORC1 和mTORC2 的共同组成成分,可促进两种复合物发挥作用。DEPTOR 也参与mTORC1 和mTORC2 的组成,但对其发挥抑制作用[11]。另一个与mTORC 相关的蛋白是PRAS40,可能参与生长因子和蛋白激酶B(protein kinase B,AKT/PKB)传导到mTORC1 和mTORC2 信号过程[11]。胰岛素(insulin)和胰岛素样生长因子(in⁃sulin like growth factor,IGF)等均可激活mTORC1和mTORC2,但mTORC2 激活的信号传导机制有别于mTORC1 途径[12]。磷脂酰肌醇-3 激酶(phosphoinosit⁃ide 3-kinase,PI3K)/Insulin 信号途径可促进mTORC2与核糖体结合,进而增加mTORC2 活性[13]。核糖体可作为磷酸化mTORC2 与底物发生作用的支架,也可给予mTORC2 适当定位,但激活mTORC2 具体机制仍有待阐明[14]。
在生理功能方面,越来越多的研究表明mTORC1在细胞生长以及营养稳态调节过程中发挥重要作用[11]。相比之下,mTORC2 对于营养不敏感,但可调节AGC 激酶家族成员,如AKT、蛋白激酶C(protein ki⁃nase C,PKC)以及血清和糖皮质激素调节激酶1(serum and glucocorticoid inducible kinase 1,SGK1),促进脂质生成、葡萄糖摄取、糖酵解以及细胞存活,从而参与机体糖、脂代谢稳态的调节[11]。因此,mTORC2 信号传导在防治胰岛素抵抗和2 型糖尿病的发生发展过程中发挥重要作用。
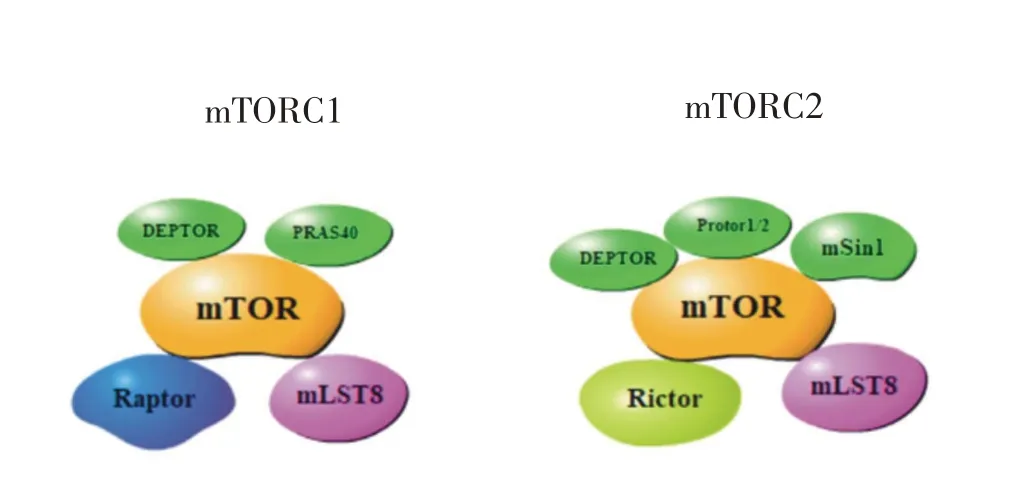
图1 mTOR 复合物组成示意图
2 mTORC2对机体骨骼肌代谢的调节作用
越来越多的证据表明mTORC2在机体组织代谢中发挥重要作用。在禁食状态下,肝脏可通过分解肝糖原和糖异生作用产生葡萄糖以维持血糖水平。在餐后状态下,肝脏停止产生葡萄糖,摄取循环系统中多余的葡萄糖以补充糖原和储存甘油三酯。胰岛素是机体调节餐后血糖水平的主要激素,可促进糖原合成、抑制糖异生和糖原分解,从而降低血糖。研究发现在肝脏特异性Rictor 基因敲除小鼠模型中,肝细胞AKT-Ser473位点磷酸化受抑制,同时葡萄糖激酶、固醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)活性降低,引起糖异生增强,糖酵解以及脂肪生成作用减弱[15],提示肝细胞mTORC2 信号紊乱会影响肝脏对机体代谢稳态的调节。
骨骼肌是机体葡萄糖利用的最主要组织,且骨骼肌胰岛素抵抗可能是导致2型糖尿病的重要因素。若骨骼肌及脂肪细胞摄取循环血中葡萄糖能力减弱,同时肝脏糖异生作用增强,胰岛β细胞释放胰岛素水平不足,则会引起机体血糖水平显著增高[16]。深入研究发现mTORC2可促进骨骼肌细胞葡萄糖转运蛋白4(glu⁃cose transporter 4,GLUT4)转位以及葡萄糖摄取[17,18];敲低Rictor的L6肌管细胞葡萄糖摄取能力较对照组显著降低[18]。此外,在骨骼肌特异性缺失Rictor的小鼠模型中发现该骨骼肌葡萄糖摄取能力下降以及糖原合成酶活性增加,并引起机体糖耐量下降[17]。与此相一致,脂肪组织特异性缺失Rictor引起脂肪细胞葡萄糖转运能力下降,且组织葡萄糖耐受下降、高胰岛素血症以及骨骼肌和肝脏胰岛素抵抗[5]。此外也有研究表明,小鼠棕色脂肪细胞特异性敲除Rictor 可抑制脂质从头合成(de novo lipogenesis,DNL)、促进脂质分解以及生热,并抑制饮食诱导的肥胖症和肝脏脂质沉积的进展[19]。总之,多项研究表明mTORC2 有利于机体组织细胞的脂肪生成和糖酵解,抑制脂肪分解以及促进葡萄糖摄取,进而参与全身代谢稳态的调控。因此,深入探究mTORC2的功能以及调节机制可为代谢性疾病提供理论依据。
3 mTORC2在运动调控骨骼肌糖代谢中的作用
耐力运动可通过诱导肌肉组织重塑,从而改善机体各组织器官的代谢变化。研究表明,耐力运动对机体各类健康指标具有实质性的益处[20]。在脊椎动物中,运动可增加线粒体的生物合成[21],降低甘油三酯的储存[22],改善胰岛素敏感性[23],并保护肌肉和神经功能[24]。研究认为,可能是运动通过上调腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和In⁃sulin/AKT 信号途径,从而引起机体代谢指标发生变化[25]。AKT 可以增强脂肪细胞和骨骼肌细胞GLUT4 转位,进而促进葡萄糖摄取。此外,AKT可引起糖原合成激酶3(glycogen synthase kinase 3,GSK-3)磷酸化,进而抑制其活性,降低糖原合成酶的磷酸化速率,增强糖原合成酶活性,从而提高糖原含量,此过程在骨骼肌和肝脏中尤其重要[26]。叉头转录因子-1(fork⁃head box transcription factor 1,FOXO1)在糖异生过程中发挥重要作用,同样,AKT 通过抑制转录因子FOXO1,进而调节组织葡萄糖稳态。此外,AKT 还是mTORC2 的下游底物,因此mTORC2 可能介导了AKT信号对葡萄糖稳态的调节。
有研究表明,给予骨骼肌组织特异性敲除Rictor基因的小鼠模型进行单次运动,发现骨骼肌葡萄糖摄取能力较正常对照组显著降低[27]。此外,长期有氧运动可增加骨骼肌Rictor-mTOR的结合并增强AKT-Ser473位点磷酸化[28]。这提示,mTORC2在运动调控骨骼肌细胞糖代谢中发挥重要作用。
4 mTORC2 参与运动调节骨骼肌糖代谢的可能机制
4.1 Rac1-mTORC2信号通路
Ras-相关C3 肉毒杆菌毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)是Rho GTP酶家族成员之一,可调控NADPH 氧化酶活性、肌动蛋白细胞骨架重构等生物过程。此外,研究表明Rac1在胰岛素和运动刺激骨骼肌葡萄糖摄取以及GLUT4转位过程中发挥重要作用[29]。骨骼肌特异性缺失Rac1的小鼠以65% VO2max的速度进行跑台运动时,其骨骼肌葡萄糖摄取能力下降,且肌膜上GLUT4表达量下降,该研究提示Rac1 可能通过调控GLUT4 转位,进而参与运动诱导的骨骼肌葡萄糖摄取[29]。此外也有研究显示mTORC2 可与Rac1 结合,参与运动促进骨骼肌葡萄糖摄取过程[27]。但目前在骨骼肌细胞研究mTORC2 与Rac1 两者关系的报道较少,该机制所涉及的信号途径仍需深入探究。
4.2 Sestrins-mTORC2/AKT信号通路
Sestrins 是一组高度保守的应激诱导蛋白,在哺乳动物体内存在3 种同系物(Sestrin1-3)[30]。Sestrins 的主要功能是降低活性氧(reactive oxygen species,ROS)[31]以及抑制mTORC1[32]。多项研究表明Sestrins参与机体代谢稳态的调节。高脂饮食诱导的肥胖小鼠和瘦素缺乏诱导的遗传性肥胖小鼠模型实验表明,Ses⁃trin2在维持肝脏胰岛素敏感性中发挥重要作用[33]。在脂毒性状态下,肝脏Sestrin2 表达选择性增加,抑制mTORC1活性,减轻内质网应激,从而减缓脂肪性肝炎的发生发展[34]。Sestrin3同样可以调节肝脏胰岛素敏感性,激活Insulin/AKT信号传导途径[35]。此外,Sestrins能够促进骨骼肌细胞AKT磷酸化以及增强葡萄糖摄取能力[36]。可见,多项研究提示Sestrins 可通过介导AKT 信号途径,进而调节机体糖代谢稳态。
Sestrins可通过多种信号途径激活AKT,如Sestrins通过抑制mTORC1,调节mTORC1/核糖体蛋白S6 激酶(ribosomal protein S6 kinase,S6K)负反馈抑制信号途径[37],从而激活胰岛素受体信号传导途径。在该机制中,mTORC1 持续性激活,引起S6K 依赖性胰岛素受体底物(insulin receptor substrate,IRS)丝氨酸位点发生磷酸化,从而减弱胰岛素受体到PI3K的信号传导[38]。因此,Sestrins抑制mTORC1,可间接促进PI3K/AKT信号传导[37]。此外,Sestrins 也可直接增强mTORC2 的活性,进而激活AKT。前期研究发现,Sestrin2 可与mTORC2 相互作用。同样,在最新体外mTORC2 激酶测定实验中发现,HpG2 细胞过表达Sestrin2 可显著增强mTORC2 的催化活性[39]。此外,Sestrin3 不仅可与Rictor 结合,也能增加肝细胞Rictor 与mTOR 结合,从而激活 mTORC2 以及增强AKT-Ser473 位点磷酸化[35]。研究发现,长期有氧运动可增强骨骼肌Sestrins 蛋白表达[36]。Lee 等发现Sestrins 在机体运动适应性以及运动改善机体胰岛素敏感性等方面发挥重要作用[40]。研究还提示,mTORC2/AKT信号途径可能对运动和Se⁃strin 均产生重要影响[40]。综上所述,mTORC2 在Ses⁃trins介导运动调节骨骼肌胰岛素敏感性过程中可能发挥重要作用。
虽然AKT 作为mTORC2 的底物,且该信号途径在mTORC2 维持机体代谢稳态中发挥重要作用。然而,有研究表明mTORC2促进骨骼肌细胞GLUT4转位以及葡萄糖摄取过程可不依赖于AKT/AS160 信号途径[18,41]。与该研究相一致,在小鼠棕色脂肪细胞特异性敲除Rictor研究中发现,mTORC2通过促进FOXO1去乙酰化调控脂质分解代谢[19],而非依赖于AKT 信号途径。Guertin等也发现白色脂肪细胞特异性敲除Rictor,脂肪生成转录因子碳水化合物反应元件结合蛋白β(carbo⁃hydrate response element- binding protein β,ChREBPβ)表达下降,导致脂肪酸从头合成减少及肝脏胰岛素敏感性受损[42]。该研究提示mTORC2 部分程度上通过调控ChREBPβ表达以及脂质从头合成,进而调节脂肪细胞葡萄糖摄取,而对总AKT(pan-AKT)信号途径未有影响[42]。mTORC2 不依赖于AKT 信号途径调节机体代谢过程可能有以下三种可能[42]:一是当机体缺失mTORC2,AKT 信号途径发生重新编程以克服依赖于mTORC2 的某些功能,某些无法克服依赖于mTORC2 功能的AKT 底物除外;二是仅部分AKT 底物需要依赖mTORC2 的激活,如AKT1-Ser473 和AKT2-Ser474 位点[19,42];第三种可能是mTORC2 不通过AKT信号途径,也能调节骨骼肌细胞代谢。因此,对于mTORC2的功能仍需不断深入认识。
5 结论
规律运动具有促进骨骼肌糖代谢、改善胰岛素抵抗等积极作用,但其具体机制尚不完全明确。运动可促进骨骼肌细胞mTORC2 的表达和活性,但mTORC2是否介导了运动改善机体骨骼肌胰岛素抵抗、调节代谢稳态及mTORC2调节骨骼肌糖代谢中的机制等均有待深入研究证实。因此,开展mTORC2 的功能研究将有助于揭示运动防治代谢性疾病的机理,同时为新药研发提供新的选择。
