冲击波对大鼠骨骼肌钝挫伤修复及IGF-1/PI3K/AKT信号通路的影响
2020-02-26吕欣曹宇周达岸
吕欣 曹宇 周达岸
锦州医科大学附属第三医院(辽宁锦州121000)
骨骼肌钝挫伤是体育锻炼中的常见损伤,多发于腓肠肌和股四头肌[1]。损伤处局部肌肉的收缩性能较损伤前会有所降低,并且周围肌肉再次损伤的概率也会增加。损伤初期组织周围水肿、炎性细胞浸润、肌纤维排列紊乱;当进展到修复期时,出现新生肌纤维和血管,早期瘢痕形成;到重塑期时,新生肌纤维粘附在细胞外基质,出现大量瘢痕[2-5]。骨骼肌损伤修复的病理进程离不开相关基因、蛋白及生长因子等的调控,它们的启动和传导又需要信号通路的激活。其中,IGF-1/PI3K/AKT 信号通路是重要途径之一。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是其重要调节起始点,磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)和蛋白激酶B(proteinkinase B,PKB,即AKT)能够被IGF-1 激活,从而调节细胞增殖、分化及蛋白合成等生理过程[6,7]。已有研究发现[8-10],PI3K/AKT 信号通路与骨骼肌的修复再生密切相关,不仅能够促进骨骼肌蛋白质合成,而且还能刺激更多肌卫星细胞(muscle satellite cells,MSCs)处于增殖状态,再生新的肌细胞,进而达到促进骨骼肌再生、修复损伤的作用。目前,以冲击波作为干预手段,通过该信号通路探讨骨骼肌损伤修复作用的相关研究较少。本研究以冲击波为干预措施,研究成肌分化抗原(myogenic differ⁃entiation antigen,Myod)、肌肉生长抑制素(Myostatin)和肌细胞生成素(Myogenin)在骨骼肌钝挫伤修复时的表达变化及冲击波对IGF-1/PI3K/AKT 通路的调控,探讨冲击波对骨骼肌钝挫伤的作用效果和可能治疗机制,为临床治疗及科学研究提供思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和分组
由锦州医科大学SPF(specific pathogen free)级实验动物中心购入21 只健康成年雄性SD(Sprague Daw⁃ley)大鼠,8~9 周龄,体重180 g ~200 g,饲养温度控制在20℃~25℃,相对湿度50%~60%,动物生产许可证号:SCXK(辽)2017-0003,整个实验操作过程符合伦理标准。适应性饲养1 周后,采用随机数字表法将21只大鼠分为正常组、模型组和治疗组,每组6 只,其中随机选取3只大鼠检验造模是否成功。
1.1.2 主要试剂及仪器
Myod1 一抗、Myogenin 一抗(美国,abcam)、Myo⁃statin 一抗(武汉,三鹰),IGF-1 一抗、PI3K(p85)一抗、AKT 一抗、p-AKTSer473 一抗(南京,Biogot),GAPDH(北京,博奥龙),山羊抗兔二抗(美国,Earthox),West⁃ern blot 相关试剂(上海,碧云天),电泳及转膜仪(美国,BIO RAD 公司),凝胶图像扫描及分析系统(美国,BIO RAD公司),免疫组化相关试剂(北京,索莱宝),体外冲击波治疗仪(瑞士,EMS公司),自制钝挫伤重物打击造模装置。
1.2 实验方法
1.2.1 造模方法
依照Markert等[11]的造模方式,自行设计钝挫伤重物打击造模装置。打击物重260 g,下落高度90 cm,重力为2.55 N,动能为2.29 J,打击头面积约1 cm2。大鼠双侧小腿后侧毛在造模前12 h 用电动剃毛刀剃除,腹腔注射2.5%戊巴比妥钠溶液,根据大鼠体重麻醉(0.2 ml/100 g),俯卧位固定于鼠板上,双后肢置于伸膝位、踝背屈90°,并且呈稍外展位固定,暴露腓肠肌中段,用纱布垫将后肢垫起,避免后肢悬空造模时发生骨折。
造模成功标准:钝挫伤局部皮肤无开放性破损,腓肠肌肿胀,胫腓骨无骨折,无反常活动(如图1),造模后大鼠可行走,呈轻微跛行步态。
造模后12 h随机选取3只大鼠进行HE染色,光镜下可见肌细胞破碎,排列不规则,炎症细胞浸润等肌纤维损害标志。
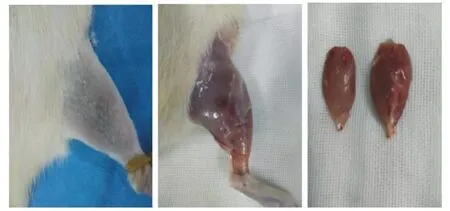
图1 骨骼肌钝挫伤造模后模型组腓肠肌(右图为正常组与模型组对照)
1.2.2 干预措施及取材
正常组大鼠不作任何处理;模型组大鼠造模后不进行冲击波治疗;治疗组大鼠于造模后24 h采用冲击波刺激,作用于大鼠腓肠肌中段。设定参数:能流密度0.14 mJ/mm2,频率10 Hz,冲击次数500次,间隔3 d再次治疗,于第2次治疗后即刻对各组的6只大鼠进行取材检测。2.5%戊巴比妥钠溶液麻醉后,取各组腓肠肌,每组中的3只大鼠取材后的腓肠肌置于4%多聚甲醛溶液中固定18~24h,再放入30%蔗糖溶液中脱水,冰冻切片,进行HE 染色和免疫组织化学(immunohistochemis⁃try,IHC)检测;每组中另外3只大鼠的腓肠肌组织于−80 ℃冰箱储存,用于免疫印迹(Western blotting,WB)检测。
1.2.3 HE染色方法
腓肠肌组织冰冻切片,横切8 μm,依次将切片置于苏木精染色液3 min,分化液30 s,自来水15 min,伊红染色液1 min,然后梯度酒精脱水,二甲苯透明,中性树胶封片。在20×光学显微镜下观察并采集图片。
1.2.4 免疫组化方法
冰冻切片横切,PBS 冲洗,擦掉周围液体,用组化笔圈出样品;滴加0.3%甲醇双氧水,避光30 min;PBS洗;山羊血清室温封闭1 h,滴加稀释的Myostatin 一抗50 μL(3% BSA-PBS 稀释,1︰200),4℃过夜;PBS 冲洗;滴加二抗(1︰3000 稀释),室温孵育1 h,PBS 洗,5分钟×3次;DAB显色,显微镜下观察染色程度,待细胞着色,背底颜色浅时吸去,PBS 洗10 min;复染,分化,梯度酒精脱水,透明,封片。应用Image Pro Plus 分析Myostatin的阳性表达。
1.2.5 免疫印迹法
取各组标本100 mg,于PBS溶液中剪碎,加入适量蛋白裂解液、蛋白酶抑制剂后匀浆,4 ℃,12000 r/min,离心30 min,取上清液,蛋白定量,100℃煮沸。SDSPAGE电泳,90 V 30 min,110 V 90 min,至溴酚蓝电泳至底部时终止电泳,进行转膜,300 mA 90 min,7%脱脂奶粉置于室温2 h,TBST 洗膜后分别放入Myod1(1︰1000)、Myostatin(1︰1000)、Myogenin(1︰500)、IGF-1(1︰1000)、PI3K(p85)(1︰500)、AKT(1︰500)、p-AKTSer473(1︰500)、GAPDH(1︰3000)一抗稀释液中4 ℃摇床孵育过夜;TBST 洗膜,二抗(1︰10000 稀释)室温1 h;洗膜,显影,成像。Image J软件分析各个目的蛋白的条带灰度值。
1.2.6 统计学方法
SPSS 24.0 软件对不同组别数据进行分析,以均数± 标准差(±s)表示,采用单因素方差分析(Oneway ANOVA)和LSD 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 造模结果
大鼠造模后,钝挫伤局部即腓肠肌中段肿胀,皮肤无开放性破损,胫腓骨无骨折,无反常活动,轻微跛行步态。
2.2 HE染色结果
正常腓肠肌组织横切面肌细胞排列整齐,胞浆呈均匀粉红色,细胞核呈蓝色,少量且均匀分布于肌细胞边缘(如图2A);模型组较正常组可见细胞排列间隙增宽,肌卫星细胞迁移至细胞质或损伤处周围,出现肌丝及新生的单核或多核肌小管(如图2B);治疗组较模型组相比,肌卫星细胞多数均匀迁至细胞边缘,间隙变小,并且多核肌小管增多(如图2C)。

图2 3组腓肠肌组织形态(HE染色,×200,标尺=50 μm)
2.3 免疫组化结果
Myostatin 在细胞质中散在表达,正常组表达较少(如图3A,表1)。模型组出现分布不均匀的棕黄色阳性表达,与正常组相比表达显著升高(如图3B,表1)(P<0.01)。给予冲击波干预后,治疗组Myostatin 的阳性表达减弱,与正常组相比无显著性差异(P>0.05);与模型组相比,治疗组Myostatin 表达显著降低(如图3C,表1)(P<0.05)。

图3 3组腓肠肌Myostatin表达情况(免疫组化,×200,标尺=50 μm)

表1 各组大鼠Myostatin表达量比较(n=3)
2.4 各组大鼠IGF-1/PI3K/AKT 信号通路及成肌相关因子的蛋白表达
由图4和表2可知:与正常组相比,模型组和治疗组PI3K、p-AKT 和AKT 的蛋白表达均升高(P<0.05),IGF-1 蛋白表达量明显增加(P<0.01);与模型组相比,治疗组IGF-1 和p-AKT 的蛋白表达升高(P<0.01),PI3K 和AKT 的蛋白表达与模型组相比差异不具有统计学意义(P>0.05)。

图4 各组大鼠检测指标免疫印迹图
由图4和表3可知:与正常组相比,模型组Myo⁃genin 蛋白表达量增加(P<0.05),Myostatin 蛋白表达明显增加(P<0.01),Myod1 蛋白表达虽然增加,但不具有统计学意义(P>0.05);治疗组Myod1 和Myogenin 与正常组相比蛋白表达增加(P<0.01),Myostatin 相比于正常腓肠肌表达差异无统计学意义(P>0.05)。与模型组相比,治疗组Myod1 蛋白表达增加(P<0.01),Myogenin蛋白表达增加(P<0.05),Myostatin 蛋白表达下降(P<0.05)。
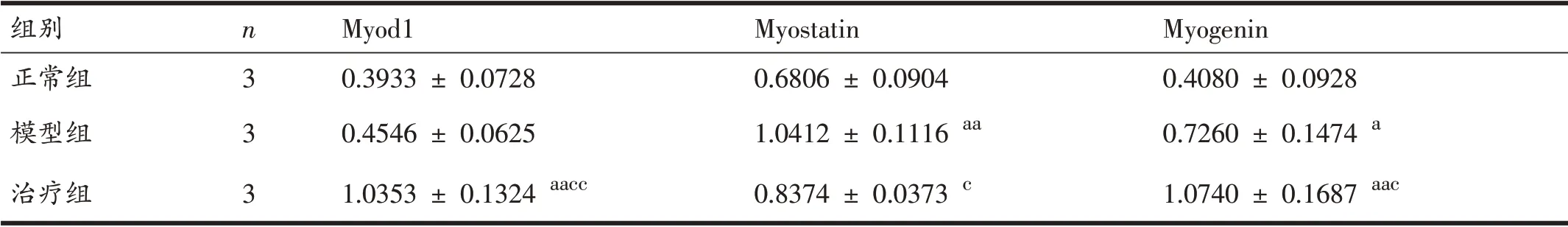
表3 各组大鼠Myod1、Myostatin和Myogenin蛋白表达量比较
3 讨论
骨骼肌钝挫伤是较为常见的运动损伤之一,是由突发的强大冲击力所导致的闭合性肌肉损伤。钝挫伤后腓肠肌血肿并且出现炎症反应,损伤修复过程主要依靠激活更多肌卫星细胞,促进成肌相关指标的表达,形成新生的单核或多核肌小管,逐渐融合成新的肌纤维[12]。以往研究表明,IGF-1/PI3K/AKT 信号通路的激活在促进成肌相关指标表达方面起着至关重要的作用,通过PI3K 蛋白激酶级联反应后磷酸化AKT,调控肌卫星细胞增殖与分化[9,13]。
本次实验应用的冲击波干预强度经过前期实验筛选[14,15],最终确定为0.14 mJ/mm2、10 Hz、冲击次数500次。冲击波通过其具有力学性质的高频高速振动而产生的机械波作用于受损局部肌肉,通过力-化学信号的刺激,增加组织密度,促进肌卫星细胞增殖与分化,最终使治疗靶点内损伤腓肠肌组织再生,修复损伤[16-18]。HE染色结果显示,冲击波治疗后原本迁至细胞质和损伤周围的肌卫星细胞逐渐均匀散布在细胞边缘,并且多核肌小管增多,说明冲击波治疗对骨骼肌损伤的修复再生具有一定程度的促进作用。Myostatin是骨骼肌再生的负性影响因子,其表达减少能促进骨骼肌再生[19],并且有研究表明Myostatin与IGF-1呈负相关性表达[8]。免疫组化和Western bloting 结果显示,模型组与治疗组的Myostatin 蛋白表达均高于正常组,且治疗组表达低于模型组,说明冲击波治疗能够抑制腓肠肌钝挫伤后的Myostatin 蛋白表达。有研究[20]显示,高频振动能够下调废用性肌萎缩时Myostatin 的蛋白表达,促进肌萎缩的修复,这与本研究结果一致,并且冲击波使IGF-1蛋白表达增加,可能通过直接和间接的双重影响作用,降低Myostatin蛋白表达量。
当钝挫伤发生后,肌卫星细胞的增殖分化状态被激活。Myod1 是肌细胞增殖标志物,本研究结果提示Myod1 正常组和模型组差异无统计学意义,可能是由于取材时Myod1表达已处于升高后的下降水平。以往研究表明,Myod1在骨骼肌损伤进展过程中,在损伤后第1天或第3天表达量达到最高,第5天时下降至与正常组相比无统计学意义,与本研究结果一致[21,22]。冲击波治疗后Myod1 蛋白表达明显高于正常组和模型组,这与Zissler 等[23]研究结果一致,可能是冲击波高频的机械振动促使其表达增加。刘宇等[21]研究表明,Myod1在小鼠骨骼肌损伤后第14天达到第2个表达高峰,因此,也有可能是冲击波治疗使Myod1 第2 个表达高峰提前。Myogenin是标志肌卫星细胞分化的指标之一,骨骼肌损伤3~5天时,肌卫星细胞开始融合成肌小管[21,22,24]。本研究中模型组表达增加,且HE染色显示出现肌小管,治疗组Myogenin表达量较模型组增加,多核肌管增多,可以推断冲击波在肌卫星细胞分化方面具有一定影响作用,一定程度促进了肌卫星细胞融合成肌管的过程。
本研究结果表明,冲击波治疗不能提高骨骼肌钝挫伤后PI3K和AKT的表达,但可提高腓肠肌钝挫伤后IGF-1 和p-AKT(Ser473)的水平,激活肌细胞内的IGF-1/PI3K/AKT 信号通路,且有研究表明冲击波对该信号通路具有一定调控作用[25]。IGF-1 是肌纤维形成的早期启动子,能增强成肌细胞的增殖,也是激活PI3K/AKT信号通路的关键起始因子[9,26]。在正常生理状态下,PI3K在细胞内的表达水平很低,但当细胞损伤时,受IGF-1 的调控,PI3K 活化,同时表达水平快速升高[27]。损伤时,PI3K 的p85 调节亚基被募集,相较正常时表达增加,与p110亚基结合,PI3K活化,促使4,5-二磷酸磷脂酰肌醇(PIP2)转变为3,4,5-三磷酸磷脂酰肌醇(PIP3)[10,28]。PIP3作为第二信使[29],招募磷酸肌醇依赖性蛋白激酶1(PDK1)和AKT 信号蛋白,三者互相结合,通过Ser473位点的磷酸化而激活,调节细胞生长因子来促进细胞存活[30]。经冲击波干预后,该条信号通路被更大程度激活,调控Myod1、Myogenin 表达增加,Myostatin表达减少,增强骨骼肌再生修复。
本研究结果提示,IGF-1 /PI3K/AKT 信号通路的激活很可能参与了冲击波治疗骨骼肌钝挫伤的作用机制,通过该通路调控相关成肌因子的表达,从而修复损伤。
4 结论
本研究对冲击波治疗骨骼肌钝挫伤的作用机制进行了初步探讨,结果表明冲击波能够上调IGF-1 的表达,进一步调控p-AKT 磷酸化水平,激活IGF-1/PI3K/AKT 信号通路,调节成肌相关指标Myod1、Myostatin 和Myogenin的变化,从而促进肌卫星细胞的增殖与分化,对钝挫伤后骨骼肌的再生修复起到正向调节作用。
