生长因子在半月板修复中的应用研究进展
2020-02-26游茗柯罗俊容付维力
游茗柯 罗俊容 付维力
四川大学华西医院骨科(成都610041)
1 前言
半月板是膝关节的重要组成部分,发挥着重要作用,包括负载、传递、减震、稳定、营养分配和本体感觉输入等[1]。半月板常因运动损伤和年龄等因素发生变性而受损,并且因为内部血管化区域有限,导致其愈合能力相对较低。由于半月板损伤后自体再生能力较差,半月板切除术是目前最常见的治疗方式。然而,切除后可能会导致关节不协调,并对相邻的软骨造成明显的压力,可能会导致软骨过早的变性等[2],半月板切除术的并发症还可能最终导致骨关节炎(osteoarthri⁃tis,OA)的发生[3]。因此,利用细胞生物学、生物材料科学和生物工程领域的先进技术,结合干细胞、生物相容性支架和相关生长因子来实现半月板纤维软骨功能和稳定性的再生十分重要[4]。
半月板再生所需要的条件包括:修复细胞、支架材料以及起生化刺激作用的生长因子。迄今为止,在半月板组织工程中已经检测到各种细胞类型,如骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)、滑膜间充质干细胞(synovial-derived mesenchy⁃mal stem cells,S-MSCs)、半月板纤维软骨细胞和软骨细胞等[3]。支架材料可分为天然生物材料和人工合成材料,且两种材料在半月板修复中均有重要应用。在人工合成材料中,一类为具有修复半月板撕裂的生物可降解组织胶粘剂,它们比缝合线更便宜,也更易使用,在愈合期间该材料可将组织的撕裂部分保持在一起,待愈合相对完全后会降解成无害的化合物,通过代谢等方式从体内排出[5]。生长因子通常被定义为:能够刺激细胞生长和分化的天然物质,是后生动物细胞存活的重要调节因子[6]。生长因子最初被发现是由于它们能够在无血清完全培养基中激发静止细胞的有丝分裂[7]。生长因子的作用可概括为促进细胞增殖、迁移、分化、成熟等,并且其作用特点是在靶区快速扩散和作用后快速失活。生长因子是自分泌、旁分泌和内分泌机制的一部分,最常见的生长因子包括表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、血小板源性生长因子(platelet-derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)[8]。
本研究检索Pubmed数据库、Ovid数据库、ELSEVI⁃ER 数据库,检索式为“(((((meniscus)OR menisci))AND((((((Intercellular Signaling Peptides and Pro⁃teins)) OR Paracrine Peptide Factors) OR Peptide Factors,Paracrine) OR Paracrine Protein Factors)OR Growth Factors)) AND ((((((((Stem Cells)OR Cell,Stem)OR Progenitor Cells)OR Cell,Pro⁃genitor) OR Mother Cells) OR Cell,Mother) OR Colony- Forming Unit) OR Colony- Forming Units))”。对检索文献进行统计分析,结果显示,有关半月板再生的细胞因子包括:胰岛素样生长因子(IGF)、转化生长因子(TGF-β1、TGF-β3)、成纤维细胞生长因子(FGF)、碱性成纤维细胞生长因子(ba⁃sic fibroblast growth factor,bFGF)、血小板源性生长因子(PDGF)、血管内皮生长因子(VEGF)、白细胞介素-1(interleukin,IL-1)、基质细胞衍生因子-1(stro⁃mal-derived factor-1,SDF-1)、肝细胞生长因子(hepa⁃tocyte growth factor,HGF)、结缔组织生长因子(con⁃nective tissue growth factor,CTGF)、骨成型蛋白(bone morphogenetic protein,BMP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、软骨素酶-ABC(enzymatic chondroitinase-ABC)、粒细胞集中刺激因子(granulocyte concentration of stimulators,G-CSF),共14种。本文详细介绍的与半月板再生有关的生长因子主要有:胰岛素样生长因子-1(IGF-1)、转化生长因子(TGF-β1、TGF-β3)、血小板源性生长因子(PDGF)、成纤维细胞生长因子(FGF)。
2 常见生长因子及其作用
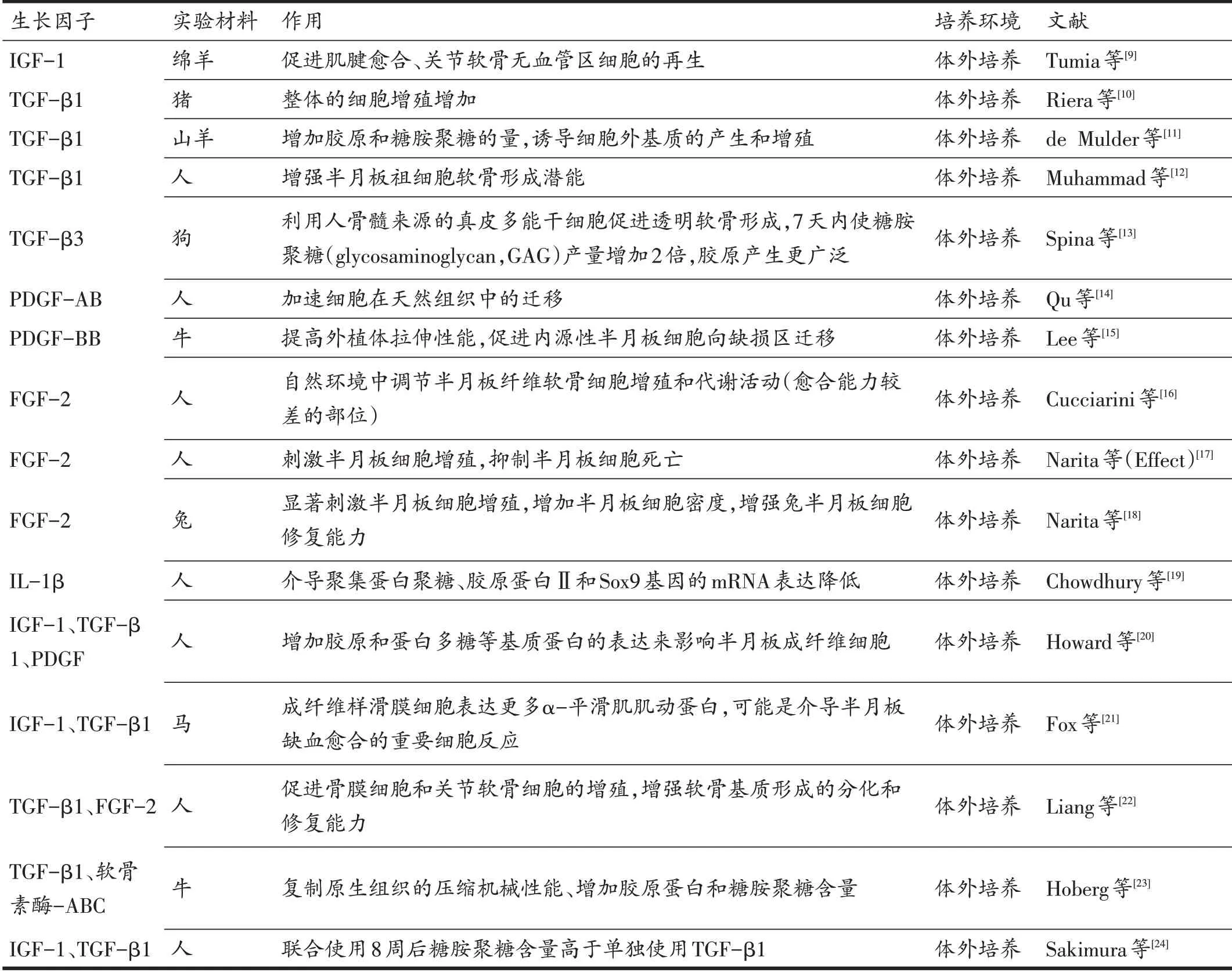
表1 常见半月板再生相关生长因子种类及作用
2.1 IGF-1
生长因子IGF-1 主要通过促进细胞增殖、促进GAG 和Ⅱ型胶原生成、增加蛋白多糖的合成速率来发挥作用[20]。
Bonnevie 等[25]的实验结果显示,含IGF 的实验组GAG 含量远超过对照组,且半月板表面初步形成包含局部纤连蛋白、Ⅱ型胶原蛋白和润滑物质的表面层物质,而该种表面层润滑物质由关节软骨细胞中润滑油素合成的增多所致,通过促进边界润滑,提高组织置换的效率,大幅提高润滑性能,从而减少组织间的磨损及恶化,有利于半月板组织的再生。
Fox[21]等在研究中发现,在IGF-1 与TGF-β1 的共同作用下,成纤维样滑膜细胞表现出成纤维软骨的巨大潜能,促进Ⅱ型胶原和聚集蛋白聚糖生成量显著增加。该实验表明,这两种生长因子具有诱导软骨形成的潜力。同时,在实验中成纤维样滑膜细胞(fibro⁃blast-like synoviocyte,FLS)表达增加,生成了更多的α-平滑肌 肌动蛋白(α-smooth muscle actin,α-SMA),可能介导无血管区半月板的再生愈合。但在增加的Ⅱ型胶原中,细胞种子支架并没有显示出明显的基质的细化。
有实验显示,IGF-1还具有刺激纤维软骨细胞活性的能力,用以保持半月板所有区域(包括无血管区)细胞的增殖和促进细胞外基质(extracellular matrix,ECM)的形成。其中,无血管区细胞对IGF-1的添加作出积极反应[26,9]。而Ruiz[27]的实验则指出,IGF-1 是强有力的有丝分裂原,可促进半月板胶原合成,IGF-1在血管区可发挥作用,但在无血管区无作用。
2.2 TGF-β
生长因子TGF-β参与调节多种细胞的生命过程,包括细胞的生存、生长、增殖、迁移、分化、凋亡以及合成和降解ECM、促进无血管区GAG和Ⅱ型胶原蛋白的合成、促进无血管区半月板的撕裂修复和工程材料在体内的成熟和整合。
TGF-β的培养方式可分为单层培养、外植体培养或半月板细胞播种在支架上培养[22]。de Mulder 等将TGF-β接种于聚氨酯支架的山羊半月板纤维软骨细胞上,通过观察其生物学特性和力学性能的变化发现,TGF-β对于细胞增殖和细胞外基质的产生都有很强的诱导作用[11]。同时,有研究发现,TGF-β可增加半月板细胞的增殖和积累,增强OA 软骨细胞的软骨形成,还确定TGF-β信号可控制耐药突变预防浓度(mutation preventive concentration,MPC),从而导致Sox9基因的表达增加、Runt相关转录因子2(runt-related transcrip⁃tion factor 2,RUNX 2)基因的表达降低[12],使半月板综合的修复能力得到进一步提升[22]。
Spina 等将加入TGF-β1 与不加入TGF-β1 的培养基作对比[13],发现含TGF-β1 的培养基中GAG 含量相较于无TGF-β1组显著增加,并且ECM含量的增加速度也比不含TGF-β组更快。与此相似,Chen 等[28]的实验结果显示,在众多生长因子中,TGF-β1 增加胶原蛋白和GAG 合成的能力最强,且合成物质的量最多。TGF-β1 同时还显著提高了α-SMA 半月板细胞的数量,而α-SMA在细胞收缩中起关键作用,对于半月板损伤后修复具有重大意义。
TGF-β3 的连续添加[2]可刺激基质沉积,提高修复界面的基质密度从而提高整合度,同时增加细胞数量,促进半月板的修复再生,促进半月板间修复性结构的进一步形成。
研究发现[29],应用结缔组织生长因子(connective tissue growth factor,CTGF)和转化组织生长因子β3(TGF-β3)诱导间充质干/祖细胞(MSCs)的募集和逐步纤维软骨分化,可显著改善了半月板损伤的愈合。Tarafder 等采用聚乳酸-羟基乙酸(poly lactic-co-gly⁃colic acid,PLGA)微球来控制TGF-β3 的释放速率,发现高剂量(1000 ng/ml)的CTGF和缓慢(0.29± 0.1 ng/day)的TGF-β3 释放应用于半月板外植体模型对无血管区半月板的综合愈合最为有效,可使半月板组织的胶原纤维排列、纤维软骨基质形成和机械性能均得到一定程度的改善[29]。短期释放CTGF 可招募局部间充质干细胞,与缓释TGF-β3 形成纤维软骨结合,进而诱导中间纤维的纤维软骨愈合[29]。
Szojka 等[30]研究发现,缺氧环境和TGF-β3 协同可介导纤维软骨细胞形成内半月板样基质干/祖细胞募集治疗半月板损伤。
Fox[21]的研究则认为,TGF-β需要与其他生长因子联合用于半月板修复再生治疗,并且指出,TGF-β参与的半月板修复治疗的副作用包括滑膜纤维素增生、炎症性白细胞增加以及刺激骨赘的形成等。
Spina 等的实验结果显示[13],单独使用TGF‐β3 比单独使用TGF‐β1可以更有效地利用骨髓来源的真皮多能干细胞(dermal muhipotent stem cells,dMSCs)来促进透明软骨的形成。Spina 等在7 天内通过检测含TGF‐β3 和TGF‐β1 的单层培养滑膜细胞,结果显示细胞GAG 含量较使用单一生长因子作用时增加了2倍,虽然胶原产生更为广泛,但并没有使软骨细胞外基质的产生增多。而TGF-β1、IGF-1、FGF-2三种生长因子两两组合或同时作用联合培养,对透明软骨的促进作用又较TGF-β3单独使用时更好。
Hidalgo Perea 等的实验表明,含有TGF-β和地塞米松(dexamethasone,Dex)的无血清培养基是间充质干细胞种子支架实验中最有前景的组合形式。该实验将半月板组织和间充质干细胞种子支架复合成缺损模型,结果显示无血清TGF-β和Dex 培养基可促进半月板组织蛋白多糖的生成,促进半月板组织的整体修复[31]。
Nakagawa等的研究表明,采用3D打印的生长因子聚己内酯(poly-ε-caprolactone,PCL)联合应用CTGF和TGF-β3 可刺激间充质干细胞向纤维软骨细胞系分化[32]。
2.3 PDGF
PDGF作为原丝分裂细胞的有丝分裂原,对半月板组织及细胞具有趋化作用,在半月板组织愈合中起重要作用,可促进细胞和原生组织的迁移[14]。PDGF-AB可吸引内源性细胞,增强其移动性和迁移能力,并且,在半月板已缺损时,PDGF-AB与胶原酶的释放可增加支架界面和支架内部的细胞密度,并与周围组织融合,在短期内增强细胞向伤口边缘的移动性,并在长期造成更好的支架定植和组织修复效果[14]。同时,PDGFAB与胶原酶的依次释放,可增加细胞的移动和细胞迁移。该实验还发现,半月板细胞的迁移量随细胞孔径的减小而减少,在存在不同浓度PDGF-AB的趋化梯度时尤为明显。而当孔径小于等于3 微米时,其细胞迁移不受孔隙大小和PDGF-AB浓度的影响。
PDGF 对软骨细胞和祖细胞也具有很强的趋化活性,可增强半月板细胞的增殖和生物合成。实验发现[15],PDGF可以通过与肝素的共价连接或静电相互作用固定在支架上持续释放,但在无血管区病变中,其活性及表达程度均降低。PDGF-BB 可招募其他缺陷区域细胞产生新的细胞外基质,增强细胞间连接的趋化作用,促进纤维软骨基质成分的合成。
与之前PDGF 表达增加促进半月板组织趋化作用的结果相反,Ruiz Iban[27]对比有血管区与无血管区半月板组织生长因子表达,发现PDGF-B 表达水平明显下降,这可能与其对之前的TGF、IGF 等生长因子发挥的促进作用进行干扰有关。
Su 等利用内侧半月板损伤的骨关节炎小鼠模型,发现骨关节炎关节软骨下骨/骨髓中的单核前骨细胞在内侧半月板切除术后很早就受到刺激,并产生大量的PDGF-BB,从而激活PDGF-β受体信号,以刺激骨关节炎的异常发育软骨下骨血管生成与成骨和神经生长的耦合,而血管侵入无血管软骨,是人类骨关节炎的早期诊断特征[33]。
2.4 FGF
FGF-21是一种由肝脏、脂肪组织和血细胞产生的脂肪因子/内分泌激素,具有抗炎和抗衰老的特性。FGF-21 与关节炎关系密切,FGF-21 通过减少一些促炎细胞因子,可减轻胶原诱导的关节炎。
FGF 的功能可基本概括为促进纤维软骨细胞增殖,增强体内半月板的修复,且作用与具有有丝分裂活性的生长因子作用一致。有研究[16]采用生化、免疫组化、组织学和组织形态学等分析方法,观察使用FGF治疗骨关节炎,对细胞增殖和存活、细胞外基质合成及α-SMA 收缩标志物表达的影响,发现FGF-2 尤其在愈合能力较差的区域和损伤部位的活性更高,其通过增强细胞的增殖率和存活率,使得治疗后半月板的撕裂幅度下降,α-SMA 的表达水平上升有助于半月板的再生修复。Liang[22]的实验表明,FGF-2 过度表达可刺激半月板纤维软骨细胞在体外大量增殖,且促进糖胺多糖在体外的合成,但不能促进黏多糖的合成。FGF-2 与TGF-β1 结合共同作用可促进骨膜细胞和人工关节软骨形成细胞的扩散比率进一步增加。同时,Liang等还发现,在缺氧(5% O2)的情况下,可通过使用FGF-2,提高肌成纤维细胞样细胞(myofibroblastic-like cell,MFLC)和关节软骨细胞的增殖率,进而提高软骨的分化能力。同时,上调MFLC 可促进胶原蛋白Ⅱ和聚集蛋白聚糖的表达。
而在对FGF的研究中,观察FGF-2与明胶水凝胶(gelatin hydrogels,GHs)结合后的作用也较为常用。生长因子通过与明胶分子的物理化学相互作用在明胶水凝胶中被固定化,水凝胶降解释放出固定化的生长因子,通过改变其交联的程度,可控制水凝胶的降解程度,即交联可以产生不同含水量的水凝胶,进而控制释放的固定化生长因子的速度和含量。GHs与FGF-2结合后具有更高的生物稳定性,能显著促进半月板细胞增殖,抑制半月板细胞死亡。Narita[17]的实验结果显示,FGF-2与GHs结合后,其诱导生物力学强度增加、表层增厚、细胞增殖速度增加。Narita[18]在家兔实验中发现两者结合后FGF-2显著增加了兔模型中半月板细胞的密度,并增强其修复能力。两项实验均证明FGF-2 为一种促生长因子而并非抗生长因子。
2.5 其他生长因子及其作用
2.5.1 肝细胞生长因子(HGF)
Hidaka[34]利用腺病毒载体介导的人肝细胞生长因子(adenoviral vector mediated human hepatocyte growth factor,Ad-HGF)进行基因转移,诱导组织工程半月板血管形成。用Ad-HGF 处理牛半月板细胞,将细胞接种于聚乙醇酸支架上,植入裸鼠皮下脂肪中,结果显示,移植后2 周,Ad-HGF 处理的半月板细胞形成高于对照组,提示HGF 基因在生物工程半月板组织中参与到局部组织血液供应的可能性。
2.5.2 IL-1
白细胞介素1β(IL-1β)是损伤关节局部炎症的主要介质。Chowdhury 等在实验中,将半月板细胞经IL-1β处理后共培养,检测到培养颗粒中Sox9 基因、Ⅰ型胶原和Ⅱ型胶原的表达明显高于未经IL-1β处理的纯培养组。与骨髓基质细胞(marrow stroma cells,MSCs)和骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)的单次培养相比,在MSCs 和BMSCs 协同培养软骨基质中,IL-1β不能消除共培养中积累的GAG 基质,但可介导聚集蛋白聚糖(aggrecan)、Ⅱ型胶原和Sox 9基因表达,并使相关表达活性降低[19]。
有研究显示,与对照组相比,IL-1β刺激半月板外植体可导致一氧化氮、基质金属蛋白酶的产生和活性以及相关细胞因子的产生显著增加[35]。
2.5.3 软骨素酶-ABC
用软骨素酶-ABC 和TGF-β1 处理半月板细胞和关节软骨细胞,与未进行TGF--β1处理的对照组比较,软骨素酶-ABC 和TGF-β1的联合处理使胶原含量、胶原密度和纤维直径明显增加,协同提高纤维软骨的杨氏模量和极限拉伸强度,形成了更致密的胶原基质,从而能够更好地承受拉伸载荷[36]。实验证明,软骨素酶- ABC治疗可能是通过交联增加胶原蛋白与胶原蛋白之间的相互作用完成的[37]。
MacBarb 等将不同的半月板细胞和关节软骨细胞共培养接种到琼脂糖孔中,分别用软骨素酶-ABC和合成代谢剂转化生长因子-β1(TGF-β1)进行处理。结果显示,与对照组相比,应用软骨素酶-ABC 和TGF-β1可使胶原含量增加。胶原密度和纤维直径也显著增加,分别比对照组增加32%和15%。力学测试发现,与对照组相比,实验组处理后可提高工程化纤维软骨的杨氏模量和极限拉伸强度。总之,这些数据表明软骨素酶-ABC 和TGF-β1相互作用,形成更致密的胶原基质,从而能够更好地承受拉伸负荷[38]。
2.5.4 内皮抑素
有研究结果显示[23],抗血管生成因子——内皮抑素在纤维软骨细胞培养的上清液中的表达增加,表明该生长因子可能限制半月板损伤后体内组织的再生能力。
Hoberg 等将内皮细胞与纤维软骨细胞进行共培养,发现联合培养后,纤维软骨细胞表达的抗血管生成因子内皮抑素的产量增加,对VEGF 信号通路有抑制作用,导致了在共培养中人脐静脉内皮细胞的增殖显著降低,由于伤口愈合需要足够的生理性血管生成,所以内皮抑素在软骨细胞中表达的增加可能是导致半月板血管分布较少区域愈合能力差的原因之一[23]。
2.5.5 多种生长因子联合培养
以动物为实验对象的一项研究[26]显示,PDGF-AB、PDGF-BB、TGF-β1和IGF-1在组织工程研究中的综合运用可能有助于促进半月板细胞在支架内的增殖和分化。Tsujii等[26]在实验中探讨生长因子对体外培养绵羊半月板软骨细胞的增殖以及对聚羟基乙酸(polyglycol⁃ic acid,PGA)支架内生长的半月板软骨细胞产生基质蛋白的影响,发现在含血小板源性生长因子(PDGF)-AB、PDGF-BB、胰岛素样生长因子(IGF)-I、转化生长因子-β1(TGF-β1)和碱性成纤维细胞生长因子(BFGF)的半月板软骨细胞培养基中软骨细胞数量明显高于对照组,而IGF-Ⅱ和骨形态发生蛋白-2对半月板软骨细胞的增殖无明显影响。随后检测发现,引起最大增殖反应的生长因子(PDGF-AB、PDGF-BB、TGF-β1和IGF-I)对PGA支架内OMC增殖和分化具有促进作用,并且所有生长因子均增加了半月板软骨细胞在支架内Ⅰ型胶原的生成量。该实验提示PDGFAB、PDGF-BB、TGF-β1和IGF-1的共同作用在半月板组织工程研究中可能有助于促进半月板细胞在支架内的增殖和分化。
在以人体为实验对象的研究中,已知IGF-1、TGFβ1和bFGF 分别对人胎儿半月板细胞的增殖有促进作用,而于体外培养人胎儿半月板纤维软骨细胞的实验发现,bFGF 和IGF-1、IGF-1 和TGF-β1 的组合对胎儿半月板细胞的增殖作用均优于单一生长因子,提示此组合可用于半月板种子细胞的体外扩增[36]。
而在成人半月板撕裂后无血管区的恢复重建中,Tarafder 等发现控制结缔组织生长因子(CTGF)和TGF-β3的含量,可以诱导无血管区半月板撕裂的无缝愈合以及进一步诱导滑膜间充质干细胞/祖细胞的分化[39]。
3 总结
生长因子与细胞之间的作用主要包括:通过促进GAG、Ⅱ型胶原的产生来促进细胞增殖;提高α-SMA半月板细胞数量,从而加速半月板再生;吸引内源性细胞,提高细胞的移动性和迁移能力等。且有研究发现[15],促进半月板损伤修复的细胞多存在于与撕裂部分邻近的半月板区域、滑膜、关节囊内。通过化学趋化因子的作用,如肝素,进行细胞募集,用于介导半月板撕裂后修复再生的能力。这些均有利于半月板损伤后的再生与修复,对组织工程半月板再生起到积极作用。
生长因子与支架材料之间的关系,除了需要支架材料作为承载区域限制生长因子发挥作用的范围,从而更有利于支架材料与原有组织相融合,提高修复速率外,部分支架材料还可与生长因子共同作用,增加反应的可行性,如生长因子与明胶水凝胶共同作用,可使该支架的生物力学强度增加,细胞增殖速度增加,更有利于损伤后的再生与修复工作。
生长因子作用于靶细胞的方式包括:粘附在特定的受体上,受体通过信号或信使系统触发并激活决定细胞增殖、分化和死亡的核基因[40],并在短时间内启动信号通路,产生合适的细胞外基质成分:I型胶原、Ⅱ型胶原和聚集蛋白等[21],进而发挥生长因子各项不同的功能及作用。
此外,我们还总结了生长因子的有无、含量变化、单独或联合培养的不同影响。如有研究使用成人滑膜来源的间充质干细胞在三维PGA 支架上培养,结果显示,在TGF- 1 和IGF-I 联合作用下,出现明显的软骨形成增强,表明成人滑膜可能是软骨工程应用中一个有前途的自体细胞来源[24]。
临床应用方面,半月板损伤的常见治疗方法包括同种异体移植、半月板切除等[41],在半月板再生方面的作用十分有限。目前很有希望的方法是基于支架的组织工程半月板。在近年的半月板损伤修复研究中,有实验[42]设计了一种新的骨形态发生蛋白受体Ⅰ型(BM⁃PRI)模拟肽CK2.1,且发现在含透明质酸的水凝胶颗粒中缓慢释放水凝胶-模拟肽,该种模拟肽可在不诱导软骨细胞肥大的情况下驱动软骨修复。且注射该模拟肽可增加Ⅸ型胶原和Ⅱ型胶原的产量,并对ECM 成分具有明显的修复作用。患有骨关节炎的患者其胶原骨架结构和机械完整性遭到破坏,而水凝胶-模拟肽的不断释放在促进受损软骨再生的同时,对骨关节炎的治疗也具有积极意义。该项研究表明,水凝胶-模拟肽颗粒不仅可以在不诱导软骨细胞肥大的情况下促进软骨再生,也可以作为退行性软骨疾病(如骨关节炎)的潜在治疗手段。
下一步要探讨半月板损伤的更精确有效的修复方法[26],为未来半月板损伤后的修复治疗提供技术支持和临床帮助。比如有研究显示[43],生长因子在体内无血管区半月板愈合方面并没有明显的改善情况,而其原因可能是体内生长因子的释放失控。因此,进一步研究的一个方向可能就是分析间充质干细胞生物活性物质的有效分泌模式,为生长因子在半月板缺损部位的特定应用开发出有效释放模式。
最后,半月板损伤及其修复的未来研究还应关注:首先,目前生长因子在半月板修复中的应用是否直接适用于所有的临床情况。第二,对于生长因子作用于半月板组织的实验研究所选择的评估方式是否精确可靠。
