脑心通胶囊中水蛭的特异性DNA鉴别*
2020-02-26朱晓枭胡恺恩邵鹏柱彭维苏薇薇
朱晓枭,胡恺恩,邵鹏柱,彭维,苏薇薇
(1. 中山大学生命科学学院/广东省中药上市后质量与药效再评价工程技术研究中心,广东 广州 510275;2. 香港中文大学李达三叶耀珍中医药研究发展中心,香港 沙田)
水蛭(Hirudo)来源为水蛭科动物蚂蝗(宽体金线蛭)WhitmaniapigraWhitman、水蛭(日本医蛭)HirudonipponicaWhitman或柳叶蚂蝗(尖细金线蛭)WhitmaniaacranulataWhitman的干燥全体;其功能主治破血通经,逐瘀消癥,主要用于治疗血瘀证[1]。近年来,由于江河污染以及人们对水蛭的滥捕滥捉,水蛭的野生资源日渐萎缩,目前多为人工养殖的水蛭商品。其中,养殖对象以宽体金线蛭为主,有少量的日本医蛭,尖细金线蛭极为罕见(目前市面上几乎没有)。此外,还有大规模养殖的伪品菲牛蛭PoecilobdellamanillensisLesson[2],严重影响了临床用药的安全性和有效性。因此,对水蛭的正品基原进行准确鉴定显得尤为必要。然而,传统的鉴别方法中,水蛭以性状和薄层鉴别为主[1],专属性和特异性都不强。对于含有水蛭的中成药,水蛭的性状特征消失,传统的鉴别方法则更难以满足实际工作需求。
随着分子生物学领域的迅速发展,DNA条形码分子鉴定技术应运而生,因其具备高特异性性,简单快速等特点,被广泛应用于市售中药材的鉴定[3-4]。近年来,有许多研究探讨了应用线粒体细胞色素c氧化酶亚基Ⅰ(COⅠ)、内转录间隔区(ITS)、ITS2、12S rRNA和16S rRNA等基因序列对蛭类动物进行分类鉴别的可能性[5-8],结果表明上述基因可以在不同程度上有效鉴定蛭类动物,以辨正伪。然而,这些研究均是采用上述基因的通用引物对水蛭药材、饮片或冻干体进行鉴别,对含水蛭的中成药中原料药材的分子鉴定(尤其是特异性鉴别)未见报道。
脑心通胶囊是由16味中药直接散粉制药而得的中药复方制剂,主要用于治疗心绞痛、心肌梗死等心脑血管疾病[9-11];水蛭为方中臣药之一。本研究以水蛭正品宽体金线蛭、日本医蛭以及伪品菲牛蛭作为研究对象,基于COⅠ基因设计了物种特异性引物,运用DNA分子鉴定技术对单味水蛭药材以及脑心通胶囊中的水蛭进行正品基原的鉴定,进一步提高了水蛭药材及含水蛭的中成药的质量控制水平。
1 材料与方法
1.1 材料
共收集市售水蛭商品22份(表1),其物种信息由广东省药品检验所鉴定并使用COⅠ通用引物(LCO1490:5′- GGTCAACAAATCATAAAGATATTGG -3′,HCO2198:5′- TAAACTTCAGGGTGACCAA- AAAATCA -3′)进行分子鉴定以核准。9批脑心通胶囊(编号NXT-1~NXT-9)由陕西步长制药有限公司提供。另根据2015年版《中国药典》(一部)(以下简称“药典”)中脑心通胶囊的制作工艺自制了缺水蛭的阴性对照药材(T4841)以及分别含日本医蛭和菲牛蛭的对照“脑心通胶囊”,分别编号NXT-12和NXT-18。样品均保存于中山大学生命科学学院。
1.2 仪器和试剂
数显型恒温金属浴(美国Labnet公司),Nanodrop 2000C超微量分光光度计(美国Thermo Fisher Scientific公司),96孔热循环仪(新加坡Applied Biosystems公司),5430R型多功能离心机(加拿大Eppendorf公司),JY600C型君意东方电泳仪(北京君意华鑫科技有限公司),Gel Doc tm XR+凝胶成像仪(美国Bio-Rad公司)。
组织/细胞基因组DNA快速提取试剂盒(货号DL107-01),广谱植物基因组DNA快速提取试剂盒(货号DL116-01),多功能DNA纯化回收试剂盒(货号DH103-01),蛋白酶K(20 mg/mL,货号SH405-01),2.5 mmol/L dNTPs(货号AP201-01),Taq DNA Polymerase(内含10×PCR缓冲液,25 mmol/L MgCl2溶液,5 U/μL的Taq DNA聚合酶,货号AT101-12),6×RNA/DNA Loading buffer(货号EL101-01)均购自北京博迈德基因技术有限公司,SYBRTMSafe DNA gel stain(货号S33102)和GeneRuler 100 bp DNA Ladder(货号SM0242)均购自赛默飞世尔科技(中国)有限公司。

表1 市售水蛭商品信息表Table 1 The information of Hirudo collected on the market
1.3 DNA提取
水蛭单味药材的DNA提取:取待测药材20~50 mg于灭菌后的1.5 mL离心管中,用消毒后的小剪刀将待测样品剪碎,按组织/细胞基因组DNA快速提取试剂盒说明书提取总DNA。
脑心通胶囊的DNA提取:取约50 mg脑心通胶囊细粉到1.5 mL灭菌离心管,加入400 μL缓冲液AP1(该缓冲液为广谱植物基因组DNA快速提取试剂盒中自带试剂)和20 μL蛋白酶K,按广谱植物基因组DNA快速提取试剂盒说明书提取总DNA。9批脑心通胶囊、缺水蛭的脑心通胶囊对照药材和分别含日本医蛭、菲牛蛭的脑心通胶囊对照样品均按上述方法提取得总DNA,并分别定量至(50.0±0.5) ng/μL,存于-20 ℃待用。
1.4 引物的设计
在NCBI的GenBank数据库中下载水蛭正品所属的2个科(Haemopidae和Hirudinidae)下各物种的COⅠ片段,其中Haemopidae共计17条,Hirudinidae共计47条,登录号见表2、3。运用BioEdit v7.0.4软件对这些序列进行排序、比对、分析,发现这2个科之间的差异较大,而属下的差异较小,故本实验针对Haemopidae和Hirudinidae水蛭正品与伪品之间的种间差异,分别设计了针对宽体金线蛭和日本医蛭的水蛭特异性引物,其序列如表4所示。由北京六合华大基因科技有限公司(广州分公司)合成。

表2 GenBank中水蛭Haemopidae科下各物种的COⅠ序列列表Table 2 The COⅠ gene sequence list of species of Haemopidae family in GenBank Database

表3 GenBank中水蛭Hirudinidae科下各物种的COⅠ序列列表Table 3 The COⅠ gene sequence list of species of Hirudinidae family in GenBank Database
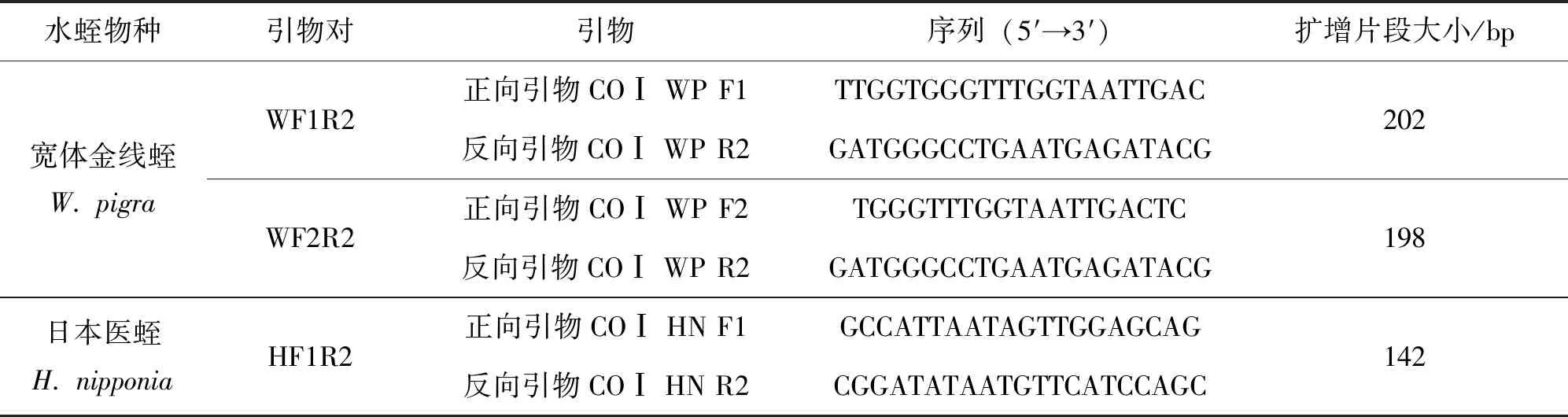
表4 宽体金线蛭和日本医蛭的特异性引物Table 4 Species-specific primers for W. pigra and H. nipponia
1.5 PCR扩增
用上述制备的水蛭单味药材DNA和脑心通胶囊DNA作为模板,分别进行PCR扩增。扩增总体系为15 μL,其中待鉴定的DNA模板0.5 μL, 10×PCR缓冲液1.5 μL,25 mmol/L MgCl2溶液1.5 μL,2.5 mmol/L dNTPs 1.2 μL,10 μmol/L的特异性正向引物和10 μmol/L的特异性反向引物各0.75 μL,5 U/μL的Taq DNA聚合酶0.1 μL,ddH2O 8.7 μL;同时设置以ddH2O为模板作为阴性对照。PCR扩增反应程序为:95 ℃ 3 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,39个循环;72 ℃ 5 min。
1.6 琼脂糖凝胶电泳检测
以琼脂糖制备凝胶,并加入SYBRTMSafe DNA gel stain染色。取5 μL PCR扩增产物与1 μL 6×RNA/DNA Loading buffer混合,于w=1.5%琼脂糖凝胶上进行点样,DNA Marker为GeneRuler 100 bp DNA Ladder。120 V条件下电泳20~30 min后,置凝胶成像系统观察。
2 结果与分析
2.1 水蛭单味药材的特异性鉴别
分别用引物WF1R2、WF2R2和HF1R2对22个水蛭商品的DNA进行PCR扩增,电泳检测结果见图1。图1A、1B中,引物WF1R2和WF2R2可以有效扩增出宽体金线蛭W.pigra的DNA,电泳结果呈现出大小为200 bp左右的明亮条带;而日本医蛭H.nipponica、伪品菲牛蛭P.manillensis和空白对照均无扩增条带。另一方面,引物HF1R2对日本医蛭产生特异性扩增,有明亮清晰的条带,大小约140 bp,而其它样品均呈阴性,无扩增条带(图1C)。此外,为验证所获得条带为目的基因,将特异性引物所得DNA条带切胶纯化、测序以进行分析。就引物WF1R2和WF2R2而言,所得序列较长,利用BLAST(Basic Local Alignment Search Tool)工具与GenBank数据库中相关序列进行搜索匹配。结果显示两对引物所对应的序列最高匹配物种均为宽体金线蛭,相似度达96.2%~100%。而引物HF1R2所得序列较短,GenBank数据库中有较多其他物种的干扰,故将该序列直接与COⅠ通用引物对相应日本医蛭所扩增的序列进行序列比对。由图2可知,引物HF1R2所得序列与相应位点上COⅠ通用引物所得日本医蛭的序列一致,该特异性引物所获得的条带为相应的目的基因(COⅠ通用引物所得日本医蛭的序列全长658 bp,图2仅截取180~360位点的序列片段)。上述实验结果表明,引物WF1R2/WF2R2和HF1R2分别对宽体金线蛭和日本医蛭具有良好的特异性。
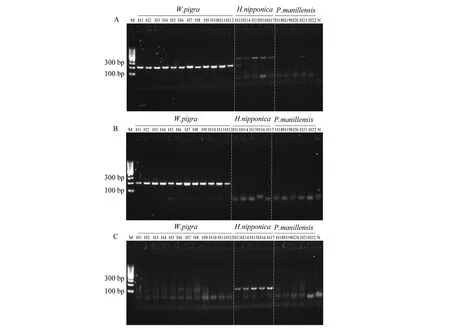
图1 水蛭特异性引物WF1R2(A)、WF2R2(B)和HF1R2(C)对水蛭药材进行PCR的产物电泳检测图Fig.1 Electrophoregram of PCR amplification products by specific primers for the Hirudo (A: WF1R2; B: WF2R2; C: HF1R2)M: DNA 相对分子质量标记; H1~H22: 水蛭药材; N: 空白对照M: DNA marker; H1-H22: crude drugs of Hirudo; N: Negative control

图2 COⅠ通用引物及水蛭特异性引物HF1R2对日本医蛭扩增所得序列对比Fig.2 Multiple alignment of the sequences amplified from the crude drugs of H. nipponica with COⅠ universal primers and specific primers HF1R2H13~H17: 日本医蛭药材; COⅠ UNI: COⅠ通用引物H13-H17: crude drugs of H. nipponica ; COⅠ UNI: COⅠ universal primers
2.2 脑心通胶囊中水蛭药材的特异性鉴别
将引物WF1R2和WF2R2分别应用于脑心通胶囊中水蛭的检测时(图3A、3B),均在200 bp左右大小出现明亮清晰的条带。为验证是否为假阳性,将各条带切胶纯化、测序,并利用BLAST工具,与GenBank数据库中相关序列进行搜索匹配。结果显示,9批脑心通胶囊所对应的序列最高匹配的物种为宽体金线蛭W.pigra,相似度达98%~99%。而在用引物HF1R2进行扩增时,脑心通胶囊中未检出明亮的条带(图3C)。由此说明,脑心通胶囊中所用水蛭为宽体金线蛭,而不含日本医蛭,这与胶囊所用水蛭投料药材(H1~H7)鉴定结果一致。
为验证若有日本医蛭或菲牛蛭混入该胶囊中,这三对引物是否能检测出正品,本实验按照脑心通胶囊的制备工艺,自制了分别含日本医蛭和菲牛蛭的脑心通胶囊(NXT-12,NXT-18)。结果显示(图3),将引物HF1R2应用于NXT-12的检测时,出现了大小约140 bp的明亮条带,说明若该胶囊中含有另一药典收载的正品日本医蛭,引物HF1R2是可以将其鉴别出来的。而若胶囊中含有菲牛蛭,3对引物都不会扩增出条带,说明这3对引物用于脑心通胶囊中水蛭的鉴别时,也是具备特异性的。
2.3 脑心通胶囊中水蛭的特异性鉴别灵敏度试验
测量脑心通胶囊的总DNA质量浓度后,母液均定量至(50.0±0.5) ng/μL作为标准质量浓度。然后分别以5倍梯度稀释,一共7个梯度,即分别稀释至质量浓度为10.0、2.0、0.4、0.8×10-1、1.6×10-2、3.2×10-3和6.4×10-4ng/μL。用引物WF1R2、WF2R2和HF1R2对所有相应的脑心通胶囊进行PCR扩增(每个批次重复1次),琼脂糖凝胶电泳检测结果见图4~6。

图3 水蛭特异性引物WF1R2(A)、WF2R2(B)和HF1R2(C)对脑心通胶囊进行PCR的产物电泳检测图Fig.3 Electrophoregram of PCR amplification products by specific primers for Naoxintong capsules (A: WF1R2; B: WF2R2; C: HF1R2)M: DNA相对分子质量标记; N1~N9: 脑心通胶囊; N12: 含日本医蛭的自制脑心通胶囊; N18: 含菲牛蛭的自制脑心通胶囊; T41: 缺水蛭的脑心通胶囊阴性对照; N: 空白对照; H1: 宽体金线蛭阳性对照; H13: 日本医蛭阳性对照M: DNA marker; N1~N9: Naoxintong capsules; N12: homemade Naoxintong capsule containing H. nipponica; N18: homemade Naoxintong capsule containing P. manillensis; T41: Hirudo-deficient Naoxintong capsule; N: Negative control; H1: crude drug of W. pigra; H13: crude drug of P. manillensis

图4 引物WF1R2对脑心通胶囊中水蛭鉴别的灵敏度检测Fig.4 Sensitivity test for the authentication of Hirudo in Naoxintong capsules using primers WF1R2M: DNA 相对分子质量标记; N: 空白对照; T41: 缺水蛭的脑心通胶囊阴性对照; 50~57: 不同稀释倍数,分别对应DNA质量浓度为50.0、10.0、2.0、0.4、0.8×10-1、1.6×10-2、3.2×10-3 和6.4×10-4 ng/μLM: DNA marker; N: Negative control; T41: Hirudo-deficient Naoxintong capsule; 50~57: dilution multiple, the corresponding DNA concentration is 50.0,10.0,2.0,0.4,0.8×10-1,1.6×10-2,3.2×10-3 and 6.4×10-4 ng/μL

图5 引物WF2R2对脑心通胶囊中水蛭鉴别的灵敏度检测Fig.5 Sensitivity test for the authentication of Hirudo in Naoxintong capsules using primers WF2R2M: DNA 相对分子质量标记; N: 空白对照; T41: 缺水蛭的脑心通胶囊阴性对照; 50~57: 不同稀释倍数,分别对应DNA质量浓度为50.0、10.0、2.0、0.4、0.8×10-1、1.6×10-2、3.2×10-3 和6.4×10-4 ng/μLM: DNA marker; N: Negative control; T41: Hirudo-deficient Naoxintong capsule; 50~57: dilution multiple, the corresponding DNA concentration is 50.0,10.0,2.0,0.4,0.8×10-1,1.6×10-2,3.2×10-3 and 6.4×10-4 ng/μL
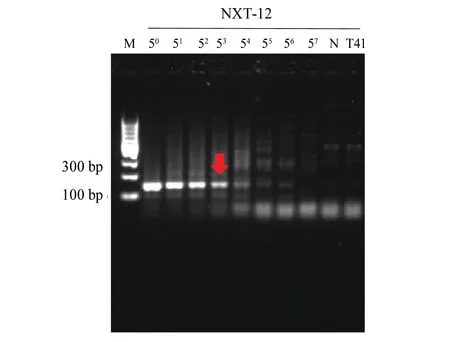
图6 引物HF1R2对脑心通胶囊中水蛭鉴别的灵敏度检测Fig.6 Sensitivity test for the authentication of Hirudo in Naoxintong capsules using primers HF1R2M: DNA 相对分子质量标记; N: 空白对照; T41: 缺水蛭的脑心通胶囊阴性对照; 50~57: 不同稀释倍数,分别对应DNA质量浓度为50.0、10.0、2.0、0.4、0.8×10-1、1.6×10-2、3.2×10-3 和6.4×10-4 ng/μLM: DNA marker; N: Negative control; T41: Hirudo-deficient Naoxintong capsule; 50~57: dilution multiple, the corresponding DNA concentration is 50.0,10.0,2.0,0.4,0.8×10-1,1.6×10-2,3.2×10-3 and 6.4×10-4 ng/μL
3 讨 论
基原鉴定是中药质量控制过程中最基础且最重要的一环。水蛭等动物类中药因其缺乏特征成分,且多数在加工过程中外部形态被破坏,组织细胞特征不明显,很难对其进行物种鉴定和质量评价[12]。而当其以中成药形式入药,在含多味中药材的脑心通胶囊中对水蛭进行基原鉴定则难上加难,也少有人研究。DNA分子鉴定技术以DNA作为标记物,不受外在形态的影响,具有特异性高、灵敏度好的特点。在2015年版《中国药典》(一部)中,正式收载了蕲蛇 、乌梢蛇和川贝母的DNA分子鉴别方法及中药材 DNA条形码分子鉴定指导原则[1],标志着DNA分子鉴定方法成为继 基原、性状、显微和薄层鉴别等四大经典鉴别方法之后的第五大国家法定鉴别方法。
相较于其他线粒体基因,COⅠ基因包含的系统发育信号更为广泛[13];且GenBank数据库中现存大量的水蛭COⅠ基因序列可做参考,故本研究基于COⅠ基因进行物种鉴定。此外,相较于他人的研究,本研究的不同之处在于分别针对宽体金线蛭、日本医蛭设计了物种特异性引物以互相区分,而非采用COⅠ的通用引物进行鉴别,原因有二:一是由于脑心通胶囊组成复杂,所含其他两味动物药(地龙和全蝎)均可被COⅠ基因的通用引物扩增,易对水蛭的鉴别产生干扰;二是该胶囊中药材均经粉碎后入药,DNA多有降解,而COⅠ通用引物所得扩增片段较长(约650 bp),不易在该胶囊中对水蛭进行扩增。研究结果显示,本研究所设计的这3对引物成功地应用于水蛭单味药材和脑心通胶囊中水蛭药材的鉴定。其中,引物WF1R2或WF2R2可以特异性鉴别宽体金线蛭,而引物HF1R2可以特异性鉴别日本医蛭;并且,这三对引物均可以将水蛭正品与市场上常见的伪品菲牛蛭区分开。本实验采用DNA作为标记物,不受实验材料的整体性影响,具有专属性和特异性,且灵敏度高,弥补了传统的性状、显微鉴别等方法的不足,同时也进一步证实了将DNA分子鉴定技术应用于中成药中原料药材鉴定的可行性,或可成为对水蛭药材或含水蛭的中成药进行现场鉴别的关键技术。
