三株散囊菌属真菌的茶叶液态发酵与其成分分析
2020-02-25陈皓睿邹克兴孙建生农李政李季刚龙章德申佩弘
苏 赞, 陈皓睿, 薛 云, 邹克兴, 孙建生,农李政, 李季刚, 龙章德, 申佩弘*
1.广西中烟工业有限责任公司,广西南宁 530001;2.广西大学生命科学与技术学院,广西南宁 530005
六堡茶作为一种特色发酵茶,具有良好的保健功效。有研究表明:六堡茶的醇提物(0.3 g/kg),能够降低总胆固醇和总甘油三酯含量,具有调节高血脂症和抗凝血作用[1]。还有研究证明六堡茶能够提高胰岛素抵抗3T3-L1脂肪细胞对葡萄糖的摄取能力,同时促进细胞内糖脂代谢,改善3T3-L1脂肪细胞胰岛素抵抗的作用[2]。有这样独特品质的前提是制作过程中的微生物发酵活动对其品质形成的影响。因为六堡茶制作过程中微生物发酵作用强烈,所以在其微生物群落中,耐高温的真菌占有很大的比例。本研究所用到的微生物是从六堡茶中分离筛选到的散囊菌属真菌,其可在较高温度下生长(高于40 ℃)[3]。本研究利用以上真菌菌株,探讨其在液态发酵方面的特性,以及应用价值。为利用散囊菌属真菌提升其他茶和烟叶的品质奠定基础。
1 材料与方法
1.1 材料与试剂
菌株:来自实验室前期实验分离鉴定。AspergilluschevalieriE2,AspergilluschevalieriE3,AspergilluscristatusE6。
发酵用茶叶:产自广西三江县某茶园,品种是“白毫毛尖”,按一芽一叶采摘。杀青烘干后,装于自封袋中19 ℃储存。
茶粉:使用粉碎机粉碎发酵用茶叶至细小碎块。
液体茶粉培养基:取粉碎的茶粉2.5 g,蔗糖1 g加入容积为150 mL的三角瓶中,加入蒸馏水50 mL,115℃灭菌15 min。
优化察氏培养基[4]:NaCl 32 g,蔗糖20 g,NH4NO33 g,MgSO40.5 g,K2HPO4·3H2O 1 g。体系为1 L,pH为自然,固体培养基添加1.5%(w/v)的琼脂,灭菌方式为115℃ 15 min。
酒石酸铁溶液:称取七水硫酸亚铁1 g,酒石酸钾钠5 g,蒸馏水定容至1 L。
1.2 仪器与设备
酶标仪(美国博腾BioTek);恒温摇床(美国New Brunswick Scientific);恒温培养箱(上海精宏实验设备有限公司);涡旋振荡器(美国赛洛捷克SCILOGEX);超净工作台(AIR TECH);真空抽滤机(郑州长城科工贸有限公司);真空浓缩机(德国艾本德Eppendorf)。
1.3 实验方法
1.3.1在茶粉培养基中的发酵与其化学成分分析
孢子悬液的制作参考龙章德的方法[5]。在无菌环境下分别将三株真菌的孢子悬液50 μL接种至液体茶粉培养基,31℃静置培养,每天分别各取出3瓶观察生长情况。第2 d、4 d、6 d的发酵液从培养箱中取出后,分别吸出2 mL发酵液置于15 mL的离心管,加入4 mL石油醚(沸程60 ℃~90 ℃),于涡旋振荡器上混匀5 min,6 000 r/m离心10 min,取上层石油醚萃取液于新离心管中,于真空浓缩机中使石油醚挥发,得到提取物粉末。用50 μL石油醚重新溶解提取物,各取10 μL按顺序在硅胶板上划线,宽度为1 cm,线距离硅胶板下沿大约1.5 cm。待硅胶板上点样处的石油醚溶剂挥发干后,将硅胶板浸入约1 cm深的石油醚∶丙酮 = 10∶1(v/v)展开剂中,展层时间约为15 min,完成后取出于通风橱中风干,于254 nm紫外下观察。
1.3.2发酵茶粉培养基酶活力分析
发酵后茶粉培养基中的果胶酶、纤维素酶、淀粉酶三种生物质水解酶的活力的测定方法参考龙章德的研究[5]。
1.3.3液体茶粉培养基发酵前后的成分分析
发酵后茶粉培养基中还原糖与总糖含量、氨基酸含量、总抗氧化能力、DPPH·降解能力等是反映茶汤质量的指标,实验方法参考龙章德的研究[5]。此外,还测定其茶多酚含量,采用酒石酸铁比色法[6],具体实验参数采用陈皓睿的实验操作流程[3]。
2 结果与讨论
2.1 在茶粉培养基中的发酵与其化学成分分析
从图1可以看出三株真菌在液体茶粉培养基中生长良好。E2在5 d形成可见菌丝球,并随时间推移增大;E3在茶粉培养基上1 d即可在液体与瓶壁接触的地方形成金色带状气生结构,随着时间推移扩大,5 d液体中形成明显的菌丝球;E6生长情况与E2相似。与在茶叶发酵部分不同,本实验液体茶粉培养基中E3没有展现出明显的无性型世代(无性型为大量灰绿色分生孢子梗结构),龙章德的研究[5]展示了这三株真菌在液体烟梗粉培养基中都以有性型世代为偏好,并且产生更多的气生结构。因此不同的环境能调控它们的繁殖偏好。谭玉梅的研究寻找到了一些与有性型调控相关的基因[7]。关于曲霉属真菌世代调控的研究有助于其在茶叶发酵中的应用,原因是散囊菌属真菌的无性型导致茶叶有“霉变”的表观质量,本研究中只有E6符合茶叶发酵的要求,而如果能调控有更好的发酵性质的此属真菌的世代,使其向有性型靠拢,便能在不影响表观质量的基础上提高发酵成茶品质。
从图2可知三株菌的2 d液体培养物中产生了三种在紫外光下都呈粉色的色素,并且条带的位置高度相似;此外靠近展层前沿的位置有蓝色条带,在未发酵对照和E3的液态发酵液中存在,并且E3发酵液中此物质浓度比未发酵对照高;而E2和E6的液态发酵液中此物质含量急剧减少。此属真菌在发酵时向培养基中分泌色素物质,有研究表明冠突散囊菌分泌的色素类物质大致有蒽醌类衍生物、蒽醌杂环类物质、酰胺类物质以及酚醛类物质[8],这些生物活性物质都有抗氧化活性。结合本实验茶汤抗氧化活性的对比,能为之后抗氧化活性物质的筛选提供帮助。

图1 各菌株在液体茶粉培养基中的生长情况
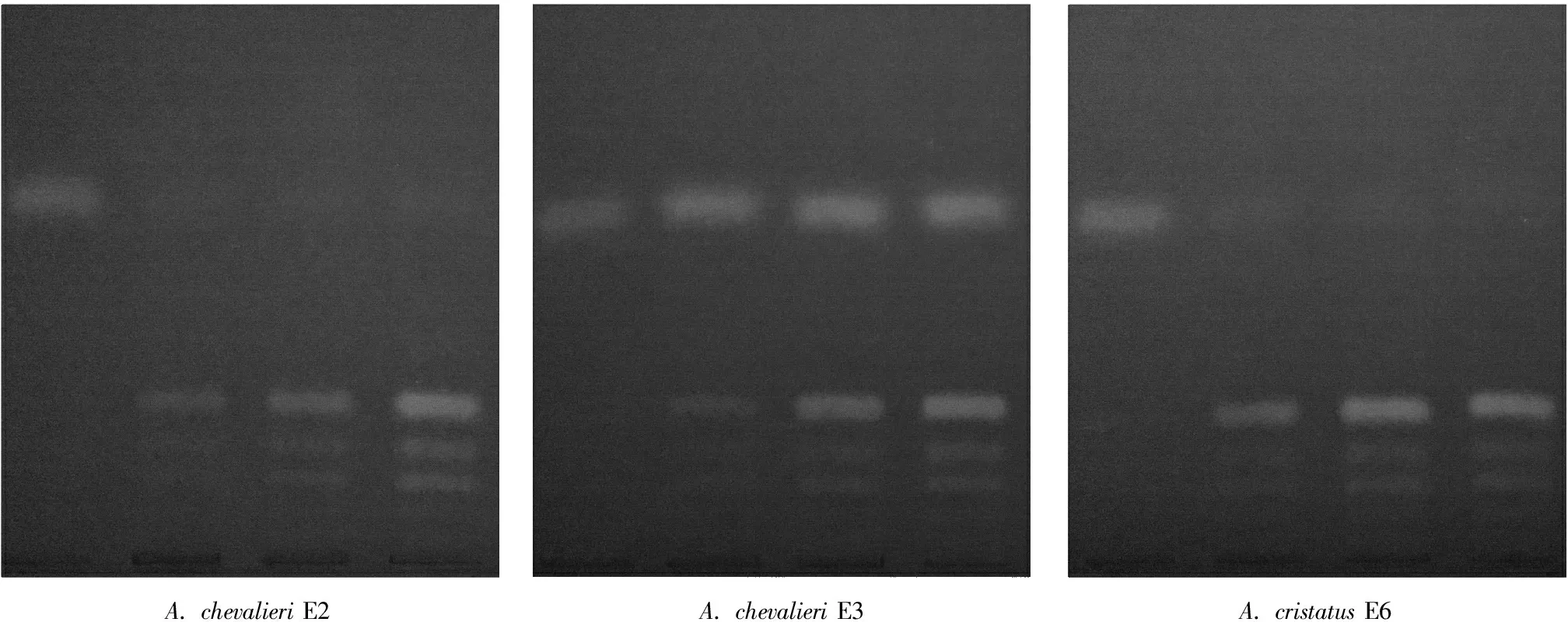
注:每一张层析图从左至右依次为未发酵对照,2 d、4 d、6 d液体培养物抽提物
2.2 茶粉培养基发酵液中酶活力分析
从图3~5可以看出三株真菌在液体茶粉培养基内的水解酶活力都较低。果胶酶活力:E2从第6 d开始上升,E3从第5 d开始上升,E6则从第3 d开始;所定时间范围内,最高酶活都在第8 d,分别为2.52 U/mL、3.44 U/mL和5.15 U/mL。纤维素酶活力:E2平稳上升,E3在4 d ~7 d期间迅速上升,E6在3 d~5 d期间迅速上升,但在5 d~7 d期间不再上升;所定时间范围内最高酶活都在第8 d,分别为0.57 U/mL、0.82 U/mL和1.10 U/mL。淀粉酶活力:三株菌分别在第5 d ~6 d、4 d ~6 d和2 d ~6 d有上升的趋势,最高酶活分别在第8 d(0.31 U/mL)、第6 d(0.35 U/mL)和第8 d(0.49 U/mL)。与龙章德在应用这三株真菌在液体烟梗粉培养基中的情况相比[5],本实验液体茶粉培养基内的水解酶活力上升速度相对更缓慢,但水解酶分泌能力最强的依然是E6,其次为E3,最弱的是E2。
2.3 液体茶粉培养基发酵前后的成分分析
根据图6,三株真菌的发酵都能大幅提高液态发酵液中的还原糖含量,增幅分别达到131.70%、627.02%和459.12%;总糖含量同样呈上升趋势,增幅分别达到6.84%、35.25%和2.07%。以上数据说明它们在所给培养条件下能自身合成糖类物质。与龙章德的实验结果[6]不同的是:本实验三株真菌在液体茶粉培养基内发酵总糖含量显著增加,说明不同的培养基质对它们利用糖的行为有完全不同的影响。
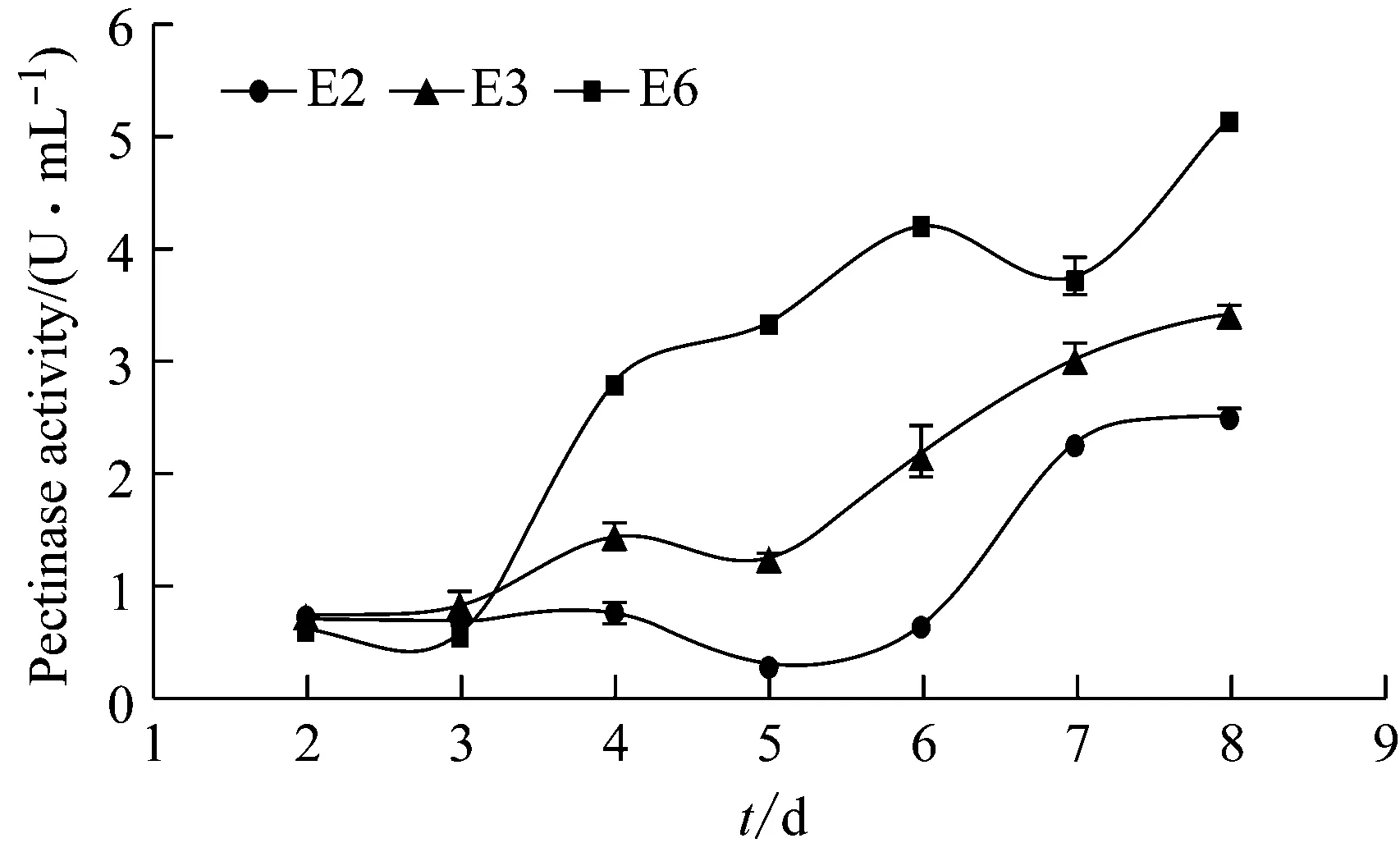
图3 各菌株液体茶粉培养基发酵液的果胶酶活力
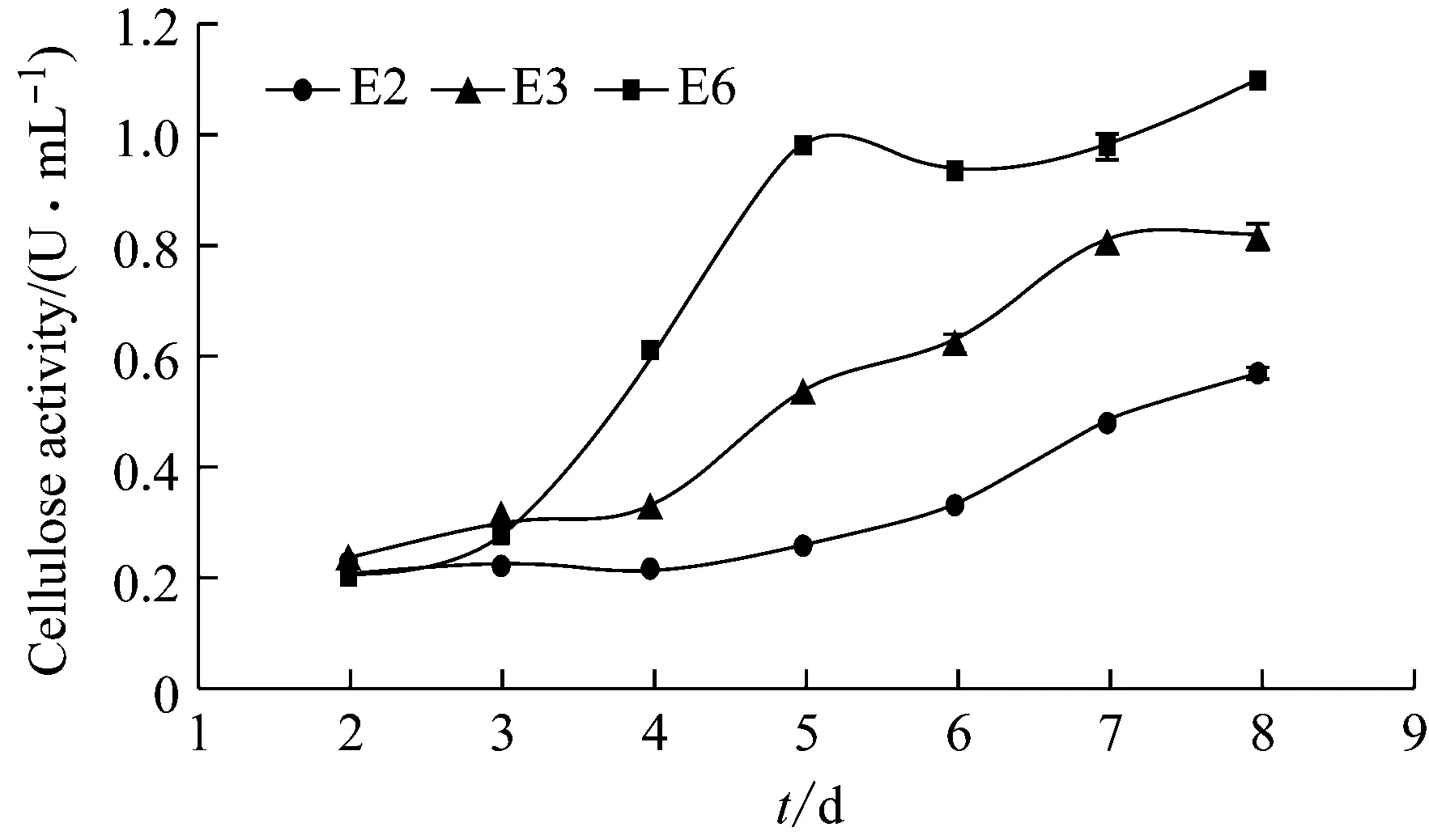
图4 各菌株液体茶粉培养基发酵液的纤维素酶活力

图5 各菌株液体茶粉培养基发酵液的淀粉酶活力

注:与各自对照组比较,P<0.05用*表示,P<0.01用**表示
图7展示了发酵后液体培养物的氨基酸含量,E2与E3分别下降了17.43%与32.68%,E6上升了0.52%。与本实验结果不同的是,杨金梅使用不同的金花菌发酵铁观音茶汤,结果显示大部分样品的发酵前后茶汤氨基酸含量变化不显著[10]。原因可能是本实验不是采用浸提液,而是直接将搅碎的茶粉直接制成液体培养基,这样,在微生物的作用下茶中的成分不断释放到液体中。龙章德[6]的实验结论与本实验相同,在液体烟梗粉培养基内发酵其氨基酸含量减少。

注:与各自对照组比较,P<0.05用*表示,P<0.01用**表示
用于测定三株菌总抗氧化活性和DPPH·自由基清除能力的液态发酵液均稀释1 000倍。图8与图9显示这两种活性都得到了显著提升。E3的总抗氧化活性提升最大,提升了65.87%;E2的DPPH·自由基清除能力提升最大,提升了128.33%。这样的结果与龙章德对于其在烟粉培养基中的实验结果[6]相反,说明三株菌的液态发酵更能保存或释放茶叶的抗氧化活性,或者是比在固态发酵的状态下产生了更多的此类活性物质。李莹对冠突曲霉的色素提取物进行了分离,发现有部分组分具有清除DPPH·和ABTS+自由基的能力,但都比维生素C弱[10]。
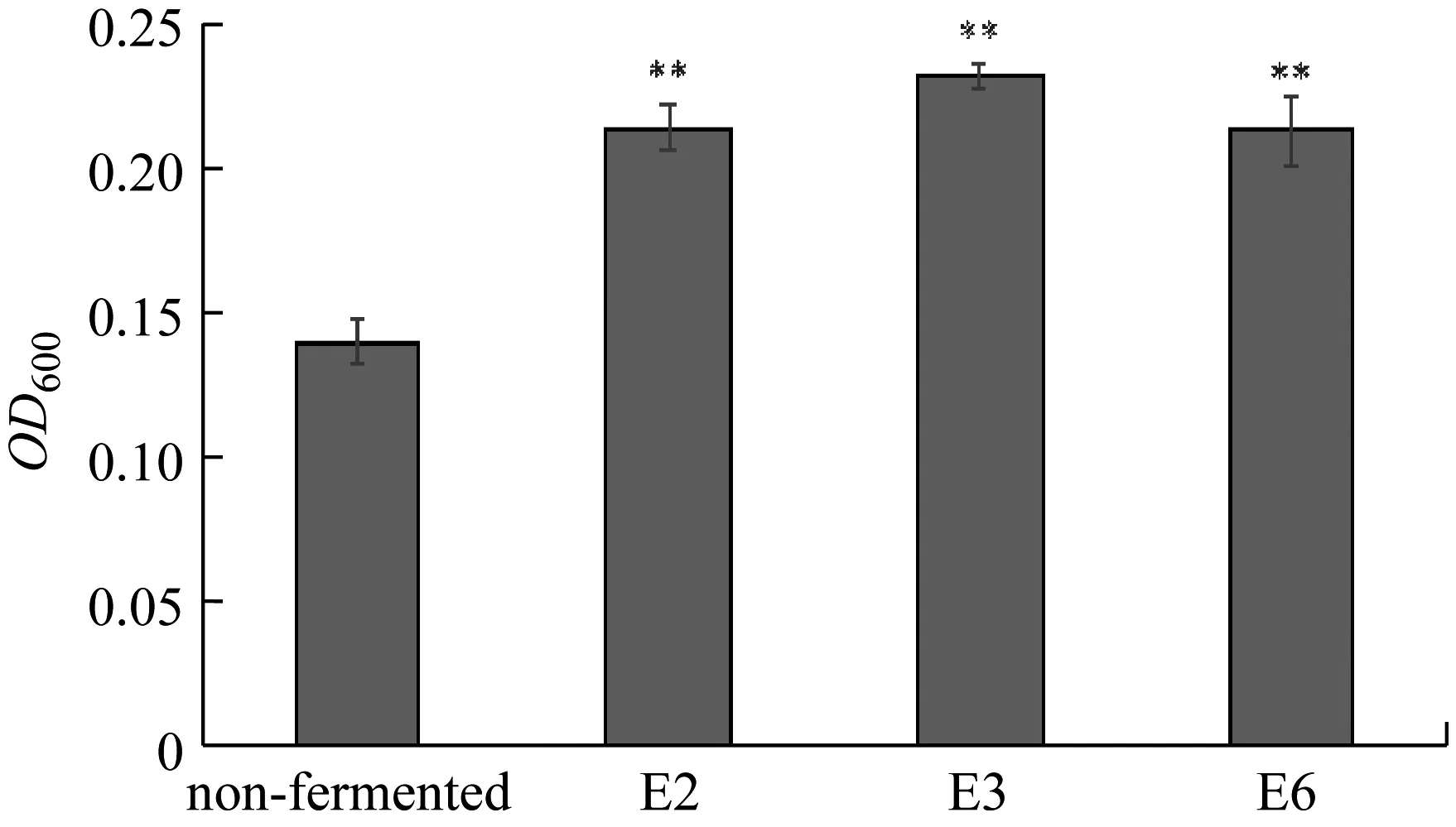
注:与各自对照组比较,P<0.05用*表示,P<0.01用**表示

注:与各自对照组比较,P<0.05用*表示,P<0.01用**表示
由图10可知三株菌液态发酵物的茶多酚含量都显著增加,增幅分别达到50.85%、51.58%和53.06%,增长水平一致。此结果与杨金梅的研究结果相反,后者的茶汤浸提物发酵液茶多酚含量在发酵24 h就急剧下降[9],说明本实验设计的条件更有利于发挥散囊菌属真菌在液态发酵方面的优势。

注:与各自对照组比较,P<0.05用*表示,P<0.01用**表示
3 结论
本研究中三株真菌在液体茶粉培养基中的发酵结果显示三株真菌的生长良好,并分泌数种在紫外光下呈粉色的色素类物质,是潜在的生物活性物质,有待后续分析。对液体茶粉发酵液的糖类水解酶活力的分析显示三株真菌都能分泌一定量的果胶酶、纤维素酶与淀粉酶,但酶活力都非常低。水解酶分泌能力最强的是E6,其次为E3,最弱的是E2。三株真菌的发酵能显著改变培养基中部分成分的含量,总体来说,还原糖和总糖含量大幅增加,氨基酸含量下降或略微上升,总抗氧化能力和DPPH·自由基清除能力提升,茶多酚含量显著提升。这些优良特性可以用于改善茶叶制品或烟草制品的品质。在此基础上,可进行更广泛深入的研究。
