葫芦茶苷对四氯化碳致肝纤维化模型小鼠的保护作用及机制研究
2020-02-24唐爱存韦燕飞刘喜华王明刚卢秋玉
唐爱存 韦燕飞 刘喜华 王明刚 卢秋玉

中图分类号R285.5;R575.2;R965.2
文献标志码A
文章编号1001-0408(2020)02-0190-06
DOI
10.603 9/j .issn.1001-0408.2020.02.12
摘要 目的:研究葫芦茶苷对四氯化碳(CC14)致肝纤维化模型小鼠的保护作用,并探讨其可能机制。方法:将昆明种小鼠随机分为正常组、模型组、秋水仙碱组(阳性对照,0.2 mg/kg)和葫芦茶苷低、中、高剂量组(3、6、12 mg/kg),每组10只。除正常组小鼠腹腔注射橄榄油外,其余各组小鼠均腹腔注射10%CC14橄榄油溶液(5mL/kg)以复制肝纤维化模型,每周2次,连续8周。自第3周起,各给药组小鼠灌胃相应药物,正常组和模型组小鼠均灌胃等体积2%羧甲基纤维素钠溶液,每日1次,连续6周。采用酶联免疫吸附测定法检测各组小鼠血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、透明质酸(HA)、白细胞介素6(IL-6)的含量;采用分光光度法、逆转录一聚合酶链反应法、Westem blotting法分别检测其肝组织中羟脯氨酸(Hyp)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)的含量,I型胶原(C01-I)、金属蛋白酶组织抑制因子1(TIMP-1)、TIMP-2 mRNA以及基质金属酶2(MMP-2)、转化生长因子β1(TGF-β1)蛋白的表达情况。结果:与正常组比较,模型组小鼠ALT、AST、HA、IL-6、MDA、Hyp含量,C01-I、TIMP-1、TIMP-2 mRNA以及MMP-2、TGF-β1蛋白的表达水平均显著升高,SOD、GSH-Px含量均显著降低(P<0.01)。与模型组比较,各给药组小鼠ALT、AST、HA、IL-6、MDA、Hyp含量,C01-I、TIMP-1、TIMP-2 mRNA以及MMP-2、TGF-β1蛋白的表达水平均显著降低,SOD、GSH-Px含量均显著升高(P<0.05或P<0.01)。结论:葫芦茶苷对肝纤维化模型小鼠具有肝保护和肝纤维化抑制的作用,其机制可能与抑制脂质过氧化和胶原蛋白合成,下调C01-I、TIMP-I、TIMP-2 mRNA以及MMP-2、TGF-β1蛋白的表达等有关。
关键词 葫芦茶苷;四氯化碳;肝纤维化;脂质过氧化;胶原蛋白;基质金属酶;金属蛋白酶组织抑制因子;转化生长因子β1;小鼠
肝纤维化(Hepatic fibrosis)是一种肝脏内纤维结缔组织异常沉积的病理过程,其并非独立疾病,而是多数慢性肝病共同的病理特征[1]。当肝脏细胞发生坏死或受到炎症刺激时,肝脏中胶原蛋白等细胞外基质的增生与降解可能会失去平衡,从而导致肝纤维化的形成;若纤维化的过程长期持续就会发展成肝硬化,甚至是肝癌[2]。目前,现有西医治疗肝纤维化的方法疗效欠佳,且复发率高、副作用较大[3]。因此,寻找和研究缓解甚至逆转肝纤维化及肝硬化的有效手段具有重要的临床意义。
葫芦茶为豆科植物葫芦茶[Tadehagi triquetrum(L.)Ohashi]的枝叶,是广西常用壮药,壮名“Gohuzluzcaz.”,主要分布于广西、广东、海南等地。该药味苦、涩,性凉,具有清热解毒、利湿退黄、消积杀虫的功效,临床上常用于治疗感冒发热、咽喉肿痛、肺痈、黄疸肝炎、肠炎、风湿关节痛、小儿疳积等症[4]。葫芦茶苷(3,5-二羟基苯基-6-0-反式.对羟基肉桂酰基- β-D-葡萄吡喃糖苷)是从葫芦茶乙醇提取物中分离得到的活性成分[5]。本课题组前期研究发现,葫芦茶苷具有明显的体外抗乙型肝炎病毒作用,其机制可能与激活Janus激酶/信号传导及转录激活因子(JAK/STAT)信号通路有关[6];此外,该化合物还能通过激活核因子E2相关因子2(Nrf2)信号通路来减轻有害物质对肝细胞的损害,抑制肝细胞凋亡,对四氯化碳(CC14)致急性肝损伤模型大鼠具有明显的保护作用[7-9]。然而,葫芦茶苷对CC14致小鼠肝纤维化的抑制作用及其机制尚未见相关报道。为此,本课题组基于前期研究结果,以CCl4诱导建立小鼠肝纤维化模型,进一步探讨葫芦茶苷对肝纤维化的抑制作用及可能机制,以期为开发广西特色抗肝纤维化壮药提供实验依据和理论基础。
1 材料
1.1 仪器
722S型可见光分光光度计(上海精密科学仪器有限公司);TDL-5型台式低速大容量离心机(上海安亭科学仪器厂);WH-1型微型旋涡混合器(上海沪西分析仪器有限公司);5810R型高速冷冻多用途离心机(德国Ep-pendorf公司);Gel Doc 2000型凝胶成像分析系统、PAC-300型低压电泳仪、9700型聚合酶链反应(PCR)扩增仪、HD-4N型核酸蛋白测定仪、Model 450型自动酶标仪(美国Bio-Rad公司);5200型全自动化学发光图像分析系统(上海天能科技有限公司);DY89-Ⅱ型匀浆器(宁波新芝生物科技股份有限公司)。
1.2 药品与试剂
葫芦茶苷对照品(纯度:>98.0%)由本课题组从葫芦茶[T triquetrum(L.) Ohashi]枝叶中分离所得,临用前用2%羧甲基纤维素钠(CMC-Na)溶液稀释,制成相应质量浓度的混悬液;秋水仙碱片(广东彼迪药业有限公司,批号:20181001,规格:0.5 mg);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、羟脯氨酸(Hyp)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶( GSH-Px)试剂盒均购自南京建成生物工程研究所(批号分别为20170801、20170601、20170801、20171221、20170601、20171022);透明质酸(HA)、白细胞介素6(IL-6)试剂盒均购自武汉伊莱瑞特生物科技股份有限公司(批号分别为N20012900、AK0017FEB22012);FirstStrand cDNA Synthesis Kit(美国MBI公司,批号:00064478);2xPCR Taq Mix(日本Takara公司,批号:9108);兔抗小鼠基质金属蛋白酶2(MMP-2)抗体、兔抗小鼠转化生长因子p.(TGF-β1)抗体(美國Abcam公司,批号分别为GR105729-I、GR121504-3);小鼠β-肌动蛋白(β-actin)抗体(内参,无锡傲锐东源生物科技有限公司,批号:18AV0315);山羊抗小鼠免疫球蛋白G(lgG)=抗、山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,批号分别为112638、134529);Trizol试剂、莫洛尼氏鼠白血病病毒(M-MIV)逆转录酶(美国Invitrigen公司);琼脂糖(西班牙Biowest公司);十二烷基硫酸钠一聚丙烯酰胺凝胶( SDS-PAGE)蛋白上样缓冲液(北京百奥莱博科技有限公司);增强化学发光法(ECI)显色剂(美国Thermo Fisher Scientific公司);RIPA裂解液(含l%蛋白酶抑制剂)、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);PCR扩增引物由上海英骏生物技术有限公司设计、合成;氯仿、异丙醇、无水乙醇等试剂均为分析纯,水为超纯水。
1.3 动物
SPF级健康昆明种小鼠,雌雄各半,体质量(20±2)g,由广西医科大学实验动物中心提供,动物使用许可证号:SYXK(桂)2014-0003。实验室温度为(20±2)℃,所有小鼠均自由进食、饮水。
2 方法
2.1 分组、造模与给药
将昆明种小鼠60只随机分为正常组、模型组、秋水仙碱组(阳性对照,0.2 mg/kg,剂量设置参照人等效剂量换算而得)以及葫芦茶苷低、中、高剂量组(3、6、12 mg/kg,剂量设置参照本课题组前期研究结果),每组10只。所有小鼠禁食过夜后,正常组小鼠腹腔注射等体积橄榄油,其余各组小鼠均腹腔注射10%CC14橄榄油溶液(5mL/kg)以复制肝纤维化模型,每周2次,连续8周[10]。自第3周起,各给药组小鼠均灌胃相应药物,正常组和模型组小鼠均灌胃等体积2% CMC-Na溶液,每日1次,连续6周。
2.2 小鼠血清学指标检测
末次给药10 h后,所有小鼠均摘取眼球取血,分离血清,采用酶联免疫吸附测定法(EIISA)以自动酶标仪检测其血清中ALT、AST、HA、IL-6的含量。严格按照相应试剂盒说明书操作。
2.3 小鼠肝组织中Hyp、SOD、MDA、GSH-Px含量检测
小鼠取血后立即脱颈处死,剖取肝脏,于肝脏右叶相同部位取肝组织约0.1 g,置于含生理盐水的匀浆器中,于冰浴中制备成10%肝匀浆。采用考马斯亮蓝法对肝组织蛋白进行定量后,采用分光光度法以可见光分光光度计检测其肝组织中Hyp、SOD、MDA、GSH-Px的含量。严格按照相应试剂盒说明书操作。
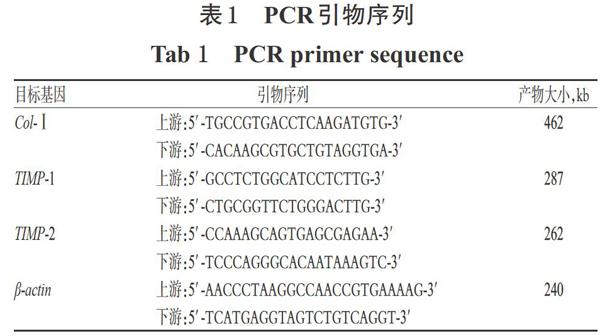
2.4 小鼠肝组织中I型胶原(Col-I)、金属蛋白酶组织抑制因子1(TIMP-1)、TIMP-2 mRNA表达水平检测 取小鼠肝组织适量,采用Trizol法提取肝组织总RNA。取上述总RNA 2 μg,按First Strand cDNA Syn-thesis Kit说明书方法,在M-MLV逆转录酶作用下逆转录合成cDNA。以上述cDNA为模板,采用逆转录一聚合酶链反应法(RT-PCR)以PCR扩增仪进行扩增。反应体系(20 μL):cDNA模板2μL,10 μmol/L的上、下游引物(序列见表1)各1μL,2xPCR Taq Mix 10 μL,用无酶水补至20 μL。反应条件:94℃预变性5 min;94℃变性30s,适宜温度(Col-I:55℃;TIMP-1和TIMP-2:52℃)退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10 min。反应结束后,取扩增产物2.OμL,进行琼脂糖凝胶电泳(电压:110V,时间:15 min),并置于凝胶成像分析系统上成像。采用Image-pro PlusV 7.0图像分析,以目的基因和内参β-actin条带的光密度(OD)值比值来表示目的基因mRNA的表达水平。上述试验重复3次。
2.5 小鼠肝组织中MMP-2、TGF-β1蛋白表达水平检测
采用Western blotting法检测。取小鼠肝组织适量,加入RIPA裂解液(含l%蛋白酶抑制剂)1 mL,于4℃下裂解后,并于4℃下以12 000 r/min离心10 min。取上清液,采用BCA法测定蛋白含量,随后加入SDS-PAGE蛋白上样缓冲液适量,于95℃水浴中变性5 min。取变性后的蛋白进行SDS-PAGE电泳分离(电压:80V,时间:30 min),电泳完成后转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭2h,加入相应一抗(稀释度均为1:1 000),4℃孵育过夜;用TBST溶液清洗5minx3次,加入二抗(MMP-2和TGF-β1加入山羊抗兔IgG二抗,β-actin加入山羊抗小鼠IgG二抗,稀释度均为1:1 000),室温孵育th后,用三羟甲基氨基甲烷盐酸盐(TBST)溶液清洗5minx3次,以ECL显色后,置于全自动化学发光图像分析系统上成像。使用QuantityOne4.6软件分析,以目标蛋白与内参β-actin条带的灰度值比值来表示目标蛋白的表达水平。上述试验重复3次。
2.6 统计学方法
采用SPSS 19.O软件对数据进行统计处理。计量资料以x±s表示,多组间比较采用方差分析,组间两两比较采用t检验。P<0.05为差异有统计学意义。
3 结果
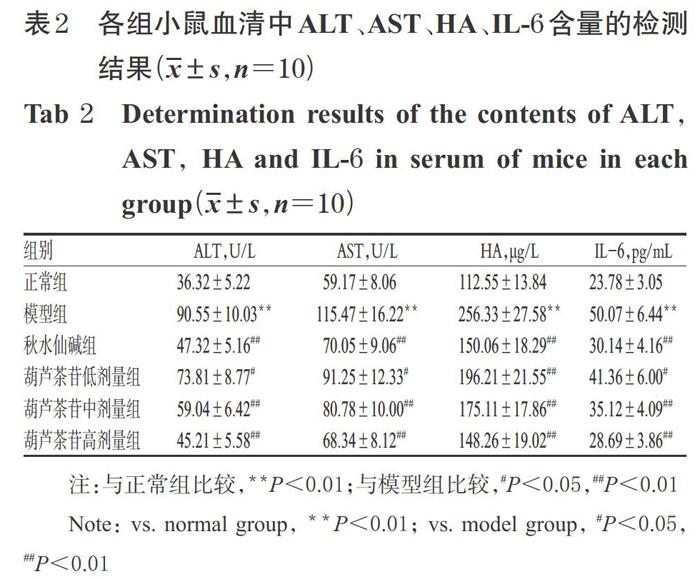
3.1 葫芦茶苷对小鼠血清中ALT、AST、HA、IL-6含量的影响
与正常组比较,模型组小鼠血清中ALT、AST、HA、IL-6的含量均显著升高(P<0.01);与模型组比较,各给药组小鼠血清中上述指标的含量均显著降低(P<0.05或P<0.01),详见表2。
3.2 葫芦茶苷对肝组织中Hyp、SOD、MDA、GSH-Px含量的影响
与正常组比较,模型组小鼠肝组织中SOD、GSH-Px含量均显著降低,而Hyp、MDA含量均显著升高(P<0.01);与模型组比较,各给药组小鼠肝组织中SOD、GSH-Px含量均显著升高,而Hyp、MDA含量均显著降低(P<0.05或P<0.01),詳见表3。
3.3 葫芦茶苷对肝组织中Col-I、TIMP-1、TIMP-2 mRNA表达的影响
与正常组比较,模型组小鼠肝组织中Col-I、TIMP-1、TIMP-2 mRNA的表达水平均显著升高(P<0.01);与模型组比较,各给药组小鼠肝组织中上述指标的表达水平均显著降低(P<0.05或P<0.01),详见表4。
3.4 葫芦茶苷对肝组织中MMP-2、TGF-β1蛋白表达的影响
与正常组比较,模型组小鼠肝组织中MMP-2、TGF-β1蛋白的表达水平均显著升高(P<0.01);与模型组比较,各给药组小鼠肝组织中上述指标的表达水平均显著降低(P<0.05或P<0.01),详见图1、表4。
4 讨论
肝纤维化是肝硬化以及肝功能衰竭的共同病理基础和必经阶段,是影响慢性肝病进展的重要环节,因此肝纤维化的预防、治疗乃至逆转是阻止肝硬化发生的关键环节[11]。肝纤维化的形成机制复杂,目前认为是由于各种肝损伤因子引起肝细胞损伤、坏死、凋亡和肝组织炎症反应,激活枯否细胞分泌多种细胞因子,与肝细胞、血小板及窦内皮细胞分泌的细胞因子、脂质过氧化物等化学递质共同作用于肝星状细胞(HSCs),后者被激活并转变为肌成纤维细胞,从而发生表型及功能改变,通过旁分泌或自分泌基质,使肌成纤维细胞增殖,合成大量的胶原蛋白等细胞外基质[12]。有研究表明,活化HSCs的减少可逆转肝纤维化,在抗病毒药物治疗病毒性肝纤维化、胆管引流治疗胆汁淤积性肝纤维化以及肝脏移植等研究中,均发现肝纤维化的逆转与活化HSCs的减少有关[13]。
CC14诱导肝纤维化小鼠模型是目前最常用的模型之一,具有操作性强、成功率高、重复性好等优点,其诱导肝纤维化的机制为CC14在体内经肝微粒体细胞色素P450酶依赖的单加氧酶系代谢后,分子中的C-CI键均裂,产生三氯甲烷自由基和氯自由基,上述自由基可攻击肝细胞膜上的磷脂分子而造成脂质过氧化;同时,三氯甲烷自由基在体内能以最快的速度与分子氧形成三氯甲基过氧自由基,后者可直接引发肝细胞脂质过氧化,诱发肝细胞凋亡,且脂质过氧化物可进一步诱导炎症反应、激活枯否细胞和HSCs,促进肝纤维化的发生和进展[14]。秋水仙碱是从植物秋水仙中提取的一种生物碱,广泛应用于抗肝纤维化的动物实验研究。研究表明,该化合物具有良好的抗肝纤维化作用,能抑制肝内储脂细胞(结蛋白阳性细胞)的增殖和转化,从而减少胶原蛋白合成及其在肝窦周围的沉积,故本研究将其作为阳性对照药物[15]。
血清中ALT、AST含量是评价肝细胞受损的基本指标,在CCI4致肝纤维化时,血清ALT、AST含量均有不同程度的升高[16]。HA是细胞外基质的主要成分之一,而细胞外基质的含量与肝纤维化程度成正相关。由此可见,HA升高是肝纤维化启动的标志之一;若其含量持续升高,则提示肝纤维化并未得到有效控制[16]。有研究表明,IL-6由活化的HSCs分泌,能反馈性地促进HSCs的增殖,并使其处于持续活化的状态[17]。本研究结果显示,与正常组比较,模型组小鼠血清中ALT、AST、HA、IL-6的含量均较正常组显著升高,提示CC14可导致小鼠肝脏受损。经不同剂量葫芦茶苷处理后,小鼠血清中上述指标的含量均显著降低,提示该化合物具有保肝、抗肝纤维化的作用。
Hyp是胶原蛋白结构中特有的氨基酸成分,在胶原蛋白中占13.4%,在弹性蛋白中含量极低;当肝纤维化发生时,胶原蛋白的含量明显增加,且Hyp的含量与肝纤维化损伤程度成正相关[16]。SOD是体内清除自由基的关键酶,其水平的高低是衡量机体抗氧化能力强弱的重要因素㈣。MDA是主要的脂质过氧化终产物,其含量高低能反映机体内脂质过氧化的强度,间接反映出机体细胞受自由基攻击的严重程度[18]。MDA本身具有细胞毒性,可进一步激活HSCs產生胶原蛋白[19]。GSH-Px是一种重要的过氧化物分解酶,可对抗并阻断氧自由基对细胞造成的损害;但随着机体内自由基水平的不断上升,GSH-Px含量逐渐降低,故可作为评价肝硬化程度的又一重要指标[20]。本研究结果显示,模型组小鼠肝组织中Hyp、MDA含量均较正常组显著升高,而SOD、GSH-Px含量均较正常组显著降低,提示肝纤维化模型复制成功。经不同剂量葫芦茶苷处理后,各给药组小鼠肝组织中Hyp、MDA含量均较模型组显著降低,SOD、GSH-Px含量均较模型组显著升高,提示葫芦茶苷对肝纤维化模型小鼠的保护作用可能与抑制脂质过氧化和胶原蛋白合成有关。
Col-I是细胞外基质的另一主要成分,是肝纤维化过程纤维间隔形成的重要来源,因此其含量可反映肝胶原蛋白的合成情况[21]。TIMPs因能抑制纤维胶原蛋白的降解,在肝纤维化的发展过程中可能发挥着重要作用,其中TIMP-I由活化的HSCs分泌,其含量与活化HSCs的数量成正比,TIMP-2则可通过抑制细胞外基质降解来加速肝纤维化进程[22]。MMPs是一类能降解细胞外基质和基底膜成分的蛋白水解酶,MMP-2是其中的一种,在动物和人体内发挥着重要的生理和病理功能[23]。研究表明,MMP-2与HSCs的活化密切相关,其可通过降解Ⅳ型胶原蛋白支架结构,使HSCs被激活,从而参与肝纤维化的启动[24]。TGF-β1是肝纤维化形成过程中的重要调控因子,可激活HSCs,并参与细胞外基质的生成[25]。研究指出,受损的肝细胞会释放大量的TGF-β1,进而激活HSCs,后者可进一步促进TGF-β1的分泌,导致肝纤维化损伤进一步加重[25]。本研究结果显示,模型组小鼠肝组织中Col-I、TIMP-1、TIMP-2 mRNA以及MMP-2、TGF-β1蛋白的表达水平均较正常组显著升高,提示肝纤维化模型复制成功。经不同剂量葫芦茶苷处理后,各给药组小鼠肝组织中上述指标的表达水平均较模型组显著降低,提示其可通过显著抑制胶原蛋白的合成与沉积、抑制HSCs活化等途径来发挥对肝纤维化的抑制作用。
综上所述,葫芦茶苷对肝纤维化模型小鼠具有肝保护和肝纤维化抑制作用,其机制可能与抑制脂质过氧化和胶原蛋白合成,下调Col-I、TIMP-1、TIMP-2 mRNA以及MMP-2、TGF-β1蛋白的表达等有关。但肝纤维化的发生机制极其复杂,本研究仅初步探究了其部分可能机制,其相关信号转导等分子机制尚有待后续研究进一步完善。
参考文献
[1]高洪燕,白殊同,刘金坤,等,柔肝宝颗粒对肝纤维化模型大鼠相关指标的改善作用研究[J].中国药房,2018,29(12):1625-1628.
[2] SAXENA NK, ANANIA FA. Adipocytokines and hepaticfbrosis[J]. Trends Endoefinol Metab,2015,26(3):153-161.
[3]吴立兵,申力军,楚金东,等,肝纤维化诊断及治疗研究进展[J].中国实用医药,2019,14(10):189-191.
[4]韦松基,朱华,常用壮药生药学质量标准研究[M].南宁:广西民族出版社.2003:399.
[5]胡佳坤,王梦洁,张燕,等,葫芦茶乙酸乙酯部位化学成分研究[J].广州化工,2017,45(21):92-94.
[6]唐爱存,王明刚,卢秋玉,等.葫芦茶苷调控JAK/STAT信号通路抗乙肝病毒作用及其机制研究[J].中药药理与临床,2017,33(1):74-77.
[7]唐爱存,陈兆霓,梁韬,等.葫芦茶乙醇提取物对肝损伤小鼠的保护作用[J].医药导报,2016,35(3):242-245.
[8] TANG A, CHEN X, LU Q, et al.Antihepatotoxic efFect oftadehaginoside, extracted from Tadehagi triquetrum( L.),against CC14-1esioned rats through activating the Nrf2 sig-naling pathway and attenuating the inflammatory re-sponse[J]. Inflammation,2014,37(4):1006-1014.
[9]唐爱存,陈兆霓,卢秋玉,等.葫芦茶苷对肝损伤大鼠肝组织Caspase-3与Caspase-8活性的影响及保肝作用研究[J].中华中医药学刊,2017,35(3):689-692.
[10]孙家昌,孙妩弋,厉歆然,等.不同浓度四氯化碳诱导小鼠肝纤维化模型的比较[J].实验动物与比较医学,2018, 38(4):255-260.
[11]
WEISKIRCHEN R, TACKE F. Liver fibrosis:from patho-genesis to novel therapies[J]. Dig Dis,2016, 34(4):410- 422.
[12] ZHANG Y, LIU J,MA Y, et al. Integration of high-throughput data of microRNA and mRNA expression pro-files reveals novel insights into the mechanism of liver fi—brosis[J]. Mol Med Rep,2019,19(1):115-124.
[13]
PANEBIANCO C, OBEN JA, VINCIGUERRA M, et al.Senescence in hepatic stellate cells as a mechanism ofliver fibrosis reversal:a putative synergy between retinoicacid and PPAR-gamma signalings[J]. Clin Exp Med,2017,17(3):269-280.
[14]
LIN TA, KE BJ, CHENG CS, et al.Red quinoa bran ex-tracts protects against carbon tetrachloride-induced liverinjury and fibrosis in mice via activation of antioxidativeenzyme systems and blocking TGF-p l pathway[J]. Nu-trients.2019. DOl: 10.3390/nu11020395.
[15]黃秀昆,孙雪梅,朱勋帅,等.4一羟基苯并嗯唑一2一酮对四氯化碳诱导大鼠肝纤维化的改善作用及机制研究[J].中国药房,2019, 30(6):747-751.
[16]黄祎,周刚,钟珊,等,双参饮对肝纤维化模型大鼠的改善作用及机制研究[J].中国药房,2019,30(12):1613-1617.
[17]
DONG W, LVB,WEl F,et al.Recombinant bovine pan-creatic trypsin inhibitor protects the liver from carbon te-trachloride-induced chronic injury in rats[J]. Pharm Biol,2013, 51(10): 1298-1303.
[18]许琼梅,李跃龙,曹后康,等,溪黄草水提物对四氯化碳诱导大鼠肝纤维化的保护作用及机制研究[J].中国药房,2018,29(20): 2791-2796.
[19]
CONG T,JIN XY, ZHAO L, et al.Anti-fibrotic effects ofthe Masson pine pollen aqueous extract on hepatic fibrosisrat model[J]. Int J,Clin Exp Pathol, 2015,8 (5):4651-4661.
[20]玉苏甫·吐尔逊,赵燕霞,小剂量二乙基亚硝胺诱导大鼠肝纤维化模型的建立[J].实用肝脏病杂志,2019, 22(1): 33-36.
[21]唐爱存,卢秋玉,伍小燕,等,木棉花总黄酮对CC14致肝纤维大鼠C01-I表达的影响[J].世界中西医结合杂志,2014,9(2):159-161.164.
[22]陈珂,许君望,周琦,等.全反式维甲酸对TGF-β1刺激的肝星状细胞COLla2、MMP-2.TIMP-I以及信号通路的影响[J].西安交通大学学报(医学版),2017, 38 (6):857-861.
[23]
YANG AT, HU DD, WANG P,et al.TGF-pi induces thedual regulation of hepatic progenitor cells with both anti-and proliver fibrosis[J]. Stem Cells Int, 2016. DOI:10.1155/2016/1492694.
[24]
KURZEPA J, MADRO A, CZECHOWSKA G, et al.Roleof MMP-2 and MMP-9 and their natural inhibitors in liverfibrosis, chronic pancreatitis and non-specific inflammato-ry bowel diseases[J]. Hepatobiliarv Pancreat Dis Int,2014 ,13(6):570-579.
[25]
LIU H, DONG F,LI G, et al.Liuweiwuling tablets atte-nuate BDL-induced hepatic fibrosis via modulation ofTGF-β/Smad and NF-KB signaling pathways[J].J,Ethno-pharmacol, 2018,210:232-241.
(收稿日期:2019-05-27修回日期:2019-10-12)
(編辑:张元媛)
△基金项目:广西自然科学基金资助项目( No.2015GXNSF-BA139126);广西卫生计生委自筹经费科研课题(No.22015481,No.220170303);广西2018年全国中药特色技术传承人才培训项目(No.桂中医药函[2018]39号);广西中医药大学第一附属医院院内制剂研究与开发项目(No.2018ZJ002)
*副主任中药师,硕士。研究方向:中药、民族药防治肝病。电话:0771-5866681. E-mail: tacyxb@163.com
