参附益心方对缺氧原代心肌细胞脂肪酸利用的影响
2020-02-24乔利杰李彬#王新陆谢世阳高原朱明军王永霞
乔利杰 李彬# 王新陆 谢世阳 高原 朱明军 王永霞


中图分类号R285.5
文献标志码A
文章编号 1001-0408(2020)02-0149-05
DOI l0.6039/j.issn.1001-0408.2020.02.05
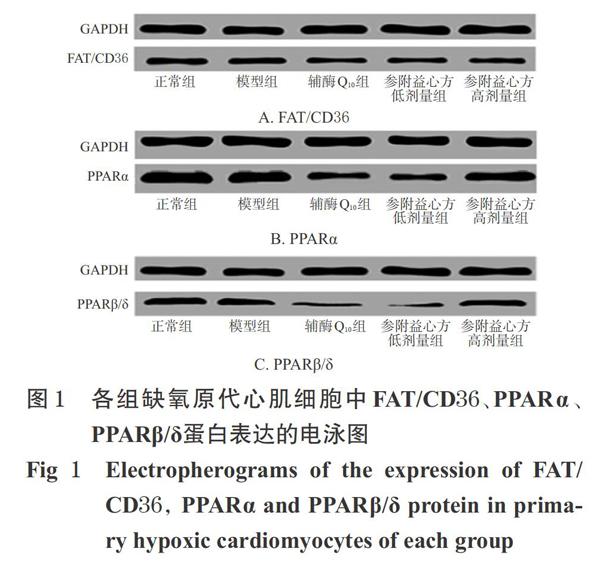
摘要 目的:探讨参附益心方对缺氧原代心肌细胞脂肪酸利用的影响及其可能机制。方法:取新生l-3d的SD大鼠心尖部组织,进行原代心肌细胞的分离、培养与鉴定,并将细胞随机分为正常组、模型组、辅酶Q.。组(阳性对照,1X10-4mol/L)和参附益心方低、高剂量组(0.25、0.5 mg/mL)。除正常组外,其余各組细胞均于5%02、5qoCO2、90%N2条件下培养6h以复制缺氧损伤模型。缺氧6h后,采用荧光素酶发光法检测各组细胞中三磷酸腺苷(ATP)的含量,采用Westem blotting法检测其脂肪酸转位酶(FAT/CD36)、过氧化物酶体增殖物激活受体(PPARa、PPARp/8)的表达情况。结果:与正常组比较,模型组细胞中ATP含量以及FAT/CD36蛋白的相对表达量均显著降低(P<0.05)。与模型组比较,辅酶Q10组和参附益心方高剂量组细胞中ATP含量均显著升高,而辅酶010组细胞中FAT/CD36、PPARa蛋白,参附益心方高剂量组细胞中FAT/CD36蛋白以及参附益心方各剂量组细胞中PPARa、PPARp/8蛋白的相对表达量均显著降低(P<0.05)。结论:参附益心方可通过抑制FAT/CD36、PPARa、PPARp/8蛋白的表达来抑制缺氧原代心肌细胞的脂肪酸利用,改善其能量代谢。
关键词 缺氧;原代心肌细胞;脂肪酸;代谢;参附益心方
心力衰竭(以下简称“心衰”)是由于心脏收缩或舒张功能异常,导致排血量不能满足机体正常需求而引发的以气喘、乏力、水肿为主要表现的一系列临床综合征,为多种心脏疾病发展的最终阶段。有学者认为,心肌维持正常生理活动所需的能量得不到满足或代谢失于平衡,可引起心脏结构与功能受损从而导致超负荷心肌损害,进一步引发心衰[1]。由此可见,改善心肌能量代谢对缓解心衰患者的症状至关重要。脂肪酸是心肌细胞产生三磷酸腺苷(ATP)的主要底物,有动物实验及临床研究证实,抑制脂肪酸利用可改善心肌能量代谢,延缓心衰病程进展[2-3]。
参附益心方为治疗心衰的经验方。有不少研究证明,该方可改善慢性心衰模型大鼠的心功能,降低其血清心房钠尿肽(ANP)、B型脑钠肽(BNP)和心肌血管紧张素Ⅱ(AngⅡ)水平,下调心肌细胞及其线粒体中活性氧(ROS)的表达,并上调ATP、肌酸激酶(CK)的含量,提高心肌细胞膜Na+-K+-ATP酶活性,从而达到缓解心衰症状的目的[4-6]。但目前有关该方对脂肪酸利用的影响尚未明确。为此,本研究拟建立缺氧原代心肌细胞模型,观察参附益心方对其脂肪酸利用的影响,并初步探讨可能的作用机制,以期为该方治疗慢性心衰提供更有力的理论依据。
l 材料
1.1 仪器
BCM-IOOOA型生物超净工作台(苏净集团苏州安泰空气技术有限公司);RC0-3000TVBB型C02培养箱(美国Revco公司);JA203型电子分析天平(上海海康电子仪器厂);TDL-50B型低速台式大容量离心机(北京医用离心机厂);CK40型倒置显微镜(日本Olympus公司);DMI3006型荧光倒置显微镜(德国Leica公司);MK3型酶标仪(美国Thermo Fisher Scientific公司);ChemiDoc XRS+型化学发光成像分析系统(美国Bio-Rad公司)。
1.2 药品与试剂
参附益心方浸膏干粉(山东步长制药股份有限公司,批号:131101,规格:1g干粉相当于生药总量9.5 g);辅酶Q10片[卫材(中国)药业有限公司,批号:H10930021,规格:10 mg];心肌细胞消化液(含胰蛋白酶0.16 g、氯化钠1.6 g、碳酸氢钠0.070 6 g、葡萄糖0.198 2g、氯化钾0.059 6 g、羟乙基哌嗪乙磺酸0.4 g.ddH20 200mL,批号:T1320)、DMEM高糖培养基(批号:12100)、磷酸盐缓冲液(PBS,pH 7.4,批号:P1020)、RIPA蛋白裂解液(批号:ROOIO)、蛋白上样缓冲液(批号:P1015)、CCK-8试剂(批号:CA1210)、BCA蛋白浓度测定试剂盒(批号:PC0020)、ECL发光液(批号:PEOOIO)均购自北京索莱宝科技有限公司;溴脱氧尿核苷(Brdu,批号:B9285)、4 ,6-二脒基-2-苯基吲哚(DAPI,批号:D9542)均购自美国Sigma公司;YOYO-I染料(批号:Y3601)、逆转录试剂盒(批号:11752050)、扩增试剂盒(批号:11744500)均购自美国Invitrogen公司;Opti-MEM培养基(批号:31985088)、胰蛋白酶(批号:27250018)均购自美国Gibco公司;兔源心肌肌钙蛋白I(cTn I)多克隆抗体(批号:BM1765)、SABC-FITC标记山羊抗兔IgG二抗(批号:SA1064)均购自武汉博士德生物工程有限公司;0.4%台盼蓝染色液(华美生物工程有限公司,批号:C0040);ATP检测试剂盒(瑞士Roche公司,批号:11699695001);兔抗大鼠脂肪酸转位酶(FATICD36)多克隆抗体(批号:ab64014)、兔抗大鼠过氧化物酶体增殖物激活受体α(PPARa)多克隆抗体(批号:ab24509)、兔抗大鼠PPARβ/δ多克隆抗体(批号:ab23673)均购自艾博抗(上海)贸易有限公司;兔抗大鼠GAPDH多克隆抗体(批号:10494-1-AP)、辣根过氧化物酶标记的山羊抗兔IgG=抗(批号:SA00001-2)均购自武汉三鹰生物技术有限公司;胎牛血清(FBS,以色列Biological Industries公司,批号:04-OO1-1A);其余试剂均为分析纯,水为双蒸水。
1.3 动物
SPF级SD大鼠,新生1~3 d,雌雄不限,体质量约5~6 g,由河南省动物实验中心提供,动物生产许可证号:SCXK(豫)2015-0005。
2 方法
2.1 药液制备
2.1.1参附益心方药液参考本课题组已发表文献[6],称取参附益心方浸膏干粉0.25 g,用DMEM高糖培养基10 mL稀释,经0.2 μm滤膜滤过后,制得质量浓度为25mg/mL(以浸膏干粉质量计)的药液。需现用现配。2.1.2辅酶Q.。药液称取辅酶Q10片50 mg,用DMEM高糖培养基5.8 mL稀释,經0.2 μm滤膜滤过后,制得浓度为1X10-2mol/L的药液,备用。
2.2 原代心肌细胞分离、培养与鉴定
于无菌条件下取出乳鼠的心尖部,以4℃的PBS清洗3次,随后将其剪成约1 mm3大小的组织块,经含0.08%胰蛋白酶的心肌细胞消化液吹打混匀后,转移至玻璃瓶内,于37℃水浴中孵育6 min,自然沉淀,弃去上清液;再同法反复消化约7~8次,直到组织块变成白色透亮状。取各次自然沉淀后的上清液与等体积含20%FBS的DMEM高糖培养基混匀,以1 000 r/min离心5min,弃去上清液,沉淀与含10% FBS的DMEM高糖培养基(以下简称“完全培养基”)1 mL混合,用200目筛网滤过,去除未完全消化的组织块,得细胞悬液。取上述细胞悬液适量,于37℃、5%C02培养箱(下同)中差速贴壁培养90 min后,吸取细胞悬液,以1 000 r/min离心5min,弃去上清液,沉淀与完全培养基充分混合,制成细胞悬液。取少量该细胞悬液,用0.4%台盼蓝染色液染色,在倒置显微镜下计数以计算活细胞比率(染色后,死细胞呈蓝色):活细胞比率=活细胞数/(活细胞数+死细胞数)XlOO%。用完全培养基将细胞浓度调整为4x105个/mL,加入浓度为0.1 mmol/L的Brdu溶液中以抑制成纤维细胞增殖,培养48h后,弃去上清液,细胞用不含血清的DMEM高糖培养基同步培养24 h;弃去上清液,用PBS清洗3遍,置于4%多聚甲醛溶液中固定10 min,加入cTnI多克隆抗体(稀释度为1:50),4℃孵育过夜;加入SABC-FITC标记山羊抗兔IgG二抗(稀释度为1:100),避光孵育2h;加入DAPI避光染色5min,用水溶性封片剂封孔,于荧光倒置显微镜下观察、拍照。随机选取6个视野,记录视野内细胞总数目(N1)和心肌细胞数(n1,即荧光阳性细胞数),计算心肌细胞比例:心肌细胞比例=n1/N1×1OO%。当该比例超过85%,表明原代心肌细胞纯度达到试验要求,可用以进行后续研究[6]。
2.3 分组、造模与给药
取“2.2”项下原代心肌细胞适量接种于96孔板中,将其随机分成正常组、模型组、辅酶Q.。组(阳性对照,IX10-4 mol/L,剂量参考本课题组前期CCK-8试验结果设置)和参附益心方低、高剂量组(0.25、0.5 mg/mL,以浸膏干粉质量计,剂量参考本课题组前期CCK-8试验结果设置),每组设3个复孔。正常组和模型组加入完全培养基2 mL,各给药组加入含相应药物的完全培养基2 mL。除正常组外,其余各组细胞均于5% 02、5%C02、90%N2条件下培养6h(缺氧时间根据本课题组前期YOYO-1染色试验结果确定),复制缺氧损伤模型;正常组细胞则于37℃、5%C02条件下培养6h。
2.4 缺氧原代心肌细胞中ATP含量检测
按“2.2”项下方法分离、培养、鉴定原代心肌细胞后,再按“2.3”项下方法分组、给药、造模。缺氧6h后,吸弃各孔上清液,用常温PBS清洗2~3次,每次1min,然后采用荧光素酶发光法以酶标仪检测细胞中ATP的含量,严格按照相应试剂盒说明书重复操作3次。
2.5 缺氧原代心肌细胞中FAT/CD36、PPARα、PPARβ/δ蛋白表达水平检测
按“2.2”项下方法分离、培养、鉴定原代心肌细胞后,再按“2.3”项下方法分组、给药、造模。缺氧6h后,采用Western blotting法检测心肌细胞中FAT/CD36、PPARa、PPARp/8蛋白的表达情况。用RIPA蛋白裂解液300 μL反复吹打破碎细胞,于4℃、12 000 r/min离心10 min后,取上清液。采用BCA法测定各组细胞的蛋白浓度后,加入4x蛋白上样缓冲液适量,于100℃煮沸变性5min。取变性后的蛋白进行SDS-PAGE电泳(先于80 V下电泳20 min,再于120V下电泳lh),湿法转膜(恒流:250 mA,时间:2h),以5%脱脂奶粉室温下封闭2h后,加入相应一抗( FATICD36、PPARa、PPARp/8、GAPDH,稀释度分别为1:1 000、1:1 000、1:1 000、1:4 000),4 cC孵育过夜;然后加入相应二抗(稀释度为1:5 000),室温孵育2h后,经ECL发光液孵育后于化学发光成像系统上显影并拍照。采用Image Pro Plus 6.O软件分析各蛋白条带的灰度值,以目的蛋白与内参GAPDH条带的灰度值比值来表示蛋白的相对表达量。上述试验重复3次。
2.6 统计学方法
采用SPSS 19.O软件对数据进行统计分析。计量资料以x±s表示,组间比较采用单因素方差分析或f检验。P<0.05为差异有统计学意义。
3 结果
3.1 原代心肌细胞的鉴定
显微镜下可见,原代心肌细胞呈星形或者梭形生长,相互接触交织成网,且呈现同步搏动,搏动频率、节律、强度稳定,频率为70~130次/min。原代心肌鉴定结果见本课题组已发表文献[6]。
3.2 参附益心方对缺氧原代心肌细胞ATP含量的影响
与正常组比较,模型组细胞ATP含量显著降低(P<0.05);与模型组比较,辅酶Q10组和参附益心方高剂量组细胞ATP含量均显著升高(P<0.05),详见表1。
3.3 参附益心方对缺氧原代心肌细胞中FAT/CD36、PPARα、PPARβ/δ蛋白表达的影响
与正常组比较,模型组细胞中FAT/CD36蛋白的相对表达量显著降低(P<0.05);而PPARa、PPARβ/δ蛋白的相对表达量与正常组比较差异均无统计学意义(P>0.05)。与模型组比较,辅酶Q.。组细胞中FAT/CD36、PPARa蛋白,参附益心方高剂量组细胞中FAT/CD36蛋白以及参附益心方各剂量组细胞中PPARα、PPARβ/δ蛋白的相对表达量均显著降低(P<0.05),详见图1、表2。
4 讨论
正常生理条件下,心脏运动所需的ATP约有60%~80%来自于脂肪酸代谢,20%~40%来自于碳水化合物(葡萄糖、乳酸、酮体)代谢;在消耗等量氧气的情况下,脂肪酸代谢途径比碳水化合物(葡萄糖)代谢途径产生的ATP少[7]。可见,在心衰发生时,心肌细胞缺血缺氧能量生成不足,而抑制脂肪酸代谢、增加葡萄糖氧化供能将更有助于心肌获益。
ATP是心脏可直接利用的能量形式,对维持心肌细胞正常代谢和功能具有重要意义;若ATP生产不足,将导致心肌收缩和舒张功能减弱[8]。辅酶Q.。是线粒体氧化磷酸化的辅酶之一,对线粒体氧化磷酸化和细胞ATP的形成具有重要作用;同时,其可增加心输出量,降低外周阻力,是治疗心衰的常用药物[9]。因此,本研究選择辅酶Q10作为阳性对照。
FAT/CD36作为脂肪酸转位酶,存在于细胞内和细胞膜上,参与脂肪酸的跨膜转运,并影响机体对脂肪酸的利用[10]。有研究证实,FAT/CD36编码基因缺失大鼠的脂肪酸摄取率明显降低,而葡萄糖利用度明显升高[11]。由此可见,可通过抑制心衰模型大鼠FAT/CD36蛋白的表达来抑制心肌细胞对脂肪酸的利用。PPAR家族为过氧化氢酶增殖物激动受体,其生理功能主要涉及脂肪酸代谢、糖代谢、细胞增殖与分化等[12]。其中,PPARa为机体调控脂肪酸代谢的重要因子,可参与脂肪酸B氧化过程,活化的PPARa可提高肉毒碱棕榈酰转移酶I(CPT-I)编码基因的表达,后者可促使脂肪酸通过线粒体内膜转移至线粒体基质内,然后被机体代谢[13]。Morgan EE等[14]研究发现,心衰患者心肌组织脂肪酸氧化率下调与PPARa蛋白表达减少有关。PPARβ/δ可通过调控CPT-I、过氧化物酶体增殖物激活受体y辅助活化因子la(PGC-1a)等编码基因的表达,进一步调节脂肪酸B氧化过程,其反应强度与机体脂肪酸利用呈正比[15]。有研究证实,心衰患者心肌PPARβ/δ蛋白表达下降,脂肪酸氧化将受到抑制,而葡萄糖有氧代谢则会增加[16]。由此可见,抑制PPARa、PPARβ/δ蛋白及其编码基因的表达对延缓心衰患者的疾病进展至关重要。
中医认为,心衰多因外感风寒、内伤饮食、情志失畅、温热疫毒日久导致气血亏虚、心脉失养而引起,病位在心,涉及肺、脾、肾三脏,病机总属本虚标实、虚实夹杂,本虚为气虚、阳虚,标实为痰饮、血瘀、水停,治法宜益气温阳、活血利水[17]。河南中医药大学孙建芝教授以此法立方,得参附益心方。方中以人参大补元气为君,使气旺血行,水饮痰湿无以停聚;附子、桂枝为臣,温肾阳、通心脉,使元阳充盛正气存内;丹参、赤芍、益母草活血化瘀利水,猪苓、泽泻、车前子利水渗湿,诸药配伍使瘀祛水行;葶苈子泻肺平喘、利水消肿,砂仁、大枣温补中焦,保护胃气,为佐使之药。全方补泻兼施,标本兼治,扶正不滞邪,利水不伤阴[18]。
本研究选用缺氧细胞模型,模拟心衰时心肌细胞的缺氧状态,从ATP含量、脂肪酸利用相关因子FAT/CD36以及PPARa、PPARp/8蛋白表达等方面来探讨参附益心方对缺氧原代心肌细胞脂肪酸利用的影响及可能机制。结果显示,模型组细胞中ATP含量及FAT/CD36蛋白的表达均较正常组显著降低;PPARa、PPARβ/δ蛋白的表达虽有降低,但差异无统计学意义。这提示心衰发生时,心肌细胞的能量代谢底物发生了变化,由优先利用脂肪酸转变为优先利用葡萄糖[7],脂肪酸氧化率降低,产能总体减少。与模型组比较,辅酶Q10组和参附益心方高剂量组细胞中ATP含量均显著升高,辅酶Q10组细胞中FAT/CD36、PPARa蛋白,参附益心方高剂量组细胞中FAT/CD36蛋白以及参附益心方各剂量组细胞中PPARα、PPARβ/δ蛋白的相对表达量均显著降低。这提示参附益心方可进一步抑制缺氧条件下原代心肌细胞的脂肪酸利用,改善其能量供应。
综上所述,参附益心方可通过抑制FAT/CD36及PPARa、PPARβ/δ蛋白的表达来抑制缺氧原代心肌细胞的脂肪酸利用,改善其能量代谢,延缓心衰过程。由于本研究的缺氧时间设定为6h,处于缺氧早期,而参附益心方对缺氧中晚期原代心肌细胞脂肪酸利用的抑制作用尚未可知,故本课题组后续将延长缺氧时间来检测FAT/CD36蛋白、PPARa、PPARβ/δ蛋白及其mRNA的表达,对上述结论进行验证;此外,参附益心方对脂肪酸利用其他相关因子的调控作用及机制,以及对葡萄糖利用的调控作用尚未明确,仍有待进一步深入研究。
参考文献
[1] DOENST T.NGUYEN TD. ABEL ED. Cardiac metabo-lism in heart failure: implications beyond ATP produc-tion[J]. Circ Res,2013 ,113(6): 709-724.
[2]邹亚兴,吴文宇,罗莉,等.苓桂术甘汤对多柔比星所致心力衰竭大鼠的改善作用及其机制[J].中国中医基础医学杂志,2018,24(7):912-915、954.
[3]
FRAGASSO G.PALLOSHI A.PUCETTI P,et al.A ran-domized clinical trial of trimetazidine,a partial free fattyacid oxidation inhibitor, in patients with heart failure[J]J,Am Coll Cardiol,2006,48(5):992-998.
[4]王永霞,任红杰,朱明军,等.参附益心颗粒对慢性心力衰竭大鼠血清心钠素、脑钠素的影响[J].中国实验方剂学杂志,2011,17(4):118-120.
[5]王永霞,任红杰,李彬,等,参附益心颗粒对慢性心力衰竭大鼠心肌血管紧张素Ⅱ1型受体和2型受体表达的影响[J].中华中医药杂志,2013,28(9):2710-2712.
[6]李彬,王新陆,谢世阳,等.参附益心方对缺氧原代心肌细胞活性氧和能量代谢的影响[J].中国药房,2019,30(8):1018-1024.
[7]陶志强,高想,姜卫东,等.曲美他嗪对心衰大鼠心脏功能和脂肪酸代谢的影响[J],中国老年学杂志,2014,34(17):4913-4915.
[8]鄧洁,倪晶宇,黄钰婷,等,心力衰竭与心肌能量代谢关系的研究进展[J].中国临床药理学杂志,2019,35 (11):1213-1216.
[9]李玲巧.瑞舒伐他汀联合辅酶Q10治疗对慢性心衰心功能的影响[J/CD].临床医药文献电子杂志,2018,5(A1):89-90.
[10]薄俊霞,李敬达,刘庆平.脂肪酸移位酶FAT/CD36与长链脂肪酸的结合机制[J].中国动脉硬化杂志,2018,26
[11]张治宇,李振东,殷仁富.脂肪酸转运体FAT/CD36在心肌脂肪酸代谢中的作用[J].同济大学学报(医学版),2006,27(S):25-27.
[12]张云,何秋霞,侯海荣,等.过氧化物酶体增殖物激活受体α的研究进展[J].现代生物医学进展,2013,13 (29):5798-5800.
[13]胡鸣旭,参芪益心方对H9C2心肌细胞能量代谢的影响及机制研究[D].哈尔滨:黑龙江中医药大学,2014.
[14]MORGAN EE, CHANDLER MP, YOUNG ME, et al.Dissociation between gene and protein expression of meta-bolic enzymes in a rodent model of heart failure[J]. Eurl,Heart Fail,2006,8(7):687-693.
[15]胡承,贾伟平.PPAR8与脂代谢及胰岛素抵抗[J].国际内分泌代谢杂志,2006,26(6):385-387.
[16]CHENG L, DING G, QIN Q, et al.Cardiomyocyte-re-stricted peroxisome proliferator-activated receptor-deltadeletion perturbs myocardial fatty acid oxidation andleads to cardiomyopathy[J]. Nat Med, 2004, 10 (11):1245-1250.
[17邓悦,中医药在诊治心力衰竭中的地位[J].中国中西医结合杂志,2017,37(10):1162-1163.
[18]谢世阳,王幼平,王小晓,等.参附益心颗粒对心力衰竭大鼠心肌ATP含量及解偶联蛋白2的影响[J].中华中医药杂志,2017,32(10):4412-4415.
(收稿日期:2019-05-08修回日期:2019-09-02)
(编辑:张元媛)
△基金项目:国家自然科学基金资助项目( No.81503419,No.813 73853, No.81603466, No.81603432)
*硕士研究生。研究方向:中医药防治心血管疾病。E-mail:qlj000826@163.com
#通信作者:主治医师。研究方向:中西医结合治疗心血管疾病的基础及临床。电话:0371-66264771。E-mail:libinnvhai@163.com
