精胺在猪精液液态保存过程中的作用
2020-02-24王婧然郭海涛孙良振金小虎石学颖林敬轶岳顺利周佳勃
王婧然,郭海涛,孙良振,金小虎,石学颖,林敬轶,岳顺利,周佳勃
(东北农业大学 生命科学学院 黑龙江省动物细胞与遗传工程重点实验室,黑龙江 哈尔滨 150030)
人工授精是世界范围内应用最广泛、效果最显著的生猪繁殖技术[1]。虽然精液冷冻技术取得了重大进展,但是精液液态保存仍然是稳定猪精子质量,维持其受精能力的主要方法[2]。猪生产企业需要优质高效液态保存稀释液来提高育种和繁殖效率以提升产品的市场竞争力。目前,中国、美国和欧洲等猪肉生产大国已经广泛采用液态精液的人工授精[3],液态精液人工授精在畜群健康和遗传育种中起非常重要的作用。
虽然人们对猪精液液态保存已进行过大量研究,但是还存在着稀释液成分复杂,保存时间不长,效果不稳定等问题。液态保存2 d精液的分娩率一般在60%~70%,而保存到第5天时则分娩率下降50%[4]。因此,必须进一步研究猪精液液态保存过程中的精子生理情况,改进保存方法,延长保存时间,提高受胎率。
精胺是生物代谢过程中产生的具有生物活性的低相对分子质量脂肪族含氮碱,是微生物、动物及人体合成核酸和蛋白质所必需的一种调控物质。精胺广泛存在于哺乳动物组织和体液中,特别是在精浆中浓度较高,约为2~15 μmol/L[4]。它可参与调控动物体内多项生命活动,如转录和转录后修饰、离子通道的开启与关闭以及某些激酶的活性,还可以改变细胞膜的结构与功能,增强细胞活力,诱导细胞自噬,延缓机体衰老[5]。睾丸组织中的精胺大部分由支持细胞和间质细胞合成,合成量受促性腺激素的调控,参与调控睾丸的各项功能和精子发生过程[6]。精浆中的精胺相对稳定的含量,对维持精子活力等方面具有很重要的作用[7],但具体作用机制还有待于进一步研究。
本研究在精液保存液添加精胺,探究不同浓度精胺对猪精子活力、质膜完整性、顶体完整性的影响。还进一步探究猪精子液态保存过程中精胺与活性氧(ROS)产生、线粒体膜电位、细胞凋亡以及体外受精能力的影响,期待延迟液体保存精子的保存时间,揭示精胺提高精子质量的分子机理,为开发新型保存稀释液,提高优良中公畜的利用率,推动猪畜牧生产业的发展提供实验及理论参考。
1 材料与方法
1.1 主要试剂除特殊说明外,本研究所用试剂均来自Sigma-Aldrich公司。BTS(贝尔茨维尔液)作为保存液,pH7.2其包含37 g/LD-葡萄糖,6 g/L二水柠檬酸钠,1.25 g/L乙二胺四乙酸二钠,1.25 g/L碳酸氢钠,0.75 g/L氯化钾,0.05 g/L青霉素钠,0.05 g/L硫酸链霉素。
1.2 精液采集与保存精液采自5头健康可育长白种公猪,用手握法采集浓厚部精液。将采集的鲜精液温度保持在35~37℃,45 min内运至实验室。镜检精子活力≥75%以上的精液样品用于试验。鲜精液需避光放置并使温度缓慢降至室温。将精液按稀释比例分装于15 mL的离心管中,300 r/min离心去除精浆,然后分别用含有不同浓度(10,100,500 μmol/L)精胺的保存液稀释,不含精胺的处理组作为对照组,分装至1.8 mL冻存管中,使精子的终浓度为3×107~5×107个/mL。将不同处理的冻存管置于17℃精液保存箱中保存5 d,每隔24 h取精液样本并检测[8]。
1.3 精子活力检测于检测前取适量精液样本混匀,并放到37℃恒温箱中预热20 min,使用清华同方精子分析仪(MX 7.5)分析精子的各项运动参数。取10 μL预热后的精液样本置于计数池上,每次检测6个视野,精子数量不少于200个。
1.4 精子质膜完整性检测根据文献[9]报道的方法,精子质膜完整性采用低渗肿胀法检测。将20 μL 精液样本混于100 μL预热的低渗液(9 g/L果糖和4.9 g/L柠檬酸钠的水溶液)中,放于37℃温箱中孵育45 min后,取10 μL预热后的精液样本,在400倍的相差显微镜下观察并统计头部肿胀和弯尾精子数以及总精子数。每次采集6个视野,精子总数不少于200个,每组重复3次。
1.5 精子顶体完整性检测根据周佳勃等[10]报道的方法,精子顶体完整性的检测采用FITC-PNA染液染色法。检测时,取100 μL精液与200 μL BTS混匀,再取10 μL混匀后的精液涂抹在干净的载玻片上,用5 μL无水甲醇固定精液5 min。晾干后,将8 μL FITC-PNA染液滴加到样品载玻片上并将载玻片置于37℃恒温箱内避光孵育30 min。孵育完后,将载玻片用 PBS 溶液冲洗3次,每次3 min,盖上盖玻片,然后,在 400×倒置荧光显微镜下观察顶体染色情况。
1.6 精子线粒体膜电位的检测采用MitoProbe JC-1试剂盒对线粒体膜电位进行检测[11]。取0.5 mL精子数量为2×106个精液的样品,加入0.5 mL JC-1染色工作液混匀。在37℃培养箱中染色20 min,然后在4℃下800 r/min离心5 min洗2次,弃上清,再用JC-1缓冲液(1×)重悬后,用流式细胞仪进行检测分析,计算膜电位高的精子的比例。
1.7 精子ROS含量检测采用DCFH-DA(2′,7′-二氯二氢荧光素二乙酸酯)染料进行精子ROS的检测。从不同的试验组中取0.5 mL的精液与0.5 mL BTS混匀,加入DCHF-DA,使其终浓度达到 200 μmol/L,在37℃恒温培养箱中避光孵育 30 min,每5 min混匀1次,随后加入 PI 检测液(终浓度为2 μmol/L),然后用流式细胞仪检测分析。
1.8 精子凋亡的检测精子凋亡采用AnnexinV-FITC细胞凋亡检测试剂盒进行检测[12]。检测时,先将1 mL精液1 500 r/min离心5 min,弃上清,再加入100 mL PBS重悬。取适量精子(1×106)与500 μL 的结合缓冲液充分混合,随后加入5 μL AnnexinV-FITC和5 μL PI,在室温下避光孵育15 min,然后通过流式细胞仪检测凋亡率。
1.9 体外受精检测卵母细胞体外成熟参考孙梦等[13]报道的方法进行,精子获能和受精液均为mTBM液。精子经过1 200 r/min室温离心3 min,洗涤2次,然后将精子按照106个/mL在mTBM液中获能1 h。按照每50 μL受精滴转入30个成熟卵母细胞。再加入获能精子使其终浓度为2.5 × 105个/mL。卵母细胞在体外受精6 h后,经PZM-3(胚胎培养液)洗涤3次,并转入PZM-3培养微滴中在37℃,5%的二氧化碳培养箱中培养。48 h后观察并计算卵裂率,6 d后观察并计算囊胚率。

2 结果
2.1 精胺对液态保存猪精子活力的影响见表1。结果显示,从液态保存2 d开始,精子活力出现明显变化。保存3 d,100 μmol/L精胺组与对照组相比,精子活力差异显著(P<0.05)。而500 μmol/L精胺组的精子活力在保存2 d就显著低于对照组(P<0.05)。保存5 d,100 μmol/L精胺组精子活力为(57.73±0.55)%仍然可达到人工授精要求。
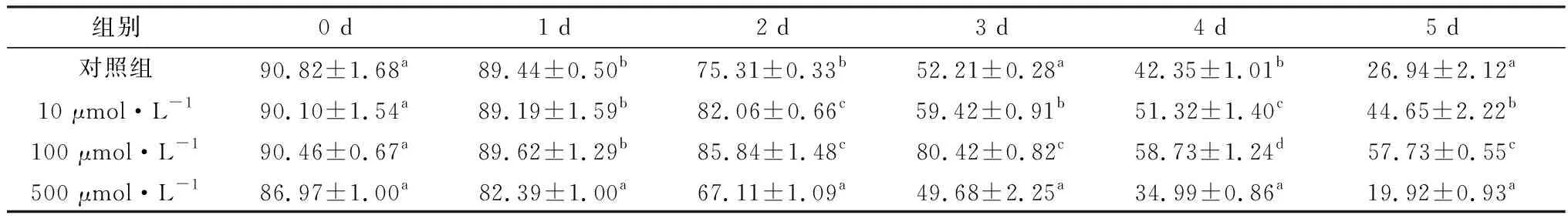
表1 精胺对液态保存猪精子的活力的影响 %
2.2 精胺对液态保存猪精子质膜完整性的影响如表2所示,保存1,2 d,添加10,100 μmol/L精胺组与对照组相比无显著性差异(P>0.05)。从3 d开始,100 μmol/L精胺组的质膜完整性(65.34±0.58)%显著高于其他组的质膜完整性(P< 0.05)。

表2 精胺对液态保存猪精子质膜完整性的影响 %
2.3 精胺对液态保存猪精子顶体完整性的影响如表3所示,在保存液中含有10,100 μmol/L精胺组的猪精子顶体完整性均高于对照组。并且随着保存时间的增加,差异越来越明显。保存至5 d时,添加100 μmol/L精胺组(72.07±0.75)%精子顶体完整率与对照组(65.03±0.60)%相比,差异极显著(P<0.01)。
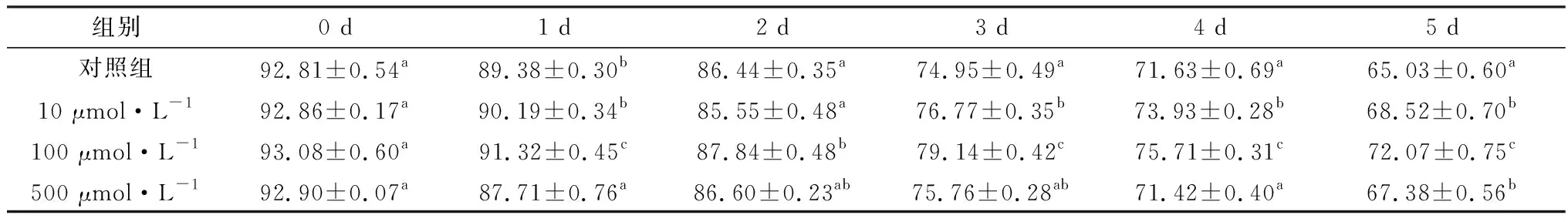
表3 精胺对液态保存猪精子的顶体完整性的影响 %
2.4 精胺对液态保存猪精子线粒体膜电位的影响随着保存时间的延长各组线粒体膜电位高的精子比例均呈逐渐下降的趋势。由表4可知,在保存5 d,添加100 μmol/L组的膜电位高的精子比例(64.27±0.28)%显著高于对照组(56.57±0.26)%(P<0.05)。

表4 精胺对液态保存的猪精子线粒体膜电位的影响 %
2.5 精胺对液态保存的精子ROS含量的影响由以上述得知,保存液中加入100 μmol/L精胺对猪精子液态保存效果最好。同时试验发现随着保存时间的延长,猪精子ROS含量也随之升高。如表5所示,以保存5 d为例,加入100 μmol/L精胺组(34.83±0.52)%与对照组(41.91±0.64)%相比差异显著(P<0.05)。

表5 精胺对液态保存的猪精子ROS含量的影响 %
2.6 精胺对液态保存猪精子凋亡水平的影响随着保存时间的增加,对照组与试验组的精子凋亡水平也随之升高,但与对照组相比,添加精胺组能显著降低精子凋亡水平。以保存5 d为例,如表6所示,加入100 μmol/L精胺组(11.92±0.35)%与对照组(19.76±0.17)%相比猪精子的凋亡水平降低,并具有显著性差异(P<0.05)。

表6 精胺对液态保存猪精子凋亡水平的影响 %
2.7 精胺对液态保存猪精子受精能力的影响根据以上试验结果,用保存3 d的精子进行体外受精和胚胎发育试验。结果如表7所示,在保存液中加入100 μmol/L精胺的精子的穿透率、受精率、卵裂率和囊胚率均显著高于对照组(P<0.05),分别是(51.00±1.00)%,(28.00±0.58)%,(66.08±1.27)%和(23.36±0.84)%。

表7 精胺对液态保存猪精子受精和胚胎发育的影响 %
3 讨论
猪精液在保存的过程中精液质量会随着保存时间增加而下降,具体表现在精子的运动能力降低、代谢活动抑制、顶体和质膜损坏进而受精能力降低。本研究发现,添加精胺可有效抑制保存过程中猪精子的活力和质膜完整性的下降,而且精子质膜完整性、顶体完整率要高于对照组。这些结果表明精胺可显著提高保存过程中猪精子的质量,特别是具有稳定精子细胞膜结构的能力。AMBROSI等[14]报道了在公绵羊精子冷冻缓冲液中加精胺具有抗氧化作用,且有利于稳定精子质膜的性质。据报道精胺是一种精子获能抑制因子[5],可以稳定精子质膜,抑制精子提前的异常获能和顶体反应,从而保证精子的正常功能不受损害。此外,研究中我们发现添加较高浓度的(500 μmol/L)精胺时,与对照组相比精子的活力、质膜完整性、顶体完整率都显著下降。这与ERIF等[15]报道的精胺在犬精液冷冻保存的结果一致,添加高浓度的精胺对精子产生有毒作用。
线粒体功能与精子运动相关,因此线粒体膜电位可作为一种可靠的精子质量指标[16]。研究表明线粒体膜电位升高往往伴随着ROS产生增加,ROS在细胞内过度积累会导致细胞功能紊乱[17]。ROS主要源于是线粒体内膜的呼吸链,而维持低水平的ROS有利于促进线粒体功能。本研究中我们发现精胺不仅降低了ROS浓度,而且精胺的添加显著改善了线粒体的功能,在保存5 d,添加100 μmol/L组的高线粒体膜电位的精子比例显著高于对照组。精胺是人和大鼠精液中多胺的一种天然成分,具有重要的抗氧化能力[18]。RIGOBELLO等[19]报道精胺可以抑制大鼠肝细胞线粒体肿胀、线粒体膜电位下降和谷胱甘肽的丢失。可见,精胺可通过保护线粒体功能降低精子在液态保存过程中的氧化应激从而提高保存精子的质量。
氧化应激不但可引起精液质量下降、参数异常,还与精子DNA损伤成正相关。DNA碎片化是细胞凋亡最具典型的变化之一[20]。据报道精胺是一种细胞内天然ROS清除剂,防止DNA遭到过多ROS的破坏[21]。本研究的结果进一步支持了这一观点,精液保存过程中精子细胞凋亡比例逐渐升高,而添加精胺可以有效地降低精子细胞凋亡程度。
精子质量与精子穿卵能力密切相关,而且精子功能缺陷是最常见的导致雄性不育和妊娠失败的诱因[22]。外界不良环境,可引起精子DNA去甲基化进程受阻,降低雌配子和雄配子基因组的全能性,抑制雌雄原核形成,从而导致胚胎发育终止[23]。据文献报道,精浆物质可通过调节精子的活力和细胞器功能,以及与母体雌性因子之间产生互作来改变后代表观遗传学,从而间接调节胚胎发育[24]。猪精液在常温保存过程中,细菌、氧化应激和精浆中物质的改变对精子的生理功能可产生不同程度的影响。本研究中我们发现添加100 μmol/L精胺的保存液能够显著提高猪精子体外受精的穿透率、总受精率、卵裂率和囊胚率。与我们的结果相一致,有研究表明精胺可以提高小鼠体外受精率,同时缩短体外受精时间[25]。猪精子质膜上因含有大量多不饱和脂肪酸在保存过程中及易受到氧化应激氧化损伤。氧化还原失衡会损伤精子DNA完整性,可导致早期胚胎发育终止、胎儿流产和后代不育或先天缺陷。结合本研究结果添加精胺能够维持精子氧化还原平衡,降低ROS的含量,改善线粒体功能。因此,我们推测添加精胺可能通过降低ROS对DNA损伤,改善线粒体功能状态,提高精子在早期胚胎发育中的去甲基化进程,促进雌雄原核形成,从而间接调节胚胎发育。
综上所述,在保存液中添加精胺能显著提高精子的活力、质膜完整性和顶体完整率。精胺可有效清除ROS,抑制精子凋亡,提高精子线粒体活性,从而延长了精子的保存时间。此外精胺还能够增强精子穿透能力提高受精效率和后续胚胎发育能力。精胺是一种高生物活性的多胺类物质,可在多种途径参与细胞的功能,我们对精胺在猪精液液态保存过程中的影响仍处在基础研究阶段,未来可以考虑通过研究精子内的抗氧化酶体系及细胞凋亡相关抑癌基因(p53)和丝裂原活化蛋白激酶(MAPK)分子与精胺的互作关系进一步探究精胺改善精液品质的具体作用机制,以期为研究精胺对雄性动物生殖细胞的影响和猪精液稀释液的研发提供更多理论参考。
