猪链球菌流行优势菌株的调查及耐药性
2020-02-24王治方白红杰徐引弟朱文豪张青娴焦文强李海利王克领娄治国
王治方,白红杰,徐引弟,朱文豪,张青娴,焦文强,李海利,许 峰,王克领,张 彬,娄治国
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002;3.河南省农业科学院,河南 郑州 450002)
猪链球菌病是由猪链球菌引起的一类急性、热性传染性疾病,属于国家规定的二类动物传染病,临床上主要引起猪的败血症、脑膜炎、关节炎等病症,是世界范围内养猪业最常见的细菌性疾病之一[1-2]。
猪链球菌血清型较多,基于猪链球菌荚膜多糖抗原的不同,猪链球菌一度被分为35个血清型,分别是1~34和1/2型;2005年,HILL等[3]进一步验证,32型和34型并不是猪链球菌,猪链球菌划分为33个血清型(1/2型、1~31型、33型);而有最新的研究报告指出,血清型20型、22型、26型和33型属于其他新的物种,应该从猪链球菌中分离出来[4]。因此,目前认为猪链球菌有29个血清型。猪链球菌的致病性与其携带的毒力基因密切相关,目前研究较多的猪链球菌主要毒力基因有胞外因子(extracellular protein fateror,epf)、溶菌酶释放蛋白(muramidase-released protein,mrp)和溶血素(suilysin,sly),这3个毒力基因常作为猪链球菌致病性的指示蛋白基因。目前普遍认为猪链球菌血清1/2型、1型、2型、7型和9型对猪的致病性较强,其中2型毒力最强、流行最广,而且能够引起人类的感染发病和死亡,是国内防控猪链球菌病的主要血清型。
近年来,随着我国养猪业集约、规模化的发展,猪链球菌病的发生呈现上升趋势,而且经常作为主要病原继发于猪伪狂犬病、猪繁殖与呼吸障碍综合征、猪圆环病毒等病毒性疾病,给养猪场临床疾病诊疗控制带来不小的困难,给养猪企业造成不小的经济损失。本试验通过对2019年度河南省猪场疑似猪链球菌病例采集病料95份,通过病菌分离培养、纯化鉴定,获得猪链球菌68株,同时对68株猪链球菌进行了 血清型鉴定、药敏试验、毒力基因和耐药基因检测研究,旨在探讨近段时间河南省猪链球菌流行优势菌株及其毒力基因和耐药基因分布情况,为临床猪链球菌的防控提供参考依据。
1 材料与方法
1.1 病料2019年度河南省不同规模的猪场临床发生有脑膜炎、关节炎、败血症等疑似猪链球菌病例病料,剖检濒死期病猪,采集脑组织、心血和关节液病料95份(分别采自鹤壁12份、焦作10份、驻马店15份、南阳12份、周口16份、平顶山8份、济源8份、开封5份和洛阳9份)。
1.2 主要试剂胰蛋白大豆琼脂(TSA)和胰蛋白大豆肉汤(TSB)购自美国Difco公司;新生犊牛血清购自郑州益康生物工程有限公司;革兰染液试剂盒购自珠海贝索生物技术有限公司;6大类18种常用抗生素标准药敏片,其中15种购自杭州滨河微生物试剂有限公司,头孢噻呋、替米考星、土霉素药敏片购自Sigma公司;微生物DNA提取试剂盒、DL2000 DNA Marker、Lording Buffer、2×Taq Master Mix等均购自宝生物(大连)工程有限公司;相关引物均由生工生物工程(上海)股份有限公司合成。
1.3 病原的分离、纯化无菌操作,将采集的疑似猪链球菌病例的病料脑、心血和关节液分别划线接种于TSA平板(含5%的新生牛血清),放置于培养箱37℃培养18~24 h后,挑选可疑单个菌落纯化、革兰染色镜检。同时将纯化后的可疑菌株分别接种于TSB液体培养基(含5%的新生牛血清),于37℃培养18 h,备用。
1.4 分离菌株的PCR检测、血清型鉴定
1.4.1引物设计 参照文献[5-7]设计合成猪链球菌通用引物和29种血清型引物。
通过聚合酶链式反应(PCR)对纯化好的分离菌株进行鉴定和血清型分型鉴定。
1.4.2DNA提取 取可疑菌株TSB液体培养物1 mL于离心管中,10 000 r/min离心5 min,弃上清收集菌体沉淀,按照DNA提取试剂盒说明书提取菌体DNA,分装,-80℃保存备用。
1.4.3PCR检测 PCR反应体系(25 μL):2×Taq Master Mix 13 μL,10 μmol/L上、下游引物各1 μL,ddH2O 8 μL,模板DNA 2 μL。
PCR反应条件:95℃预变性 5 min;95℃ 变性30 s,56℃ 退火30 s,72℃ 延伸30 s,40个循环;72℃延伸5 min,4℃保存备用。
电泳:取10 μL PCR扩增产物于1%琼脂糖凝胶电泳跑胶检测,紫外透射分析仪观察结果,比照DL2000 DNA Marker确定条带大小。阳性PCR扩增产物送生工生物工程(上海)股份有限公司测序,测序结果进行BLAST软件比对。
1.5 毒力基因检测
1.5.1引物设计 参考文献[8-10]设计合成了3对猪链球菌毒力基因(胞外因子epf基因、溶血素sly基因、溶菌酶释放蛋白mrp基因)引物,各对引物序列和扩增片段长度见表1。

表1 毒力基因引物序列及相关信息
1.5.2DNA提取及毒力基因检测 DNA提取方法同上述1.4.2。毒力基因PCR反应体系(25 μL):2×Taq Master Mix 13 μL,上、下游引物各1 μL,ddH2O 8 μL,模板DNA 2 μL。PCR反应条件:95℃预变性5 min;95℃ 1 min,57℃ 1 min,72℃ 30 s,共35个循环;最后72℃延伸10 min,PCR产物4℃保存备用。电泳:取10 μL PCR扩增产物于1%琼脂糖凝胶电泳跑胶检测,紫外透射分析仪观察结果,比照DL2000 DNA Marker确定条带大小。
1.6 药物敏感性试验药敏试验采用Kirby-Bauer(K-B)纸片扩散法[11-12]。具体方法及判定标准参照(美国临床实验室标准委员会NCCLS)(2005)标准。判定结果分为敏感、中介、耐药。6大类18种抗生素包括头孢噻呋、头孢他啶、阿莫西林、青霉素、氨苄西林、卡那霉素、阿米卡星、壮观霉素、替米考星、阿奇霉素、四环素、强力霉素、土霉素、左氟沙星、氧氟沙星、恩诺沙星、环丙沙星和复方新诺明。
1.7 耐药基因检测
1.7.1引物合成 参考文献[13-15],合成5大类24个耐药基因包括β内酰胺类(blaTEM、blaOXA-1、blaCTX-M-2、blaSHV、blaIMP-1、blaDHA-1),氨基糖甙类(aadA1、aadA2、strA、strB、aadB、aacC2、aac(3)-IV、aphA1),四环素类(tet(A)、tet(B)、tet(C)、tet(D)、tet(G)),喹诺酮类(gyrA、parC)和磺胺类(sul1、sul2、sul3)基因的引物,用于本菌株耐药基因的检测扩增。
1.7.2耐药基因检测 模板DNA的提取方法同上述1.4.2。用上述24对耐药基因的引物进行扩增检测。
反应体系为25 μL:2×Taq Mix 12.5 μL, 10 μmol/L上、下游引物各1 μL,模板DNA 1 μL,加ddH2O 至25 μL。反应条件:95℃预变性5 min;95℃ 1 min,57℃ 1 min,72℃ 30 s,共35个循环;最后72℃延伸10 min,PCR产物4℃保存。取10 μL扩增产物电泳,紫外光下观察结果,阳性产物测序。
2 结果
2.1 细菌形态分离菌株在TSA平板(含5%的新生牛血清)上,形成均一的表面光滑湿润、边缘整齐、圆形半透明、略带蓝色荧光的小菌落。挑取单个菌落革兰染色镜检为革兰阳性,菌体呈球形或卵圆形,呈单个、成对或短链存在(图1)。
图1 猪链球菌菌体形态(1 000×)
2.2 细菌纯化鉴定及血清型检测通过对采集的95份(脑组织30份、关节液36份、心血29份)疑似样品进行细菌分离、纯化、鉴定,共获得猪链球菌68株其中脑组织24株(30份),关节液22株(36份),心血22株(29份)。
用29对猪链球菌血清型引物对68株猪链球菌进行血清型分型鉴定,结果分离菌株血清2型48株(脑组织18株、关节液12株、心血18株),占70.5%;血清9型15株(脑组织6株、关节液7株、心血2株),占22%;血清4型2株(关节液1株、心血1株),占3%;血清14型2株(关节液2株),占3%;血清3型1株(心血1株),占1.5%(图2,3)。
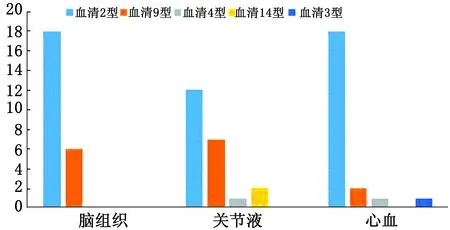
图2 河南猪链球菌临床分离株血清型分离鉴定统计结果
2.3 毒力基因检测用3对毒力基因引物对68株猪链球菌分别行PCR扩增检测,胞外因子(epf)、溶菌酶释放蛋白(mrp)和溶血素(sly)3个毒力基因目的条带分别为626,885,1 502 bp(图4)。结果分离菌株中毒力基因类型为epf-/mrp-/sly-有20株,分别是血清9型15株、血清14型2株、血清3型1株、血清2型2株;血清4型2株毒力基因类型均为epf-/mrp+/sly-;剩余46株血清2型中,毒力基因类型epf+/mrp+/sly+18株,epf+/mrp+/sly-3株,epf+/mrp-/sly+25株(表2)。

图3 猪链球菌部分菌株血清型PCR鉴定结果 M.DL 2000 DNA Marker;1,3,5,7,9.猪链球菌通用引物鉴定;2.猪链球菌2型菌株; 4.血清3型菌株;6.血清4型菌株;8.血清9型菌株;10.血清14型菌株

表2 猪链球菌临床分离株毒力基因类型检测表

图4 猪链球菌毒力基因PCR检测结果 M.DL2000 DNA Marker;1.阴性对照;2.epf毒力基因; 3.mrp毒力基因;4.sly毒力基因
2.4 药敏试验结果参照NCCLS手册(2005版 )标准判定,68株猪链球菌临床分离株药敏试验结果表明,河南省猪链球菌临床分离株对不同种类的抗生素药物的敏感性存在明显差异(表3)。68株猪链球菌对β内酰胺类抗生素敏感性结果较好,对头孢噻呋、头孢他啶、阿莫西林、氨苄西林的敏感性分别为79.4%,75%,73.6%,70.6%,其中对头孢噻呋、头孢他啶2种药物没有发现临床耐药菌株,但青霉素的临床敏感性不容乐观,只有47.1%。68株猪链球菌对氨基糖苷类、大环内酯类、四环素类、磺胺类药物均表现出较高的临床耐药性,其中对四环素类药物耐药性最为突出,均在95%以上;对强力霉素、四环素、土霉素、卡那霉素没有发现1株敏感菌株。此外,所有分离菌株均存在严重的多重耐药现象,耐药表型表现出均对5种或5种以上抗菌药物耐药现象。

表3 河南省猪链球菌临床分离株药物敏感试验结果
2.5 耐药基因检测用24对耐药基因引物对68株猪链球菌进行耐药基因扩增检测,结果共检测出12种耐药基因(图5),分别是blaTEM、aadA1、strA、strB、aadB、aacC2、aphA1、tet(B)、gyrA、parC、sul1和sul2基因,其中检出率较高的耐药基因分别是aphA1、tet(B)、gyrA和parC基因,检出率分别是86%(59/68),89%(61/68),63%(43/68)和58%(40/68)。
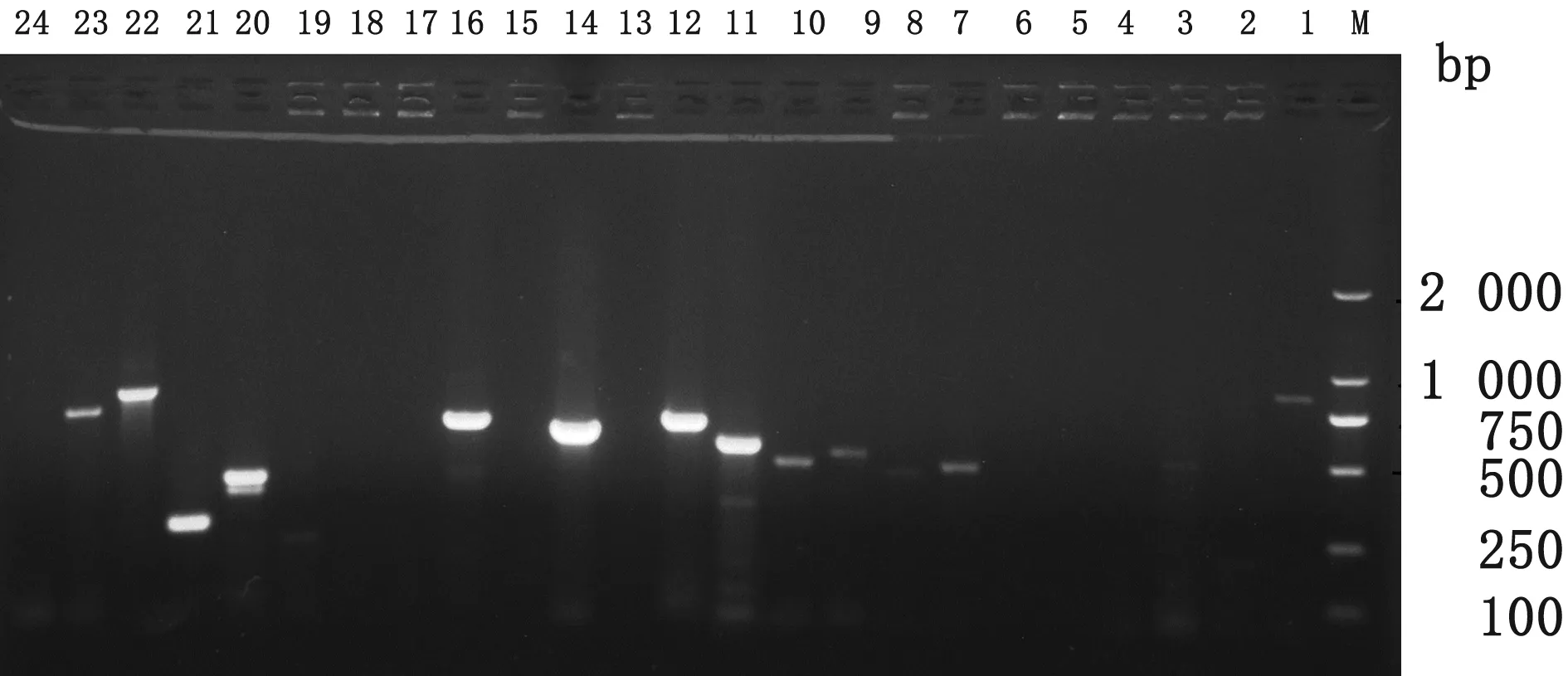
图5 猪链球菌个别菌株耐药基因PCR检测结果 M.DL 2000 DNA Marker;1.blaTEM;2.blaOXA-1;3.blaCTX-M-2;4.blaSHV;5.blaIMP-1;6.blaDHA-1;7.aadA1;8.aadA2;9.strA;10.strB;11.aadB;12.aacC2;13.aac(3)-IV;14.aphA1;15.tet(A);16.tet(B);17.tet(C);18.tet(D);19.tet(G);20.gyrA;21.parC;22.sul1;23.sul2;24.sul3
3 讨论
本试验采集河南省不同规模猪场疑似猪链球菌病例的95份样品,通过细菌分离、纯化鉴定及血清型分型,共获得68株猪链球菌,其中血清2型48株占70.5%,血清9型15株占22%,表明当前河南省猪链球菌流行优势菌株主要是血清2型,其次为血清9型,这与国内其他报道较为一致[3,16]。此外,还从心血、关节液样品中分离到2株4型菌株、2株14型菌株和1株3型菌株,并没有分离到以往报道中占一定优势的血清1型和血清7型。表明临床上猪链球菌流行优势菌株在不断发生变化,因此,在生产实际中,选择疫苗防控猪链球菌病,最好弄清区域内优势血清型或者选择使用含有血清2型的多价疫苗,确保获得较为理想的防控效果。
猪链球菌菌株的致病性强弱与其携带的毒力基因密切相关,通常把胞外因子(epf)、溶菌酶释放蛋白(mrp)、溶血素(sly)作为猪链球菌毒力指示蛋白,用来区分菌株的毒力强弱,epf+/mrp+/sly+常被认为与高致病性菌株相关[3,10]。本试验通过对68株猪链球菌毒力基因检测,共获得5种毒力基因类型,epf+/mrp-/sly+毒力类型为25株,占比36.7%;其次为epf-/mrp-/sly-类型20株和epf+/mrp+/sly+18株。其中epf+/mrp-/sly+类型的25株和epf+/mrp+/sly+类型的18株均是血清2型菌株,而血清9型的15株毒力类型均是epf-/mrp-/sly-。结果表明河南省猪链球菌临床流行菌株以epf+/mrp-/sly+毒力类型为主,其次是epf-/mrp-/sly-类型和epf+/mrp+/sly+类型,这一点与其他相关报道有一定的变化[10,17-18]。同时,通过菌株携带的毒力基因情况,表明临床血清2型在致病性方面强于血清9型。
挑选6大类18种常用抗生素对68株猪链球菌进行药敏试验,结果显示只有β内酰胺类的头孢噻呋、头孢他啶、阿莫西林和氨苄西林敏感性较好,在70%以上;其中头孢噻呋和头孢他啶没有发现耐药菌株。而对其他14中抗生素均表现出了高度的耐药性,对四环素类的四环素、强力霉素、土霉素耐药性最强,分别是100.0%,98.5%,98.5%;对氨基糖苷类的卡那霉素和阿米卡星的耐药性也在95%以上;大环内酯类的阿奇霉素和替米考星的耐药性为88.1%,91.1%对喹诺酮类药物的耐药性在42%~58%,这与国内的有关研究报道[19-20]基本一致。
对68株猪链球菌进行24种耐药基因检测,共检测出12种耐药基因。氨基糖苷类8种耐药基因检出6种,其中aphA1检出率高达86%;喹诺酮类2种耐药基因全部检出,检出率分别为63%,58%;四环素类5种耐药基因检出tet(B)1种,检出率高达89%。结合表型耐药结果,说明耐药菌株耐药基因的检测结果和表型耐药结果有很大的相关性。生产实际中,如何减少或消除耐药细菌的耐药基因,是减少耐药菌株产生的重要环节,需要进一步进行深入研究和探索。
本试验分离获得的68株猪链球菌对大部分常用药物表现出广泛的耐药现象,而且存在严重的多重耐药性,且存在耐药基因传递情况。笔者认为临床菌株产生耐药性的主要原因,主要是抗生素的长期滥用或不规范使用引起的。因此,在生产实际中,建议规模化猪场在选择疫苗或选药、用药前,最好通过有关机构弄清本场流行菌株血清型和药敏试验筛选出敏感药物,有的放矢,能很大程度上提高防控或治疗效果。另外,如果能够利用本场分离菌株制备相应的疫苗,用于防控猪链球菌,无论从保护率方面还是在成本方面都是切实而有效的方法。
