肥胖低通气综合征患者血清瘦素水平的变化及意义
2020-02-24马青青朱述阳朱洁晨
马青青, 朱述阳, 朱洁晨
(徐州医科大学附属医院呼吸内科,徐州 221000)
肥胖低通气综合征(obesity hypoventilation syndrome,OHS)是一种常见的与肥胖相关的睡眠呼吸紊乱疾病。肥胖是指体重指数(body mass index,BMI)≥30 kg/m2。90%的OHS合并阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA),OHS与OSA是两种独立疾病,其主要区别就是前者有日间清醒状态下有低氧血症或高碳酸血症。虽然都有打鼾、夜间窒息或憋气、日间极度嗜睡和晨起头痛、记忆力下降等相似症状,但是OHS与OSA相比,其花费医疗费用更高、生活质量更低、预后更差,更易出现糖尿病及心脑血管疾病等并发症,早期病死率更高[1-3]。未经治疗的OHS与单纯肥胖患者相比,18个月死亡率高达2倍多[4]。随着中国肥胖人数增加,OHS患病率也逐年上升。瘦素(leptin,LP),也称为饱腹激素,是哺乳动物脂肪细胞分泌的一种由肥胖基因(ob基因)编码的蛋白类激素。其主要功能是调节糖、脂代谢,抑制食欲、减少能量摄入、增加能量消耗、降低体重,同时瘦素还能作用于呼吸中枢,维持正常呼吸功能[5-7]。OHS患者存在高瘦素血症,说明OHS患者体内存在瘦素抵抗[8]。因此,OHS与瘦素的关系值得重视。下面初步探讨OHS患者血清瘦素水平的状况及其与颈围、腰围、动脉血气、多导睡眠图(polysomnography,PSG)等相关参数的相关性。
1 资料与方法
1.1 一般资料
选取2018年10月~2019年3月在徐州医科大学附属医院呼吸睡眠监测中心就诊的患者,经多导睡眠呼吸监测仪监测达到中华医学会呼吸病学分会睡眠呼吸障碍学组2011年阻塞性睡眠呼吸暂停低通气综合征诊治指南[9]标准者。OHS的诊断不仅要除外严重的阻塞性肺及气道疾病、间质性肺疾病、胸壁疾病、甲状腺机能减退、神经肌肉疾病和先天性中枢性肺泡低通气综合征等引起高碳酸血症的疾病,还需要行血气分析确诊符合日间高碳酸血症(在海平面水平PaCO2≥45 mmHg或PaO2<70 mmHg)以及合并睡眠呼吸紊乱[1]。所有受试者中OHS患者23例(AHI≥5次/min,BMI≥30 kg/m2,PaCO2≥45 mmHg或PaO2<70 mmHg) (OHS组),不伴有OHS的肥胖OSA患者40例(肥胖OSA组,AHI≥5次/min,BMI≥30 kg/m2,PaCO2<45 mmHg)、单纯肥胖者6例(单纯肥胖组,AHI<5次/min,BMI≥30 kg/m2,PaCO2<45 mmHg)和不伴肥胖OSA患者14例(非肥胖OSA组,AHI≥5次/min,BMI<30 kg/m2),另选取同期内经体检中心确定的正常健康成人10例(正常对照组,BMI<30 kg/m2)。单纯肥胖组和正常对照组中均未发现睡眠打鼾和睡眠呼吸暂停及低通气的临床表现,两组患者均无糖尿病及心脑血管疾病史。
1.2 研究方法
1.2.1 一般资料和PSG监测
所有受试者在监测当天禁饮酒及咖啡,停用镇静剂,晚20:00来到睡眠呼吸监测中心,询问吸烟、饮酒史,既往高血压、糖尿病、冠心病、脑梗塞等病史,测量身高、体重、颈围(在环甲膜上缘水平测量)、腰围(髌嵴顶和腋中线最后一根可触及肋骨下缘之间的中点测量),计算BMI[体重(kg)/身高2(m2)],进行爱泼沃斯思睡量表(ESS)评分。采用澳大利亚瑞思迈公司生产的多导睡眠监测仪ApneaLink进行至少7 h睡眠监测,睡眠期呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次/h,则诊断为OSA。
1.2.2 瘦素检测
各组均于PSG监测次日早晨8 h空腹抽取外周静脉血4 mL,离心后取血清,置-20 ℃冰箱保存待检。人血清瘦素采用酶联免疫分析测定,试剂盒由江莱生物公司提供,灵敏度为0.1 ng/mL,批内、批间变异系数分别小于9%和11%,监测范围为0.5~16 ng/mL,所有标本均严格按照说明书操作。
1.2.3 动脉血气分析
对BMI≥30 kg/m2的受试者次日于清醒状态下,室内安静休息至少0.5 h后,抽取桡动脉血1 mL,标本采集之后立即送检。
1.2.4 统计学方法
采用SPSS 19.0统计软件,计量资料采用均数±标准差表示,组间比较采用单因素的方差分析,进一步两两比较采用LSD法,不同参数之间的相关分析采用Pearson相关分析法分析,受试者工作特征曲线 (receiver operating characteristic curve,ROC曲线)分析相关参数对OHS的诊断预测作用,P<0.05差异有统计学意义。
2 结果
2.1 各组受试者一般资料比较
由表1可知,OHS组患者BMI及颈围明显高于其他各组(P<0.05),单纯肥胖组患者与其他各组相比年龄更小(P<0.05),总样本量分析男性发病率较女性高,但是无明显统计学差异(P>0.05)。

表1 各组受试者一般资料比较Table 1 Comparison in patients data of each group
注:a为与OHS组相比,P<0.05;b为与肥胖OSA组相比,P<0.05;c为与单纯肥胖组相比,P<0.05;d为与非肥胖OSA组相比,P<0.05;e为与正常对照组相比,P<0.05。合并症是指高血压、糖尿病。
2.2 各组受试者血清瘦素水平的比较
由表2可知,各组女性的瘦素水平都较男性高,但是差异无统计学意义(P>0.05)。OHS组患者血清瘦素水平最高,与其他各组相比,有显著性差异(P<0.01),且血清瘦素水平存在明显组间差异。

表2 各组受试者瘦素水平比较Table 2 Comparison in leptin level of each group
注:a为与OHS组相比,P<0.01;b为与肥胖OSA组相比,P<0.01;c为与单纯肥胖组相比,P<0.01;d为与非肥胖OSA组相比,P<0.01;e为与正常对照组相比,P<0.01
2.3 OHS组、肥胖OSA组和单纯肥胖组各组动脉血气分析与PSG监测指标比较
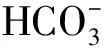
2.4 血清瘦素与各参数的相关性

2.5 BMI、颈围、腰围、血清瘦素预测OHS的ROC曲线
由图1~图4可知,ROC曲线下面积(AUG)分别为0.721、0.713、0.733、0.980。

图1 BMI对预测OHS的ROC分析Fig.1 ROC analysis of BMI for predicting OHS
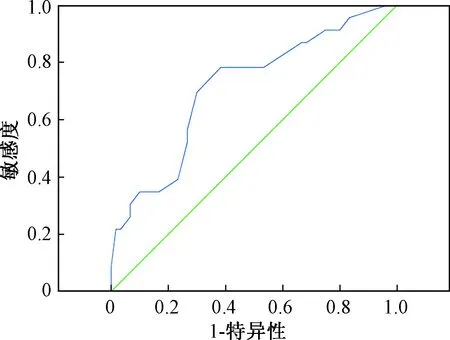
图2 颈围对预测OHS的ROC分析Fig.2 ROC analysis of neck circumference for predicting OHS

图3 腰围对预测OHS的ROC分析Fig.3 ROC analysis of waist circumference for predicting OHS

表3 肥胖组血气分析及PSG相关指标比较Table 3 Comparison of blood gas analysis and PSG related indicators in obese group
注:a为与OHS组相比,P<0.05;b为与肥胖OSA组相比,P<0.05;c为与单纯肥胖组相比,P<0.05。

表4 血清瘦素与相关参数的相关性分析Table 4 Correlation analysis of serum leptin and related parameters
注:分析数据来自OHS组、肥胖OSA组和单纯肥胖组(共69例)。
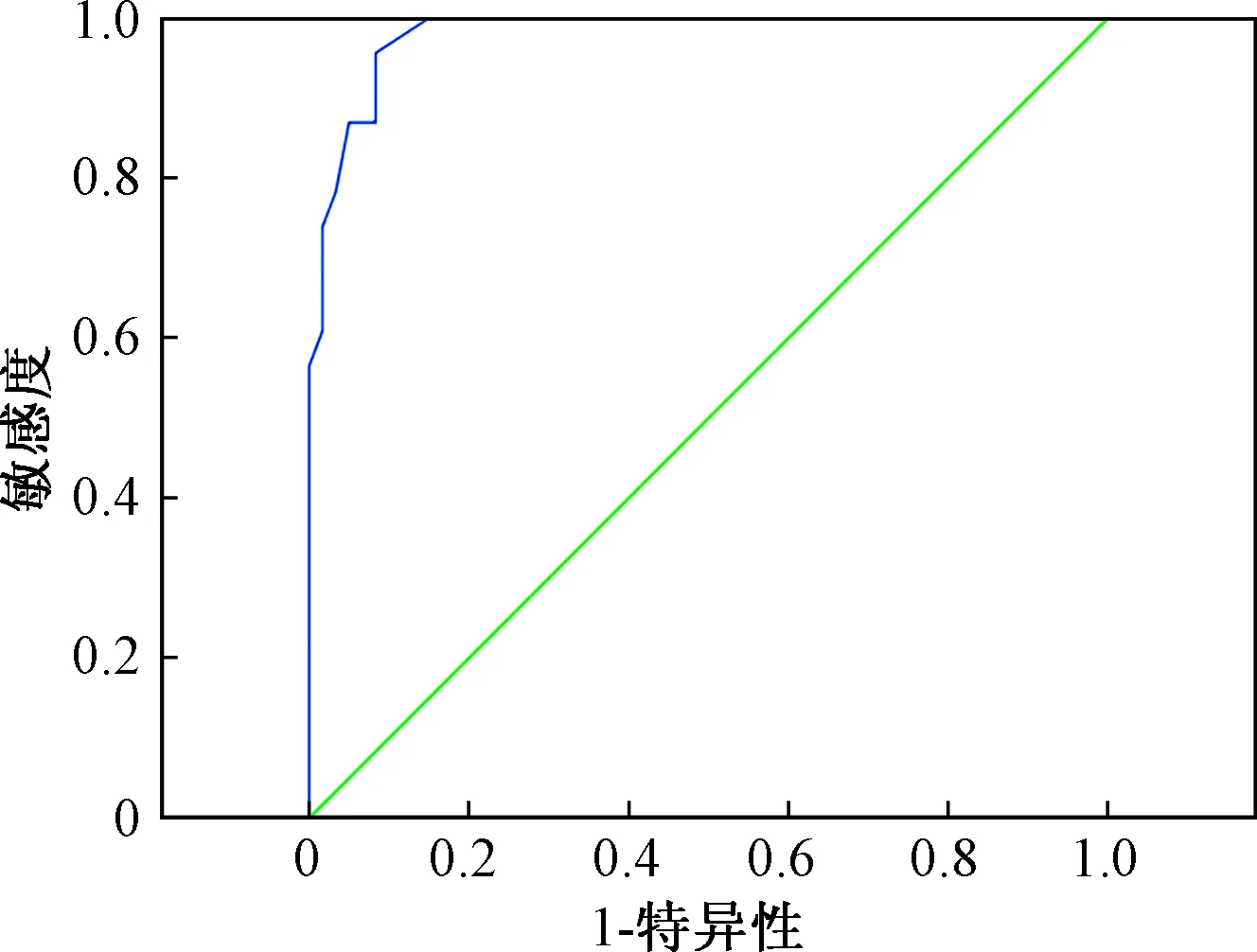
图4 血清瘦素对预测OHS的ROC分析Fig.4 ROC analysis of serum leptin for predicting OHS
3 讨论
OHS是病态肥胖的严重并发症之一。2016年《柳叶刀》发表全球成年人体重调查报告,显示全球成人肥胖人数已经超过体重正常人数,中国肥胖人数超越美国,成为全球肥胖人数最多的国家。随着肥胖人口数量的增加,OHS的发病率也逐年上升[10]。研究发现BMI>35 kg/m2的住院患者中,OHS的发病率高达31%[1]。其发病率随着BMI的升高而增加,本研究结果发现,OHS组患者的BMI明显高于其他各组,OHS组BMI平均值超过40 kg/m2,且本实验中BMI≥30 kg/m2的住院患者中OHS发病率达33%,与前人研究的结果大致相符。研究发现男性比女性OHS发病率更高[11],可能是由于女性体内孕激素刺激上气道肌肉和通气,从而降低了发病率[12]。此外,本研究发现无论是OHS组还是肥胖OSA组男性患病人数明显高于女性,但是差异无统计学意义。
OHS确切的发病机制尚不完全清楚,目前可以确定的机制有:肺功能受损、呼吸中枢驱动力改变、上气道阻力增加和瘦素抵抗[1]。瘦素能通过血脑屏障作用于下丘脑,维持体重、能量平衡和正常通气。虽然OHS患者存在高瘦素血症,但是由于瘦素抵抗,瘦素未能发挥正常生理功能。本研究结果发现OHS组血清瘦素水平明确高于其他各组(P<0.01),瘦素水平除了与BMI、颈围、腰围等相关外,与OHS本身也有关,因此当肥胖患者BMI明显升高,颈围、腰围变粗,血清瘦素水平升高时需要高度警惕OHS的发生。因此采用了ROC曲线进一步分析BMI、颈围、腰围、血清瘦素水平对OHS的诊断预测作用,发现AUG均大于0.7,表明上诉指标均对OHS的诊断有预测作用。尤其是血清瘦素水平,其AUG将近1.0,提示诊断价值最高。
OHS主要临床表现与OSA相似,如打鼾、夜间窒息或憋气、晨起头痛、胸闷、日间极度嗜睡和记忆力下降等,但是OHS和OSA是两种独立性疾病,其主要区别就是OHS存在日间高碳酸血症或/和低氧血症[13-14]。前者更易造成组织器官缺血、缺氧,并发症多,病死率高。Masa研究发现90%的OHS患者合并OSA,其原因是肥胖导致上呼吸道周围过多脂肪堆积和肺容量降低,从而导致咽部狭窄、加重气道塌陷,使上气道易于闭合或在睡眠时显著缩小[15]。实验中OHS组中合并78%(18/25)的OSA患者,未达到90%,可能因为就诊于睡眠室的大部分OHS患者是年轻患者,病程时间短,未合并OSA,或者因为样本量少,对统计结果产生了偏移。
OHS诊断的金标准是血气分析和PSG,但是动脉血气分析由于侵袭性高,未能在门诊及普通肥胖患者的筛查上普及,因此造成了部分OHS患者的漏诊。Macavei研究发现血清碳酸氢盐<27 mmol/L对排除OHS诊断的阴性预测值为97%,因此血清碳酸氢盐水平≥27 mmol/L时应引导临床医生进行验证性动脉血气分析[16]。但是本实验发现血清碳酸氢盐浓度与血清瘦素水平正相关,但是对预测OHS进行ROC分析,发现检测方法无效(Sig>0.01)。
综上所述,血清瘦素水平的升高与OHS本身发病机制有关,但是具体作用机制有待进一步研究。血清瘦素水平的升高对OHS的诊断具有预测作用,当肥胖患者出现高瘦素血症时需要进一步完善血气分析,早识别诊断,及时治疗,降低并发症和死亡率,改善预后。
4 结论
血清瘦素水平在OHS患者体内明显升高,与BMI、PaCO2等指标呈显著正相关。由于血清瘦素检测较动脉血气分析方便、侵袭性低,因此血清瘦素水平可以作为预测OHS的指标之一。该研究存在一些不足,尽管分组较多,但是由于就诊肥胖人群不多,各组样本数量较少,因此还需要扩大样本量,进一步明确OHS患者治疗前后体内血清瘦素水平变化特点。
