T7噬菌体穿孔素的克隆表达及对宿主损伤研究
2020-02-22徐海鲍熹董洪燕郭长明邓碧华卢宇朱善元
徐海 鲍熹 董洪燕 郭长明 邓碧华 卢宇 朱善元


摘要:为研究T7噬菌体穿孔素(Holin)蛋白对宿主细菌的增殖性能的影响,根据T7噬菌体gene 17.5设计引物,PCR扩增Holin基因和序列分析,将该基因插入原核表达载体构建重组表达菌BL-Holin。IPTG诱导Holin蛋白表达,SDS-PAGE和Western-blot检测目标蛋白。分光光度法测定Holin蛋白对宿主细菌增殖性能的影响,扫描电镜观察重组菌诱导后表面结构的损伤情况。结果表明,成功扩增Holin基因,构建的重组菌能高效表达Holin蛋白。T7噬菌体Holin蛋白含有1个跨膜区,氨基端位于胞外、羧基端位于胞内。Holin蛋白的表达量随诱导时间延长而逐渐增加,细菌浓度从诱导0 h至2 h逐渐升高,2 h后细菌浓度开始下降,直至6 h,电镜观察发现诱导细菌表面塌陷、皱缩进而死亡。研究结果显示,Holin蛋白具有抑菌活性,这为进一步开发噬菌体抗菌制剂提供应用基础和技术支持。
关键词:穿孔素;表达;宿主损伤;T7噬菌体
中图分类号: S188 文献标志码: A 文章编号:1002-1302(2020)24-0045-04
噬菌体是分子生物学起源与发展的模式生物,在发现之初就被用于细菌感染性疾病的治疗,随着人类进入抗生素时代使得噬菌体逐渐淡出人们的视野。近年来,细菌的耐药性已然成为全球范围内的公共健康问题,每年有近百万因耐药菌感染引起的死亡病例,面对这一严峻问题,人们开始寻找新的抗菌产品,这其中噬菌体作为细菌的天然杀手再次受到研究人员的关注[1-2]。然而,利用噬菌体防控细菌感染也面临一个棘手问题,噬菌体宿主识别谱窄,一种噬菌体往往只侵染一种或一类细菌,这限制了噬菌体在抗菌领域推广与应用[3]。烈性噬菌体裂解系统中的溶菌酶、穿孔素等蛋白作用于细菌的细胞壁、细胞膜,引起细菌裂解,效率高且不受宿主谱的限制,对细菌具有广谱的裂解活性,已成为开发新型抗菌制剂的热点之一[4-6]。
烈性噬菌体裂解宿主细菌的过程有着紧密的调控、遵循着严格的时间顺序[7-9]。溶菌酶-穿孔素二元裂解模型的提出对这一过程给予系统的解析。穿孔素是控制裂解时间的小分子量疏水性跨膜蛋白,在特定时间以寡聚体形式聚集于细胞内膜上并形成稳定的跨膜孔道,是噬菌体启动裂解步骤的“定时器”[10-12]。溶菌酶是一种胞质水解酶,随着孔道的打开,溶菌酶被释放到胞外,对肽聚糖层进行高效的切割[13-14]。近年来发现的Spanin蛋白对二元裂解模型做了进一步完善,该蛋白定位在细菌外膜,通过构象变化破坏细菌外膜结构[15-16]。在溶菌酶、穿孔素和Spanin的共同作用下,被侵染细菌彻底崩解。因此,研究上述3种蛋白与宿主细菌的作用关系,探明各自对宿主的损伤机制,才能更科学地加以利用。
T7噬菌体是侵染大肠杆菌的小型烈性噬菌体,具有良好的生长性能,侵染宿主细菌1~2 h即能完全裂解。对T7噬菌体的生物学背景已有相对全面的研究,其全部基因序列己经测定,是噬菌体研究的理想模型。本研究通过原核系统表达T7噬菌体穿孔素蛋白,分析其结构特征,揭示该蛋白对宿主的损伤作用,并测定其抑菌活性,以期为新型抗菌制剂的开发提供有益探索。
1 材料与方法
1.1 试验材料
质粒、菌株与噬菌体:质粒pET-28a(+)为笔者所在实验室保存。大肠杆菌BL21-DE3、T7 select 415-1b噬菌体购自Merck公司。
主要试剂:限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、反转录酶为大连宝生物公司产品;HRP标记抗His标签二抗购自Abcom公司;引物由金斯瑞生物公司合成,引物序列为:Holin-F:5′-ATACCATGGGCGTGCTATCATTAGACT-3′,Holin-R:5′-AGACTCGAGTCACTCCTTATTGGCT-3′,引入中下劃线分别表示限制酶切位点(NcoⅠ和 BamHⅠ);其余试剂均为分析纯。
1.2 Holin基因分析
将Holin基因翻译成对应蛋白序列,利用在线分析工具TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0)对其进行跨膜区预测;在Pfam数据库(http://pfam.xfam.org)进行比对,分析Holin蛋白所属的家族;Protparam工具(https://web.expasy.org/protparam)分析蛋白的理化性质;SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对蛋白质二级结构进行分析。
1.3 重组菌构建
以T7 select415-1b噬菌体基因组为模板,PCR扩增Holin基因。根据预设的酶切位点将基因片段插入原核表达载体pET-28a(+),构建重组表达质粒pET-Holin,NcoⅠ和BamHⅠ双酶切鉴定及测序分析。将序列正确的重组表达质粒化学转化导入大肠杆菌BL21-DE3感受态细胞,筛选表达Holin蛋白的重组菌BL-Holin。
1.4 Holin蛋白诱导表达与鉴定
挑取单菌落BL-Holin接入含有1 μg/mL卡那霉素的LB培养基中,37 ℃摇床过夜培养。取 50 μL 过夜培养菌液至5 mL新鲜卡那霉素抗性LB培养基中,37 ℃、200 r/min摇床培养2 h,加入工作浓度为0.5 mmol/L的IPTG进行诱导。同时,设BL21和BL-Holin未诱导对照。从诱导起始点开始,每隔2 h取样,经12% SDS-PAGE检测蛋白表达情况。转印蛋白至NC膜,用HRP标记的羊抗His tag二抗鉴定Holin蛋白。
1.5 Holin蛋白表达对宿主菌增殖的影响
以1 ∶ 100比例转接过夜培养的BL21、BL-Holin至新鲜培养基,在对数生长前期往重组菌 BL-Holin 中加入工作浓度为0.5 mmol/L的IPTG进行诱导,同时设BL21和未诱导对照组,于37 ℃、200 r/s摇床持续培养。从转接起始点开始每隔1 h取200 μL培养液测定D600 nm,绘制3组细菌的生长曲线。
1.6 Holin蛋白表达对宿主菌表面结构的影响
以1 ∶ 100比例转接过夜培养的BL-Holin重组菌,在对数生长前期加入IPTG进行诱导,持续诱导3 h,同时设未诱导对照。5 000 r/min,10 min收集重组菌,PBS重悬洗涤1次,再次离心后收集沉淀,采用4%多聚甲醛固定。样品送至扬州大学检测中心,扫面电镜观察细菌表面结构。
2 结果
2.1 Holin蛋白序列分析
利用多种生物学软件对T7噬菌体Holin蛋白进行分析:Protparam工具显示T7噬菌体Holin蛋白由67个氨基酸组成,相对分子质量为7 359,稳定系数为7.71,总平均亲水性为0.464,为稳定、疏水性蛋白质。Pfam数据库比对结果表面T7噬菌体Holin蛋白属于Phage_holin_2_2家族(PF10746)。TMHMM软件分析表明其氨基酸端1~36 aa位于胞外区,37~55 aa为跨膜区,56~67 aa的羧基端为胞内区。SOPMA工具显示,holin蛋白。α-螺旋、β-折叠、β-转角、延长链、和无规则卷曲分别占氨基酸总数的56.72%、0.00%、7.46%、10.45%和2537%(图1)。
2.2 Holin基因的克隆及重组质粒构建
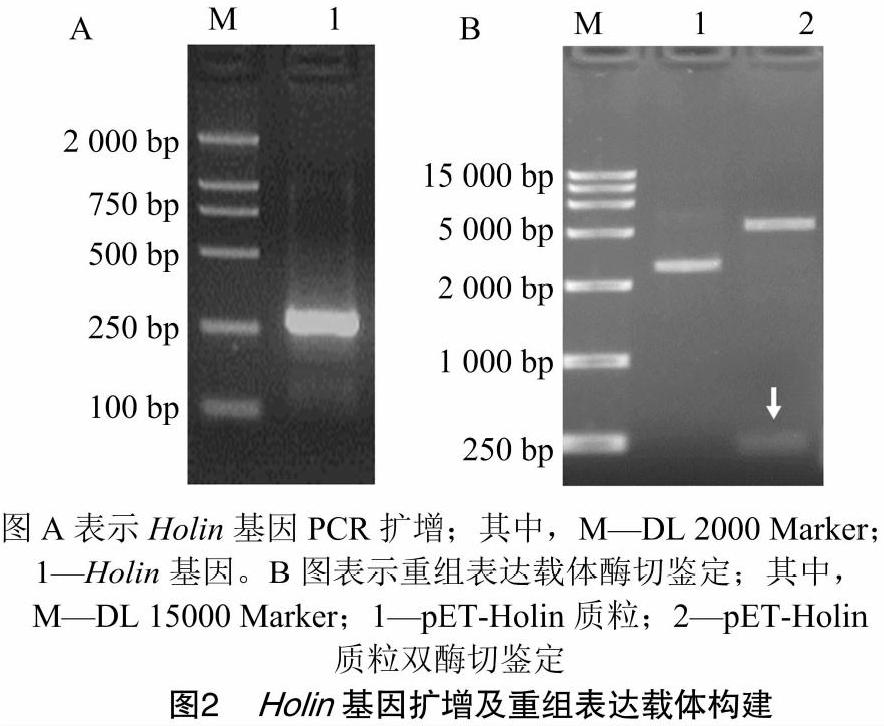
由图2-A和2-B可知,以T7噬菌体基因为模板,PCR扩增出约250 bp的Holin基因,测序结果表明获得基因片段序列正确。将该基因片段插入pET-28a(+)载体,成功构建重组表达质粒载体pET-Holin,NcoⅠ和BamHⅠ双酶切鉴定正确。
2.3 Holin蛋白诱导表达及鉴定
由图3-A可知,对数生长前期的重组菌BL-Holin经IPTG诱导后细菌浓度并未迅速上升,相反随着诱导时间的延长,重组菌出现裂解现象,培养液变清亮且泡沫增多。由图3-B可知,SDS-PAGE检测诱导菌有蛋白表达。由图3-C可知,利用Holin蛋白羧基端融合表达的His标签进行Western-blot检测,进一步确定诱导产生Holin蛋白,并且随着诱导时间的延长Holin蛋白的累积量逐渐增加。
2.4 Holin蛋白的表达对宿主细菌增殖的影响
IPTG诱导重组大肠杆菌BL-Holin表达Holin蛋白,通过对重组表达菌不同时间点的浊度测定来评价Holin蛋白对宿主细菌增殖能力的影响,由图4可知,BL-Holin转接后2 h开始诱导,细菌浊度缓慢上升至4 h,然后浊度逐渐下降,6~8 h浊度维持在较低水平,8 h后浊度开始缓慢上升。而未经诱导的BL-Holin表现出与BL21相似的增殖性能,表明Holin蛋白的表达抑制宿主的正常增殖。
2.5 Holin蛋白对宿主细菌表面结构的损伤
通过扫面电镜观察经IPTG诱导和未诱导的BL-Holin 重组菌表面结构变化,评价Holin蛋白对宿主的损伤情况。由图5-B可知,诱导表达Holin蛋白的重组菌表面塌陷,菌体皱缩,而未诱导的重组菌保持完整的表面结构(图5-A)。由此可知,重组菌表达Holin蛋白后造成胞膜的损伤,其结构完整性被破坏致使内容物释放到胞外,引起菌体死亡。
3 讨论
上世纪40年代开始,噬菌体研究进入早期的黄金时代,以λ噬菌体和T4噬菌体作为模式生物的相关研究为现代分子生物学的建立作出了卓越贡献。Young于1992年首次提出了著名的穿孔素-溶菌酶二元裂解系统理论,清晰地阐明了λ噬菌体裂解宿主的过程[17]。当然,这一理论将肽聚糖层的破坏作为裂解宿主菌的主要标志,却忽视了细菌外膜对裂解过程的阻碍。近年来,第三类裂解相關蛋白Spanin的发现进一步完善了该理论,至此λ噬菌体裂解宿主的过程可分为3个步骤:Holin蛋白在细菌内膜打孔,释放胞内溶菌酶切割肽聚糖层,Spanin通过构象变化撕裂细菌外膜,最终导致细菌的彻底崩解。参与这一过程的穿孔素、溶菌酶和Spanin均能造成细菌表面结构的损伤,因此被视为开发新型抗菌制剂的候选物质而备受关注。
T7噬菌体裂解系统研究报道较少,现已明确溶菌酶(gene3.5)、穿孔素(gene17.5)以及可能发挥Spanin功能的gene18.5/18.7构成了T7噬菌体裂解系统[15,18]。本研究对T7噬菌体Holin蛋白进行序列分析,发现该蛋白分子仅有1个跨膜区,属于Phage_holin_2_2家族(PF10746),氨基酸端位于胞外,羧基端位于胞内,这与报道的T4、T5噬菌体的Holin蛋白拓扑结构相同。为了不影响T7噬菌体Holin蛋白的跨膜转运,选择位于胞内的羧基端融合表达His标签用于Western-blot检测。结合图3-C和图4,重组菌诱导后2 h内Holin蛋白处于积累阶段,此时细菌浓度缓慢上升,当Holin蛋白量积累到一定阈值后造成细菌膜结构损伤,此时细菌浓度逐渐下降并维持在较低水平。继续诱导后期至8 h,此时Holin蛋白积累量仍然增加,而细菌浓度也逐步增加,对于这一现象尚需要进一步研究分析。由图5可见,Holin蛋白在细菌内膜聚集并形成孔道,由于缺少溶菌酶的释放,并不会对胞外结构造成直接破坏,但此时胞内可溶性蛋白、电解质等可通过孔道流失,菌体呈现塌陷、皱缩状态,最终死亡。
作为噬菌体裂解系统,穿孔素、溶菌酶无论单独使用还是联合使用,均能起到有效抑制细菌增殖的作用[19]。穿孔素还可以作为转运载体,辅助药物、核酸、蛋白质进入菌体内部,进一步提高抗菌效率[20-21]。此外,噬菌体在入侵宿主时需要在菌体表面开孔注入核酸物质,例如T7噬菌体的gp16能够水解细胞壁启动感染,这类蛋白也可以用作抗菌制剂的开发[22]。本研究对T7噬菌体的穿孔素进行原核表达,分析该蛋白的结构、评价其抑菌活性,并初步解析其损伤细菌膜结构的机制,这可为进一步研究穿孔素的抑菌机制以及开发利用穿孔素的抗菌活性做出有益的探索。
參考文献:
[1]Abedon S T. Use of phage therapy to treat long-standing,persistent,or chronic bacterial infections[J]. Advanced Drug Delivery Reviews,2019,145:18-39.
[2]Gorski A,Miedzybrodzki R,Wegrzyn G,et al. Phage therapy:current status and perspectives[J]. Medicinal Research Reviews,2020,40:459-63.
[3]Hyman P. Phages for phage therapy:isolation,characterization,and host range breadth[J]. Pharmaceuticals,2019,12(1):35.
[4]Baase W,Liu L,Tronrud D E,et al. Lessons from the lysozyme of phage T4[J]. Protein Science,2010,19(4):631-641.
[5]Junn H J,Youn J,Suh K H,et al. Cloning and expression of Klebsiella phage K11 lysozyme gene[J]. Protein Expression and Purification,2005,42:78-84.
[6]Yang D,Wang Q,Chen L Z,et al. Molecular characterization and antibacterial activity of a phage-type lysozyme from the Manila clam,Ruditapes philippinarum[J]. Fish & Shellfish Immunology,2017,65:17-24.
[7]Cahill J,Young R. Phage lysis:multiple genes for multiple barriers[J]. Advances in Virus Research,2019,103:33-70.
[8]Young R. Phage lysis:three steps,three choices,one outcome[J]. Journal of Microbiology,2014,52(3):243-258.
[9]Young R. Phage lysis:do we have the hole story yet[J]. Current Opinion in Microbiology,2013,16:790-7.
[10]Mehner-Breitfeld D,Rathmann C,Riedel T,et al. Evidence for an adaptation of a phage-derived holin/endolysin system to toxin transport in Clostridioides difficile[J]. Frontier in Microbiology,2018,9:2446.
[11]Fernandes S,Sao-Jose C. More than a hole:the holin lethal function may be required to fully sensitize bacteria to the lytic action of canonical endolysins[J]. Molecular Microbiology,2016,102(1):92-106.
[12]White R,Chiba S,Pang T,et al. Holin triggering in real time[C]//Proceedings of the National Academy of Sciences of the United States of America,108,2011:798-803.
[13]Proen?a D,Fernandes S,Leandro C,et al. Phage endolysins with broad antimicrobial activity against Enterococcus faecalis clinical strains[J]. Microbial Drug Resistance,2012,18(3):322-332.
[14]Matamp N,Bhat S G. Phage endolysins as potential antimicrobials against multidrug resistant vibrio alginolyticus and vibrio parahaemolyticus:current status of research and challenges ahead[Z]. 2019.
[15]Berry J,Rajaure M,Pang T,et al. The spanin complex is essential for lambda lysis[J]. Journal of Bacteriology,2012,194(20):5667-5674.
[16]Berry J,Savva C,Holzenburg A,et al. The lambda spanin components Rz and Rz1 undergo tertiary and quaternary rearrangements upon complex formation[J]. Protein Science,2010,19(10):1967-1977.
[17]Young R. Bacteriophage lysis:mechanism and regulation[J]. Microbiological Reviews,1992,56(3):430-481.
[18]Summer E J,Berry J,Tran T,et al. Rz/Rz1 lysis gene equivalents in phages of Gram-negative hosts[J]. Journal of Molecular Biology,2007,373(5):1098-1112.
[19]Lu N,Sun Y,Wang Q Q,et al. Cloning and characterization of endolysin and holin from Streptomyces avermitilis bacteriophage phiSASD1 as potential novel antibiotic candidates[J]. International Journal of Biological Macromolecules,2020,147:980-989.
[20]Saier M H Jr,Reddy B L. Holins in bacteria,eukaryotes,and archaea:multifunctional xenologues with potential biotechnological and biomedical applications[J]. Journal of Bacteriology,2015;197:7-17.
[21]Park S Y,Jy L,Chang W S,et al. A coupling process for improving purity of bacterial minicells by holin/lysin[J]. Journal of Microbiological Methods,2011,86(1):108-110.
[22]Heineman R H,Molineux I J,Bull J J. Evolutionary robustness of an optimal phenotype:re-evolution of lysis in a bacteriophage deleted for its lysin gene[J]. Journal of Molecular Evolution,2005,61(2):181-191.胡珊珊,陳开莉,陈红贤,等. 黑水虻抗菌肽的克隆及其生物信息学分析[J]. 江苏农业科学,2020,48(24):49-52.
