急性呼吸窘迫综合征患者的生物标志物与严重程度的相关性分析
2020-02-22叶连敏潘景业
叶连敏 潘景业

[摘要] 目的 探討急性呼吸窘迫综合征患者的生物标志物与严重程度的相关性。 方法 选择2017~2018年根据柏林定义诊断为ARDS而收住ICU的重症患者,入科48 h留取血标本,测定SP-D、IL-8浓度,并收集患者的基本临床数据和实验室指标。 结果 生存组和死亡组基本资料比较差异无统计学意义(P>0.05)。单因素分析:死亡组乳酸(3.80±1.22)mmol/L、氧合指数(99.91±36.70)mmHg、CRP[120.00(97.15,166.13)]mg/L、PCT[6.79(3.77,19.60)]ng/mL、APACHⅡ评分(26.25±6.82)分、SP-D[6274.39(3127.36,7996.32)]pg/mL、IL-8[61.57(54.13,79.78)]pg/mL差于生存组乳酸(2.50±0.59)mmol/L、氧合指数(173.66±46.92)mmHg、CRP[68.65(31.47,107.75)]mg/L、PCT[1.43(0.88,9.53)]ng/mL、APACHⅡ评分(18.83±6.09)分、SP-D[3961.03(1810.23,5053.25)]pg/mL、IL-8[22.53(15.81,26.75)]pg/mL,两组比较有统计学意义(P<0.05)。生存组和死亡组多因素分析:氧合指数、APACHⅡ评分为ARDS患者死亡的独立危险因素(OR=1.034,95%CI=1.000~1.069,P=0.048;OR=0.093,95%CI=1.005~1.450,P=0.044)。轻度、中度、重度ARDS患者血液SP-D、IL-8浓度逐渐增高,三组比较差异有统计学意义(F=109.090,P=0.000;F=9.544,P=0.002)。根据柏林定义,以氧合指数作为严重程度的指标,结果显示,SP-D、IL-8浓度和氧合指数均呈负相关(r=-0.680,P=0.001;r=-0.763,P=0.000)。 结论 ARDS患者的血SP-D和IL-8的浓度升高,且浓度随病情加重而升高。因此,血SP-D和IL-8可能成为ARDS的生物标志物,且可反映ARDS疾病的严重程度,为ARDS的治疗和预防提供依据。
[关键词] 急性呼吸窘迫综合征;氧合指数;生物标志物;炎症
[中图分类号] R563.8 [文献标识码] B [文章编号] 1673-9701(2020)36-0092-04
[Abstract] Objective To investigate the correlation between biomarkers and severity in patients with acute respiratory distress syndrome. Methods The severely ill patients diagnosed with ARDS according to the Berlin definition and admitted to ICU from 2017 to 2018 were selected. Blood samples were collected within 48 hours after admission. SP-D and IL-8 concentrations were measured. Basic clinical data and laboratory indicators were collected. Results There was no significant difference in basic data between the survival group and the death group(P>0.05). Univariate analysis showed that lactic acid(3.80±1.22)mmol/L, oxygenation index(99.91±36.70)mmHg, CRP(120.00[97.15,166.13])mg/L, PCT(6.79[3.77, 19.60])ng/mL, APACHⅡ score(26.25±6.82), SP-D (6274.39[3127.36, 7996.32])pg/mL, and IL-8(61.57[54.13, 79.78])pg/mL in the death group was worse than the lactic acid(2.50±0.59)mmol/L, oxygenation index(173.66±46.92)mmHg, CRP (68.65[31.47, 107.75])mg/L, PCT(1.43[0.88, 9.53])ng/mL, APACHⅡ score(18.83±6.09), SP-D(3961.03[1810.23, 5053.25])pg/mL, and IL-8[22.53(15.81, 26.75)]pg/mL in the survival group, and the difference between the two groups were statistically significant(P<0.05). Multivariate analysis of survival group and death group showed that the oxygenation index and APACHⅡ score were independent risk factors for death in ARDS patients(OR=1.034, 95%CI=1.000-1.069, P=0.048; OR=0.093, 95%CI=1.005-1.450, P=0.044). The blood SPD and IL-8 concentrations of patients with mild, moderate, and severe ARDS gradually increased, and the difference between the three groups was statistically significant(F=109.090, P=0.000; F=9.544, P=0.002). According to the Berlin definition, the oxygenation index is used as an indicator of severity. The results showed that SP-D, IL-8 concentration and oxygenation index were all negatively correlated(r=-0.680, P=0.001; r=-0.763, P=0.000). Conclusion The blood SP-D and IL-8 concentration in patients with ARDS increases, and the concentration increases with the disease's severity. Therefore, the blood SP-D and IL-8 may become the biomarkers of ARDS and reflect the severity of ARDS, which provides a basis for the treatment and prevention of ARDS.
[Key words] Acute respiratory distress syndrome; Oxygenation index; Biomarker; Inflammation
急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是指严重感染、休克、创伤等非心源性疾病过程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水肿,导致急性低氧性呼吸功能不全或呼吸衰竭,表现为进行性低氧血症和呼吸困难[1]。ARDS患者的死亡率很高,高达24%~46%[2]。尽管近年来人们在ARDS的定义、管理和治疗方面取得了重大进展和发展,但很少有前瞻性研究探讨急性呼吸窘迫综合征肺表面活性物质及炎症因子等生物标志物。ARDS中潜在的有用生物标志物试验尚未被应用于临床实践,缺乏有效的生物标志物来定义、诊断、监测对治疗的反应性或预测ARDS的预后,限制了该领域的进展。由于很难找到单一的生物标志物来区分ARDS患者与没有ARDS的患者,鉴于ARDS复杂的病理生理学,两个生物标志物的组合更有可能被识别[3],本研究的主要目的是通过检测急性呼吸窘迫综合征患者血液中的肺表面活性物质相关蛋白D(Pulmonary surfactant associated protein D,SP-D)及白细胞介素-8(Interleukin-8,IL-8)等生物标志物,探讨两者在ARDS诊断中的意义及与ARDS严重程度的相关性。
1 资料与方法
1.1 一般资料
选择2017~2018年根据临床病史、辅助检查,用柏林定义诊断为ARDS而收住重症医学科的重症患者,所有入组患者入科后皆签署知情同意书。入选标准为:年龄>18~<70岁;需要接受有创或者无创机械通气支持。排除标准:妊娠女性患者、COPD Ⅲ级患者、先天性心脏病患者、肺栓塞患者、间质性肺病、心源性肺水肿患者、血胸或者气胸患者、需要行胸部或者腹部手术治疗的患者、严重颅脑外伤患者(GCS评分小于10分)、肿瘤或者其他终末期患者、已入组其他研究的患者。柏林定义标准[4]:(1)1周内急性起病的已知损伤或新发的呼吸系统症状;(2)不能用心功能不全或液体过负荷所解释的呼吸衰竭;(3)X线或CT扫描示双肺致密影,不能为胸腔积液、结节、肿块、肺叶塌陷所完全解释;(4)在PEEP≥5 cmH2O的同时根据氧合指数分级:轻度为200 mmHg<(PaO2/FiO2)≤300 mmHg;中度为100 mmHg<(PaO2/FiO2)≤200 mmHg;重度为(PaO2/FiO2)≤100 mmHg。
1.2 血液标本的采集
入科48 h留取血标本,标本离心后取上清液放入EP管保存、冷冻,采用双抗体夹心酶联免疫(ELISA)法集中进行测定SP-D、IL-8浓度,并收集患者的基本临床数据和实验室指标,包括性别、年龄、身高、体重、住院时间、乳酸、血气分析、C反应蛋白(CRP)、降钙素原(PCT)、SOFA评分及APACHⅡ评分,并根据28 d死亡率,把所有病例分成生存组(12例)和死亡组(8例)进行汇总分析。
1.3 统计学分析
采用SPSS20.0统计学软件包进行统计,正态分布计量资料以(x±s)表示,非正态分布计量资料以中位数(四分位数)表示,ARDS生存组与死亡组的组间比较采用t检验或Mann-Whitney U检验;计数资料以例数表示,组间比较用卡方检验或方差分析,多因素分析采用二元Logistic回归,并对SP-D、IL-8浓度和ARDS的严重程度进行相关性分析。P<0.05为差异有统计学意义。
2 结果
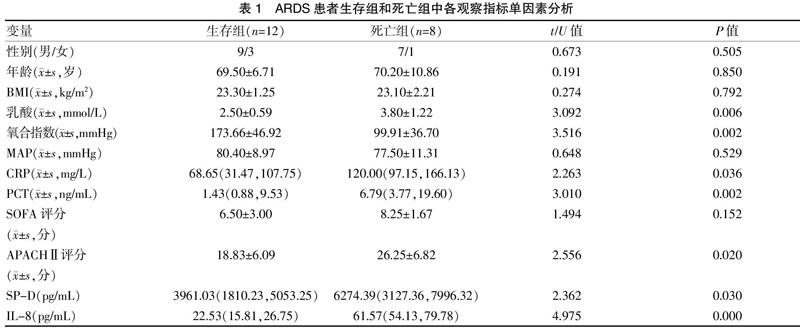
2.1 生存组和死亡组基本资料比较
性别、年龄、BMI、入科时MAP、SOFA评分两组比较差异无统计学意义(P>0.05)。见表1。原发疾病方面,生存组12例中,肺部感染8例,胸部外伤3例,颅脑损伤1例;死亡组8例中,肺部感染6例,颅脑损伤2例。
2.2 生存组和死亡组实验室检查单因素分析
乳酸、氧合指数、CRP、PCT、APACHⅡ评分、SP-D、IL-8等指标比较,差异有统计学意义(P<0.05)。见表1。
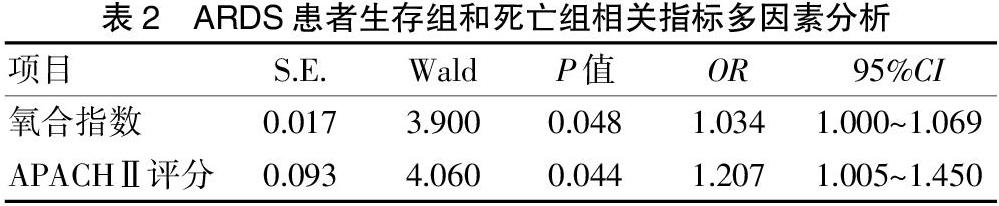
2.3 生存组和死亡组相关指标多因素分析
把单因素分析中乳酸、氧合指数、CRP、PCT、APACHⅡ评分、SP-D、IL-8等指标进行多因素Logistic回归分析,发现氧合指数、APACHⅡ评分是ARDS患者死亡的危险因素。见表2。
2.4 不同严重程度ARDS患者血液SP-D、IL-8浓度变化
根据氧合指数将ARDS患者分成轻度、中度和重度,在20例ARDS患者中,輕度5例(25%),中度11例(55%),重度4例(20%)。不同严重程度ARDS患者血液SP-D、IL-8浓度逐渐增高,三组比较差异有统计学意义(P<0.05)。见表3。
2.5 总ARDS患者中SP-D、IL-8浓度和ARDS的严重程度的相关性分析
根据柏林定义,以氧合指数作为严重程度的指标,研究生存组及死亡组共20例患者血液中SP-D、IL-8浓度和ARDS的严重程度的相关性分析。结果显示,SP-D、IL-8浓度和氧合指数均呈负相关(P<0.05)。见图1。
3讨论
急性呼吸窘迫综合征是炎症细胞及其介质、细胞因子引发的全身炎症反应[5]。过度的全身炎症反应或抗炎反应引起肺泡毛细血管损伤,通透性增加和微血栓形成,肺泡上皮损伤,表面活性物质减少或消失,导致肺水肿、肺泡内透明膜形成和肺不张,从而引起肺的氧合功能障碍,导致顽固性低氧血症[6]。ARDS除与肺部疾病的直接损伤有关外,肺外疾病引起严重的全身炎性反应,也能导致严重的ARDS,如脓毒症、急性胰腺炎、多发性损伤、急性颅脑损伤等[7-8]。本研究中肺内因素导致的ARDS有肺部感染、胸部外伤。肺外因素主要为颅脑损伤。
SP-D是肺上皮損伤的生物标志物。这种糖蛋白主要由肺泡上皮Ⅱ型细胞产生,对维持肺泡的完整性起着至关重要的作用。除了减少肺泡表面张力,SP-D还具有天然免疫作用,并具有抗微生物功能[9]。一些研究发现血浆SP-D水平升高与ARDS的诊断及更差的临床结果有关[10],ARDS患者48 h后血浆SP-D水平升高,而肺保护性通气途径通气的患者SP-D水平升高较小[11]。在一项对100例患者进行的回顾性病例对照研究中,发现血浆中SP-D水平有助于ARDS与败血症的鉴别,也表明SP-D是ARDS的一个很好的生物标志物[12]。Zogheib等[13]发现高血清SP-D水平被描述为与甲型H1N1流感病毒感染相关的ARDS重症监护病房患者预后较差的预测因子。SP-D仍然被纳入了用于诊断和死亡预测的生物标记物的研究中[14]。
IL-8是一种促炎性细胞因子,在肺中性粒细胞和单核细胞趋化中起调节作用[15]。在患有ARDS的成人中,IL-8的持续升高已经被报道[16],且是ARDS的病理生理过程的关键介质[17],在预测ARDS的生存方面显示出前景。此外,与较高的潮气量相比,肺保护性通气患者的血浆IL-8降低。因此,先前的一些ARDS新疗法的早期试验将血浆生物标志物如IL-8的测量作为终点[18]。也有文献指出,对于ARDS的治疗,在给药前通过缺氧预处理来减轻IL-8的分泌对患者有益[19]。
本研究显示ARDS患者死亡组和生存组的单因素分析显示,乳酸、氧合指数、CRP、PCT、APACHⅡ评分有统计学意义,表明死亡组的病情较生存组更重。尤以氧合指数是ARDS轻、中、重分级中的主要指标。通过表1可见,死亡组患者的SP-D和IL-8的浓度,较生存组明显升高,因此推测,患者血中SP-D和IL-8的升高,有助于判断患者是否患有ARDS。由表3可知,轻度、中度、重度ARDS患者血液SP-D、IL-8浓度逐渐增高,其原因是大量SP-D抵消了炎症的抑制作用,同时IL-8使大量中性粒细胞向炎症区聚集,使肺泡和肺间质水肿,导致炎症爆发,所导致的ARDS就越重[20-21]。且图1显示,SP-D与IL-8的浓度与氧合指数有很好的相关性,呈负相关,表明患者氧合指数越低,病情越重,SP-D与IL-8的浓度会越高,为ARDS的治疗将提供很好的实验室检查指标。但是在ARDS患者生存组和死亡组相关指标的多因素分析中,氧合指数、APACHⅡ评分是ARDS患者死亡的危险因素,这和临床工作中所见一致。而SP-D和IL-8在本研究中未显示和死亡是否相关,主要原因可能是本研究的病例数太少导致,将来仍需更大样本的研究,以验证两者是否为ARDS死亡的独立危险因素。
本研究有其局限性,因没有非ARDS组作对照,遂非ARDS组的血SP-D和IL-8浓度是否亦会明显升高,本研究无法论证。
综上所述,本研究结果显示,ARDS患者的血SP-D和IL-8的浓度升高,且浓度随病情加重而升高。因此,血中SP-D和IL-8可能成为ARDS的生物标志物,且可反映ARDS疾病的严重程度,为ARDS的治疗和预防提供依据。
[参考文献]
[1] Haeberle H,Prohaska S,Martus P,et al. Therapeutic iloprost for the treatment of acute respiratory distress syndrome(ARDS)(the ThIlo trial):A prospective,randomized,multicenter phase II study[J]. Trials,2020,21(1):1-11.
[2] Pais FM,Sinha P,Liu K D,et al. Influence of clinical factors and exclusion criteria on mortality in ARDS observational studies and randomized controlled trials[J]. Respiratory Care,2018,63(8):1060-1069.
[3] Li S,Chen S,Wang B,et al. A robust 6-lncRNA prognostic signature for predicting the prognosis of patients with colorectal cancer metastasis[J]. Frontiers in Medicine,2020,7:56-66.
[4] Yang P,Wu T,Yu M,et al. A new method for identifying the acute respiratory distress syndrome disease based on noninvasive physiological parameters[J]. PloS ONE,2020, 15(2):e0226 962.
[5] Liu G,Lv H,An Y,et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury[J]. International Journal of Molecular Medicine,2018, 41(5):2527-2534.
[6] Pooladanda V,Thatikonda S,Bale S,et al. Nimbolide protects against endotoxin-induced acute respiratory distress syndrome by inhibiting TNF-α mediated NF-κB and HDAC-3 nuclear translocation[J]. Cell Death & Disease,2019,10(2):1-17.
[7] Antoniou KM,Karagiannis K,Tsitoura E,et al. Clinical applications of mesenchymal stem cells in chronic lung diseases[J]. Biomedical Reports,2018,8(4):314-318.
[8] Lv W,Wang S,Wang L,et al. G994T polymorphism in exon 9 of plasma platelet-activating factor acetylhydrolase gene and lung ultrasound score as prognostic markers in evaluating the outcome of acute respiratory distress syndrome[J].Experimental and Therapeutic Medicine,2019, 17(4):3174-3180.
[9] Yousefi S,Sharma SK,Stojkov D,et al. Oxidative damage of SP-D abolishes control of eosinophil extracellular DNA trap formation[J].Journal of Leukocyte Biology,2018,104(1):205-214.
[10] Yoshikawa T,Otsuka M,Chiba H,et al. Surfactant protein A as a biomarker of outcomes of anti-fibrotic drug therapy in patients with idiopathic pulmonary fibrosis[J]. BMC Pulmonary Medicine,2020,20(1):27-35.
[11] Stapleton RD,Suratt BT,Neff MJ,et al. Bronchoalveolar fluid and plasma inflammatory biomarkers in contemporary ARDS patients[J]. Biomarkers,2019,24(4):352-359.
[12] Nagre N,Cong X,Ji H L,et al. Inhaled TRIM72 protein protects ventilation injury to the lung through injury-guided cell repair[J]. American Journal of Respiratory Cell and Molecular Biology,2018,59(5):635-647.
[13] Zogheib E,Nyga R,Cornu M,et al. Prospective Observational Study on the association between serum mannose-binding lectin levels and severe outcome in critically Ill patients with pandemic influenza type A(H1N1)infection[J].Lung,2018,196(1):65-72.
[14] Li X,Wei X,Chen C,et al. N-Acetylcysteine inhalation improves pulmonary function in patients received liver transplantation[J]. Bioscience Reports,2018,38(5):BSR2018 0858.
[15] Flori H,Sapru A,Quasney MW,et al. A prospective investigation of interleukin-8 levels in pediatric acute respiratory failure and acute respiratory distress syndrome[J].Critical Care, 2019,23(1):128-136.
[16] 桑智慧,邢佳麗,陈建荣.急性呼吸窘迫综合征患者呼出气冷凝液和血清中IL-8检测的临床意义[J].临床急诊杂志,2017,18(10):735-739.
[17] Bime C,Casanova N,Oita R C,et al. Development of a biomarker mortality risk model in acute respiratory distress syndrome[J]. Critical Care,2019,23(1):410-419.
[18] 曾宪飞,卢东雪,张西京,等.5种血清学标志物对急性呼吸窘迫综合征的诊断和预后预测价值[J].西安交通大学学报(医学版),2019,40(4):588-592,618.
[19] Antebi B,Rodriguez LA,Walker KP,et al. Short-term physiological hypoxia potentiates the therapeutic function of mesenchymal stem cells[J]. Stem Cell Research & Therapy,2018,9(1): 265-274.
[20] 周浩,陈建荣,陈金亮,等.SP-D在急性呼吸窘迫综合征中的研究进展[J].临床急诊杂志,2018,19(12):866-869,872.
[21] 解霞,王秋霞,常明,等.新生儿ALI/ARDS支气管肺泡灌洗液中炎症因子和肺表面活性蛋白的变化及意义[J].广东医学,2018,39(16):2433-2436.
(收稿日期:2020-09-28)
