黄芪总黄酮体外抗炎作用及对MAPKs信号通路的调控
2020-02-22周鸿缘葛冰洁李海涛张雪梅
周鸿缘,张 贤,王 萌,葛冰洁,王 政,李海涛,2* ,张雪梅*
(1.延边大学 农学院,吉林 延吉 133002;2.中国农业科学院 特产研究所,吉林 长春 130112)
炎症是保护宿主免受病原体或机械损伤的基本免疫反应[1]。动物传染性疾病、寄生虫所致病变以及一些外伤都可以使动物产生炎症病变,在兽医学相关领域的研究愈发重要[2]。黄芪为豆科植物黄芪的干燥根,其拥有悠久的药用历史[3]。黄芪成分众多,主要包括黄芪多糖类、黄酮类、皂苷类、氨基酸、生物碱及多种微量元素[4]。黄芪总黄酮(TFA)作为黄芪的主要有效成分,可以提高机体对损伤的抵抗力,具有抗炎、抗氧化、抗突变、抗肿瘤、抑制动脉粥样硬化等生物学效应[5-6]。
LPS是一种常用的炎症诱导剂,通过刺激TLR4途径发挥作用,从而激活其下游相关信号通路,刺激巨噬细胞产生转录因子,可见巨噬细胞在炎症的发生、发展中起着重要的作用[7]。本试验以传统中药黄芪的主要成分TFA为研究对象,以LPS刺激的RAW264.7细胞为模型,从炎性介质、炎性因子以及MAPKs信号通路3个部分探讨其体外抗炎作用及其机制,为TFA的进一步研究与开发利用提供理论依据。
1 材料与方法
1.1 细胞与药物小鼠腹腔巨噬细胞RAW264.7来源于北京协和细胞中心;TFA购于南京泽朗生物公司。
1.2 主要试剂LPS、DMSO和MTT购自Sigma公司;Trizol试剂购自Invitrogen公司;NO、PGE2检测试剂盒购于碧云天生物研究所;细胞因子ELISA试剂盒购于R&D公司;RT-PCR一步法转录试剂盒购于TaKaRa公司;蛋白裂解液购于索莱宝试剂有限公司;一抗iNOS、COX-2与p38、ERK1/2、JNK、p-p38、p-ERK1/2、p-JNK以及二抗山羊抗鼠单抗购于Santa Cruz公司。
1.3 MTT法检测TFA细胞毒性正常条件下培养RAW264.7细胞至对数生长期,配置细胞浓度为5×105个/mL的细胞悬液。每孔100 μL细胞悬液接种于96孔培养板上,根据试验分组加入不同质量浓度梯度的TFA(0~200 mg/L),设重复孔,37 ℃、5% CO2培养箱中孵育12 h后,每孔加入50 μL MTT,继续于培养箱中孵育4 h,再用1 mg/L DMSO溶解沉淀,酶联免疫检测仪测定在490 nm处吸光度,计算细胞存活率。
1.4 Griess法和ELISA法检测炎性介质NO和PGE2的含量以l mg/L LPS诱导的RAW264.7为模型进行试验,分别设立空白组、模型组以及TFA低、中、高(10,25和100 mg/L)剂量组。取对数生长期状态良好的RAW264.7细胞,调整细胞浓度为5×105个/mL接种于96孔板上,设立重复孔,培养12 h后,分别用不同浓度的TFA处理。收集细胞上清液,用Griess法和ELISA法检测各试验组在3,6,12,24 h时RAW 264.7细胞上清液中NO和PGE2的含量。
1.5 ELISA法检测炎性因子IL-1β、IL-6、TNF-α和IFN-γ的含量试验分组、建模及给药流程同步骤1.4,收集细胞上清液与细胞沉淀,细胞沉淀留为后续试验备用。按照细胞因子检测试剂盒操作说明,测定各试验组在3,6,12,24 h时RAW 264.7细胞上清液中IL-1β、IL-6、TNF-α和IFN-γ的分泌量。
1.6 RT-PCR法检测iNOS和COX-2 mRNA的含量收集步骤1.5在12 h所保留的细胞沉淀,PBS缓冲液洗涤离心后,使用Trizol、异丙醇、无菌水等试剂提取各试验组RAW264.7细胞总RNA,并测定其浓度与纯度,依照RT-PCR一步法反转录试剂盒进行反转录与PCR扩增试验,再通过1%~1.5%琼脂糖凝胶电泳对各组iNOS和COX-2 的PCR产物进行含量分析。PCR扩增序列引物设计如下:其中COX-2(F):5′-GGAGAGACTATCAAGATAGT-3′;COX-2(R):5′-ATGGTCAGTAGACT-TTTACA-3′。INOS(F):5′-GAGCGAGTTGTGGATTGTC;INOS(R):CTCCTTTGAGCCCTTTGT-3′。β-actin(F):CTGTCCCTGTATGCCTC-TG-3′;β-actin(R):5′-ATGTCACGCACGAT-TTCC-3′。
1.7 Western blot法检测MAPKs信号通路中相关蛋白的表达使用无菌细胞培养瓶在正常条件下培养RAW264.7细胞至对数生长期,根据步骤1.4进行试验分组、建模与给药。培养12 h后收集各试验组细胞沉淀,用RIPA蛋白裂解液(含PMSF)提取总蛋白,BCA试剂盒测定蛋白质浓度。各试验组样品进行SDS-PAGE凝胶电泳,转移到PVDF膜,5%脱脂牛奶封闭,4℃过夜孵育一抗(iNOS、COX-2与p38、ERK1/2、JNK及其磷酸化抗体),室温孵育二抗(山羊抗鼠单抗),最后用ECL显色液在成像系统下观察iNOS和COX-2蛋白表达水平以及MAPK信号通路中p38、ERK1/2、JNK的磷酸化水平。
1.8 结果处理与统计分析应用SPSS 20.0软件,对统计结果进行单因素ANOVA、t检验比较。P<0.01为差异极显著,P<0.05为差异显著,P>0.05为差异不显著。
2 结果
2.1 TFA细胞毒性测定结果用MTT法检测经TFA处理后RAW264.7细胞的存活率,确定TFA的安全给药剂量。由图1可知,0~100 mg/L TFA对RAW264.7细胞无明显毒性;当TFA质量浓度高于150 mg/L时,出现显著毒性(P<0.05)。根据这一结果,确定TFA最大安全质量浓度为100 mg/L。因此,拟定TFA低、中、高剂量组的给药质量浓度分别为10,25,100 mg/L。
2.2 TFA对LPS诱导的RAW 264.7细胞炎性介质NO和PGE2含量的影响NO和PGE2的含量变化如表1所示,与空白组相比,LPS刺激后细胞上清液中NO含量显著增加,3 h后差异极显著(P<0.01);与模型组相比,高剂量组NO含量在6,12和24 h均呈极显著差异(P<0.01);TFA中剂量组NO含量在6,24 h显著下降(P<0.05),在12 h极显著下降(P<0.01);TFA低剂量组NO含量在给药12 h后极显著降低(P<0.01)。说明TFA能不同程度地抑制LPS刺激的RAW264.7细胞的NO含量。

图1 TFA对RAW264.7细胞的毒性测定结果
模型组与空白组相比,细胞上清液中PGE2含量变化极显著(P<0.01);与模型组相比,TFA高剂量组PGE2含量在4个时间点上均呈极显著下降趋势(P<0.01);TFA中剂量组PGE2含量在3,6和24 h均呈极显著下降趋势(P<0.01),在12 h呈显著下降趋势(P<0.05);TFA低剂量组PGE2含量在6 h极显著下降(P<0.01),在12 h显著下降(P<0.05)。说明TFA能不同程度地下调LPS刺激的RAW264.7细胞的PGE2含量。
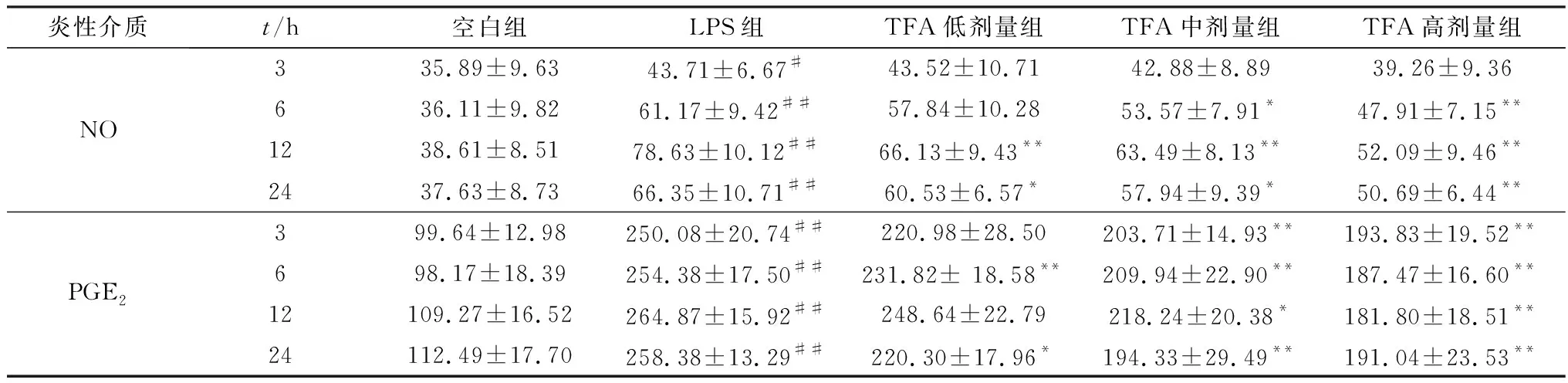
表1 TFA对LPS诱导的RAW264.7 细胞NO和PGE2含量的影响
2.3 TFA对LPS诱导的RAW264.7细胞炎性因子IL-1β、IL-6、TNF-α和IFN-γ分泌的影响各试验组RAW264.7细胞上清液IL-1β、IL-6、TNF-α和IFN-γ的含量见表2。与空白组相比,LPS刺激后,模型组细胞上清液中IL-1β、IL-6、TNF-α和IFN-γ的含量均极显著上升(P<0.01)。
与模型组相比,TFA高剂量组IL-1β含量在4个时间点上均呈极显著下降趋势(P<0.01),而TFA中、低剂量组IL-1β也显示出一定的下降趋势,且在相同时间点满足一定的剂量依赖关系;TFA中剂量组IL-6含量在3,6 h极显著下降(P<0.01),在12 h后显著下降(P<0.05),TFA高、低剂量组IL-6含量在4个时间点上均呈极显著下降趋势(P<0.01);TFA高剂量组TNF-α含量均极显著降低(P<0.01),而TFA中、低剂量组对TNF-α含量在不同时间点也有一定的抑制效果;TFA高剂量组IFN-γ含量呈极显著下降趋势(P<0.01),TFA中剂量组IFN-γ含量在6,12和24 h显著降低(P<0.05),TFA低剂量组IFN-γ的含量在6,12 h也显著降低了(P<0.05)。说明TFA在一定程度上可以明显抑制LPS诱导条件下RAW264.7细胞IL-1β、IL-6、TNF-α和IFN-γ的过度分泌。
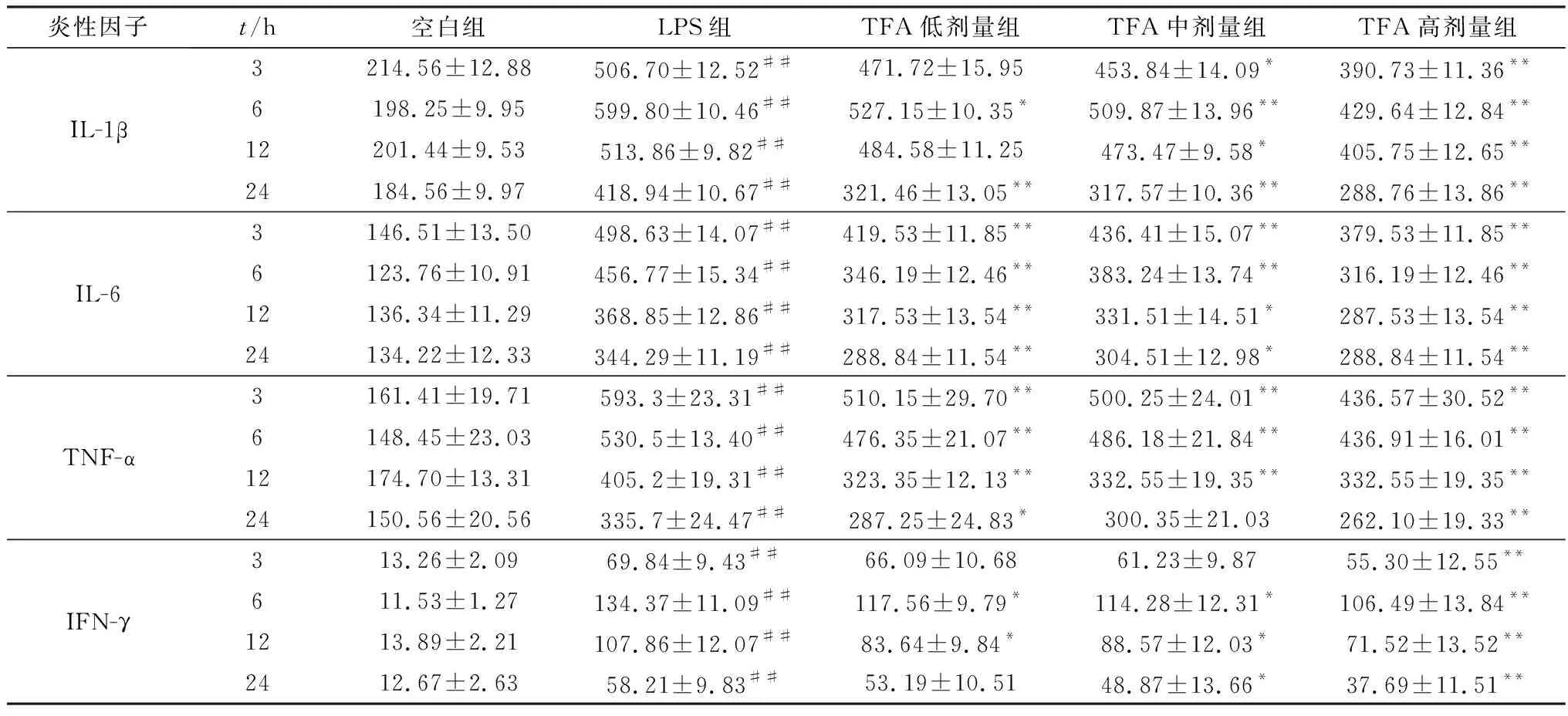
表2 TFA对LPS诱导条件下RAW264.7细胞IL-1β、IL-6、TNF-α和IFN-γ分泌的影响
2.4 TFA对LPS诱导的RAW264.7细胞iNOS和COX-2 mRNA表达的影响由图2可知,与空白组相比,模型组RAW264.7细胞iNOS和COX-2 mRNA的表达量极显著升高(P<0.01);与模型组相比,TFA各剂量组均能有效降低 iNOS mRNA表达量(P<0.01);TFA高、中剂量组COX-2 mRNA表达量没有显著差异(P>0.05),而TFA低剂量组iNOS mRNA表达量呈现极显著降低趋势(P<0.01)。说明TFA在一定条件下可有效抑制iNOS和COX-2mRNA的过度表达。
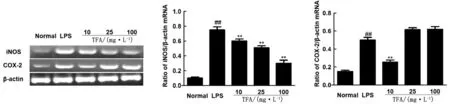
图2 TFA对LPS诱导的RAW264.7 细胞iNOS和COX-2 mRNA表达的影响
2.5 TFA对LPS诱导的RAW264.7细胞iNOS和COX-2蛋白表达的影响结果如图3所示,与空白组相比,模型组RAW264.7细胞iNOS和COX-2蛋白表达量极显著升高(P<0.01);与模型组相比,TFA高、中剂量组iNOS蛋白表达量极显著降低(P<0.01),TFA低剂量组iNOS蛋白表达量显著降低(P<0.05);TFA各剂量组COX-2蛋白量均呈极显著下降趋势(P<0.01)。说明TFA各剂量组均能有效抑制iNOS和COX-2蛋白表达,且呈一定剂量依赖性。
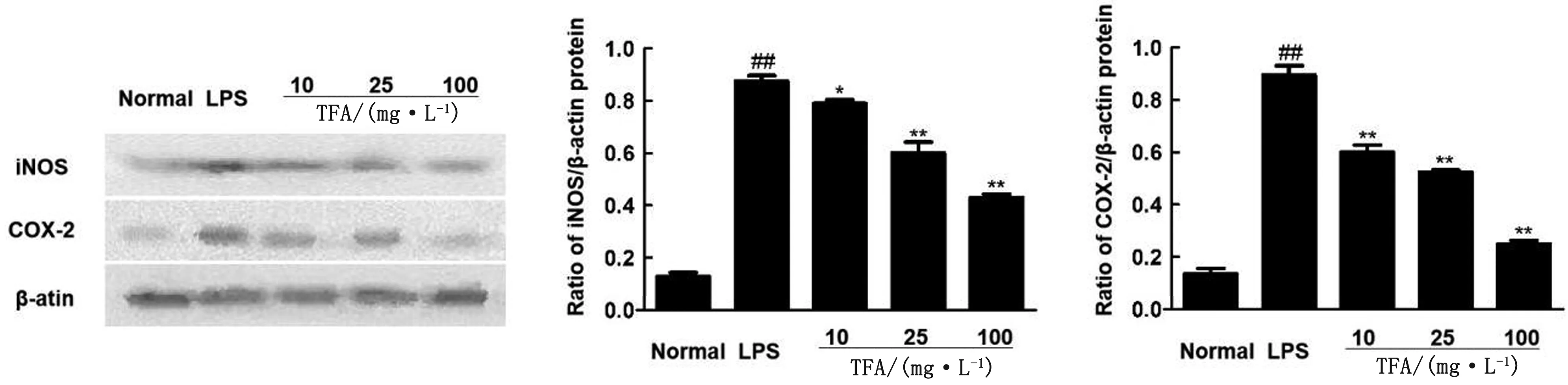
图3 TFA对LPS诱导的RAW264.7细胞iNOS和COX-2蛋白表达的影响
2.6 TFA对LPS诱导的RAW264.7细胞MAPKs信号通路的影响为进一步研究TFA抗炎机制,本试验检测了MAPKs信号通路p38、JNK、ERK1/2的磷酸化水平。结果如图4所示,与空白组相比,模型组RAW264.7 细胞p-p38、p-JNK和p-ERK1/2 蛋白表达量均极显著上升(P<0.01);与模型组相比,TFA高、中、低剂量组RAW264.7 细胞p-p38、p-JNK蛋白表达量均呈极显著下降趋势(P<0.01),且具有一定的剂量依赖性;TFA各剂量组p-ERK1/2的蛋白表达量无显著性差异(P>0.05)。说明TFA可降低MAPKs信号通路关键蛋白p38和JNK的过度磷酸化。
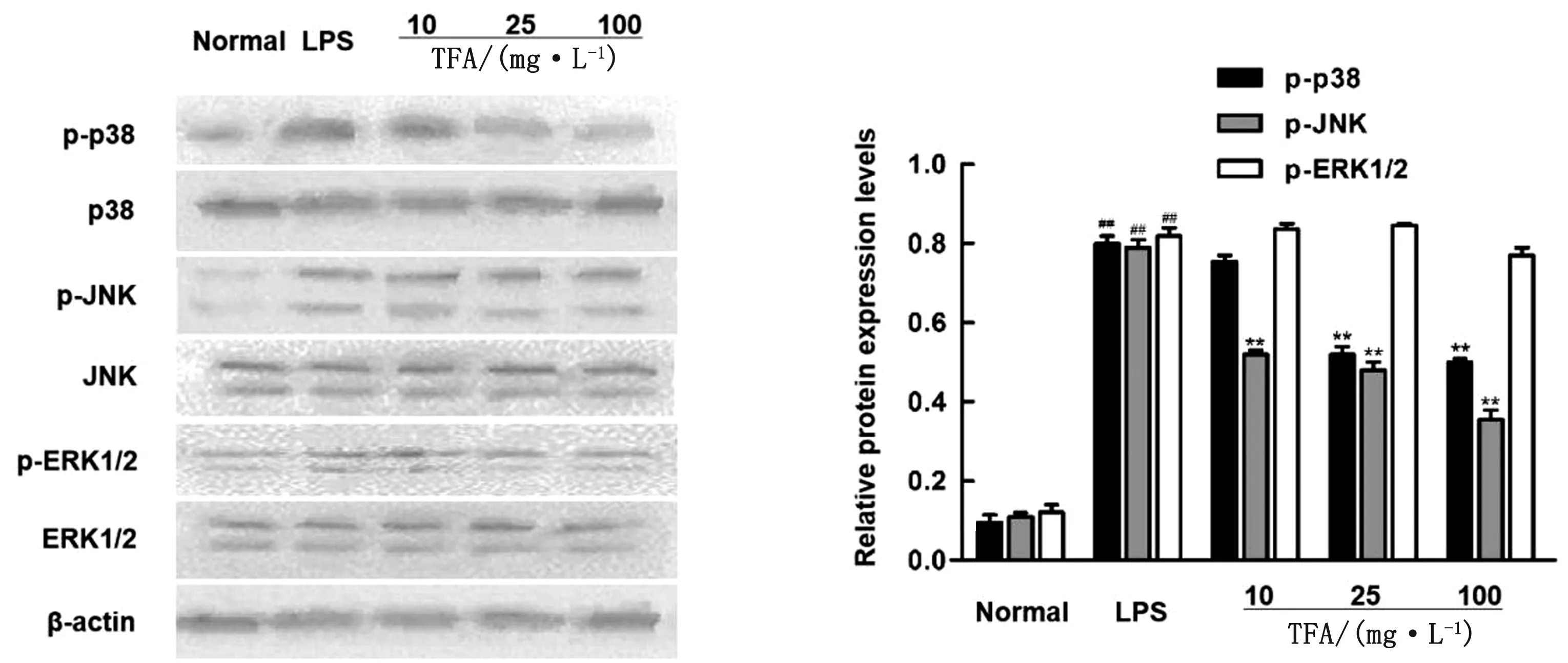
图6 TFA对LPS诱导的小鼠RAW264.7细胞p-p38、p-JNK和p-ERK1/2的调控
3 讨论
炎症反应会对动物机体造成极大的伤害,重则可使器官衰竭而引发死亡[8]。目前,常用抗炎药物仍以甾体类和非甾体类等西药为主,虽然疗效显著,但也显示出诸多弊端。近年来随着对中药抗炎作用的研究,越来越多的中药及有效成分以其毒副作用低、不良反应少等优势应用于兽医临床,成为继甾体类和非甾体类抗炎药之后的又一类应用广泛的抗炎药物[9]。本实验室已有研究表明,传统中药黄芪的主要活性成分TFA显示出明显的体内抗炎效果[10-11],但其抗炎机制不清楚。因此,本研究以LPS诱导RAW264.7细胞为模型,以TFA为研究对象,来探讨TFA的体外抗炎作用及机制。
炎症作为一种先天性免疫反应,主要由巨噬细胞诱导,进而分泌多种炎性介质和炎性因子增强机体的免疫应答,是机体免疫调控系统中一个重要环节,但炎性介质和炎性因子的过度分泌将会刺激进一步的细胞损伤,加重炎症反应[14]。而且,炎性因子与炎性介质之间会产生产生级联反应,如IL-1β和TNF-α最容易刺激细胞分泌PGE2,IFN-γ还会诱导NO的产生[15]。此外,iNOS和COX-2的表达调节也是许多炎症发病过程中的关键因素,并在相关疾病的发病机制中发挥着重要作用。iNOS表达增加,过量释放有毒介质NO,引起组织和细胞损伤,从而加重炎症反应[12]。PGE2是COX-2刺激的首要产物,也是一种重要的炎性介质,PGE2的增加同样会加重炎症的发展[13]。根据ELISA结果得出,TFA可抑制炎性因子IL-1β、IL-6、TNF-α、IFN-γ的过度分泌,说明TFA具有一定的抗炎效果。RT-PCR与Western blot试验结果发现,TFA可以抑制RAW264.7细胞iNOS、COX-2 mRNA和蛋白的过度表达,降低细胞上清液中NO与PGE2的含量。因此,通过抑制iNOS、COX-2的表达来抑制炎性介质NO和PGE2的产生可能是治疗炎症的一个有效途径。
丝裂原活化蛋白激酶(MAPKs)是与细胞生长关系最密切的一类蛋白激酶,可被多种刺激如细胞因子、神经递质、激素、细胞应激等活化。MAPKs信号通路是生物体内重要的信号转导系统之一,是连接细胞内外反应的重要环节,可介导胞外信号刺激传入胞内,调节细胞的生长、分化、炎症反应等多种重要的细胞过程[16]。在哺乳动物中,参与炎症反应的MAPKs家族成员主要分为p38、ERK1/2、JNK[17]。LPS刺激巨噬细胞后激活不同的MAPKs信号通路,进而调节炎性因子和炎性介质的基因转录与蛋白质合成等多种生理及病理过程,同时,MAPKs信号通路的异常或过度活化也是细胞炎症加重的重要因素[18]。本试验通过Western blot法得出,TFA对LPS诱导的RAW264.7细胞MAPKs信号通路中的p-p38和p-JNK蛋白表达具有抑制作用,但TFA各剂量组对p-ERK1/2蛋白表达抑制效果不明显;说明TFA能够抑制RAW264.7细胞MAPKs通路中p38和JNK的过度磷酸化。
综上所述,TFA能明显降低LPS诱导的RAW264.7细胞中炎性介质NO、PGE2及炎性因子IL-1β、IL-6、TNF-α、IFN-γ的含量,同时,TFA也显著抑制了iNOS和COX-2的mRNA和蛋白的过度表达,证明TFA具有明显的体外抗炎效果。进一步,TFA可调控p38和JNK的磷酸化水平,说明TFA的抗炎作用可能与抑制MAPKs信号通路活化有关,进而下调炎症介质和细胞因子的过量分泌。此外,TFA体外抗炎机制也要针对其他炎症相关通路以及采用不同特异性抑制剂来深入探究,从而为研发安全高效的抗炎药物提供理论依据,为兽医临床的炎症治疗提供新导向。
