羊源肺炎克雷伯菌间接免疫荧光检测方法的建立
2020-02-22陈瑞昶牛祥云苗永强胡莉萍朱瑞良
陈瑞昶,牛祥云,黄 金,苗永强,胡莉萍,朱瑞良*
(1.山东农业大学 动物科技学院 山东省动物生物技术与疫病防治重点实验室,山东 泰安 271018;2.山东省动物疫病预防与控制中心,山东 济南 250022)
肺炎克雷伯菌是一种条件性致病菌,可以导致人和动物脑膜炎、肺炎、泌尿系统发炎、伤口感染甚至败血症等[1],且具有较高的致死率[2],但在养羊业中仍未被重视。随着近年来养羊业的快速发展,各种抗生素的广泛使用、甚至滥用,高密度养殖和快速育肥的饲养模式,使该菌对养羊业的危害也越来越大[3]。
由于肺炎克雷伯菌在羊源方面的研究滞后,尚未见有可以进行临床检测的方法[4],而间接免疫荧光检测法具有操作简易、灵敏性高、特异性强的优势。结合本实验室研究及近些年的资料报道,采用全菌体免疫家兔制备兔抗羊源肺炎克雷伯菌多克隆抗体,以此为基础建立了间接免疫荧光标记抗体检测方法[5],并且通过临床试验证明检测方法稳定可靠,具有特异性,能够应用于羊源肺炎克雷伯菌的流行病学调查和临床诊断,同时为羊源肺炎克雷伯菌的快速诊断方法的应用奠定了基础[6]。
1 材料与方法
1.1 实验菌株及血清肺炎克雷伯菌由山东农业大学动物科技学院预防兽医学实验室自羊肺中分离、鉴定并保存;大肠杆菌菌株,沙门菌菌株和羊源肺炎克雷伯菌阳性血清由本实验室保存。
1.2 实验材料HRP-羊抗兔IgG购自Abcam公司;TMB底物显色试剂盒购自康为世纪公司;96孔ELISA酶标板购自Costar公司;FITC标记山羊抗兔IgG(H+L)购自碧云天公司;比浊管购自康泰生物科技公司;其他化学试剂为分析纯;4只健康非免疫家兔,体质量2~3 kg/只,购自山东泰安泰山种兔场;昆明小鼠购自斯贝福(北京)生物技术有限公司。
1.3 实验仪器标准型单人超净工作台购自SANYO公司;DNP-9082恒温培养箱购自上海慧泰仪器制造有限公司;压力蒸汽灭菌器购自上海博讯实业有限公司;BECKMANXL280超速冷冻离心机;Genes酶标仪购自美国Bio-Rad公司;DESATRONIC3000/200,Nichipet EX 系列移液器购自Thermo公司;HH-4数显恒温水浴锅购自常州国华电器有限公司;QT-2旋涡混合器购自上海隆拓仪器设备有限公司;OLYMPUS荧光显微镜。
1.4 抗原的制备将肺炎克雷伯菌100 μL,接种于500 mL LB肉汤培养基中,37℃振荡培养24 h后,加入终浓度0.2%甲醛进行灭活24 h,8 000 r/min,10 min离心收集沉淀,再用0.1 mol/L,pH7.4的PBS洗涤并制成悬液,通过麦氏比浊法测定浓度后,4℃保存备用[7]。
1.5 多克隆抗体的制备[8]将制备的抗原加白油佐剂制成免疫用抗原,选取非免疫家兔4只,进行抗原免疫,采用多点注射的方法进行4次免疫,每次间隔7 d,免疫剂量为每次2 mL/只,含菌量为2.3×109CFU/mL,在最后一次免疫后7 d进行心脏采血,分离血清,-20℃保存备用。运用间接ELISA法棋盘滴定检测多抗效价。
1.6 间接ELISA法检测多克隆抗体效价间接ELISA法棋盘滴定检测多抗效价:用碳酸盐缓冲液包被含菌量为1.0×106CFU/mL 的菌液加入酶标板,100 μL/孔,4℃过夜;PBS 作为阴性对照组,加入2% BSA 200 μL/孔,37℃孵育3 h;加入用1% BSA磷酸盐缓冲液从稀释度1∶100 开始倍比稀释的多抗100 μL/孔,37℃ 孵育1 h;加入HRP-羊抗兔IgG 100 μL/孔,37℃孵育1 h;加入底物TMB显色液100 μL/孔,避光显色40 min后,加入2 mol/mL H2SO450 μL终止反应,迅速在酶标仪测定450 nm波长下的D450值,并计算P/N值。
1.7 实验动物接种将50只雄性昆明小鼠随机分为A、B 2组,每组25只。A组将培养12 h的肺炎克雷伯菌菌液腹腔注射小鼠,0.2 mL/只,含菌量为2.1×1010CFU/mL;B组作为阴性对照组,腹腔注射等量PBS溶液。36 h内死亡小鼠取肺脏,-20℃保存。36 h后A、B组存活小鼠全部处死后取肺脏,-20℃ 保存备用。
1.8 间接免疫荧光操作程序[9]将待检组织无菌新鲜切面在载玻片轻压,获得样本,样本自然干燥。用10%甲醛固定样本15 min,将样本完全浸入PBS洗涤3次,每次5 min。将固定好的玻片标本置于湿盒中,加入一抗,即稀释的抗羊肺炎克雷伯菌多克隆抗体于样本上,于37℃孵育30 min。PBS洗涤3次,每次5 min,加入二抗,即稀释的FITC标记山羊抗兔IgG(H+L),避光,37℃孵育30 min。PBS洗涤3次,每次5 min,加1滴缓冲甘油,以盖玻片覆盖封片后,荧光显微镜下观察,拍照,记录荧光强度。
1.9 间接免疫荧光组化法最佳工作条件的优化一抗及二抗最佳稀释度的选择:同一病料做多张样本压片,运用棋盘滴定法筛选最佳稀释度,一抗为1∶20,1∶40,1∶80,1∶160共4个稀释浓度;二抗为1∶200,1∶400,1∶800,1∶1 600共4 个稀释浓度。将筛选出最佳稀释度的一抗和二抗作为最佳工作条件,进行一抗和二抗孵育时间的筛选。一抗孵育时间的筛选:固定好的玻片加入一抗后37℃分别孵育20,30,40 min后加入荧光二抗观察荧光结果,筛选一抗的最佳孵育时间。二抗孵育时间的筛选:加入一抗后,加入荧光二抗,37℃分别孵育20,30,40 min后观察荧光结果,筛选荧光二抗的最佳孵育时间。
1.10 间接免疫荧光特异性的测定通过上述方法分别将培养的大肠杆菌、沙门菌、枯草芽孢杆菌和巴氏杆菌菌液涂片,并设置阳性对照和阴性对照,选用筛选出的最佳工作条件进行间接免疫荧光的特异性测定。
1.11 间接免疫荧光重复性的测定取30份感染肺炎克雷伯菌死亡小鼠的肺脏,各制备玻片3张,保证条件相同下进行间接免疫荧光的测定,观察荧光显微镜下荧光强度的差异。
1.12 间接免疫荧光的临床应用对采集自山东各地区羊场的病料124份进行IFA检测,同时对病料组织进行细菌分离培养观察细菌形态。并运用16S rRNA测序鉴定分离菌株,对比2种方法的检验结果。
2 结果
2.1 制备抗原肺炎克雷伯菌细菌灭活后离心获得沉淀,通过麦氏比浊法测定含菌量为2.3×1010CFU/mL,4℃保存备用。
2.2 多克隆抗体效价将1,2,3,4号免疫家兔制备出的高免血清进行多抗效价的测定,当多抗的稀释倍数为1∶12 800时P/N=2.582>2.1,稀释倍数为 1∶25 600时 P/N=1.504<2.1,因此,通过间接ELISA法棋盘滴定测得多抗抗体效价为1∶12 800(图1)。

图1 羊源肺炎克雷伯菌多克隆抗体效价结果
2.3 一抗工作稀释度的筛选当一抗工作稀释度为1∶20,1∶40和1∶80时,特异性荧光均很强;一抗工作稀释度为1∶160时,特异性荧光较弱。为保证试验结果的准确性又可以节约抗体的使用量,确定一抗的最佳工作浓度为1∶80(图2)。
2.4 二抗工作稀释度的筛选当二抗工作稀释度为1∶200和1∶400时,特异性荧光均很强;一抗工作稀释度为1∶800和1∶1 600时,特异性荧光较弱。为保证试验结果的准确性,确定二抗的最佳工作稀释度为1∶400(图3)。

图2 不同稀释度的多克隆抗体对荧光效果的影响 A~D.多抗稀释度1∶20,1∶40,1∶80,1∶160;E.阴性对照;F.空白对照

图3 不同稀释度的荧光抗体对荧光效果的影响 A~D.荧光抗体稀释度1∶200,1∶400,1∶800,1∶1 600;E.阴性对照;F.空白对照
2.5 一抗孵育时间的筛选当一抗孵育20 min时,荧光较弱;孵育30 min时,荧光增强,黄绿色荧光清晰;孵育40 min时,荧光继续增强。因此对比后确定一抗最佳孵育时间为30 min(图4)。
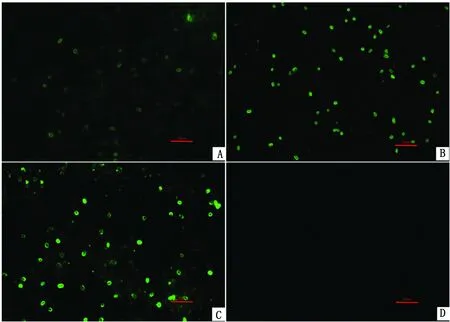
图4 不同孵育时间的多克隆抗体对荧光效果的影响 A~C.孵育时间分别为20,30,40 min;D.阴性对照
2.6 二抗孵育时间的筛选当荧光二抗孵育时间为20 min时荧光强度较弱,孵育时间为30,40 min时荧光强度差异不明显,因此对比后确定荧光二抗最佳孵育时间为30 min(图5)。
2.7 间接免疫荧光的特异性和重复性结果大肠杆菌、沙门菌、枯草芽孢杆菌和巴氏杆菌与兔抗羊源肺炎克雷伯菌多克隆抗体进行间接免疫荧光试验,未发现有特异性的荧光,抗原自发荧光对照和荧光抗体对照均为阴性,而肺炎克雷伯菌与多抗结合出现特异性荧光,结果为阳性,证明检测方法的特异性较高(图6)。同时对30份感染肺炎克雷伯菌死亡小鼠的肺脏进行的重复性试验结果表明均为阳性,特异性荧光强度差异不明显,表明重复性良好。
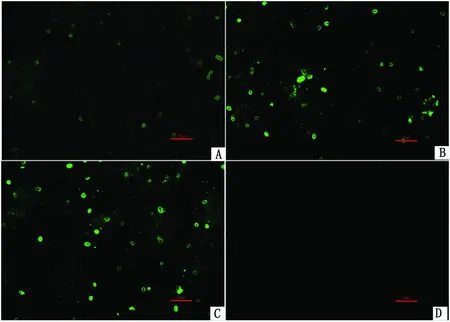
图5 不同孵育时间的荧光抗体对荧光效果的影响 A~C.孵育时间分别为20,30,40 min;D.阴性对照

图6 不同抗原和多抗作用的特异性荧光比较 A.大肠杆菌;B.沙门菌;C.枯草芽孢杆菌;D.巴氏杆菌;E.肺炎克雷伯菌;D.阴性对照
2.8 间接免疫荧光的临床应用通过兔抗羊肺炎克雷伯菌多克隆抗体对124份临床病料进行间接免疫荧光检测,同细菌分离鉴定结果进行比对,结果表明符合率为98.4%(表1)。
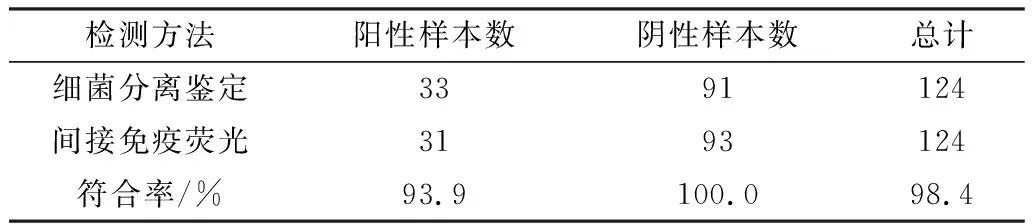
表1 间接免疫荧光法与细菌分离鉴定法 对临床样品检测结果的比对
3 讨论
在我国的畜牧生产中,养羊业逐渐向集约化、规模化的方向发展,严格控制养羊场各种疫病的发生对养羊业的健康发展至关重要[4]。克雷伯菌作为一种条件性的人兽共患病病原,当符合发病条件时,会对人和动物造成严重的影响,而肺炎克雷伯菌主要引起羊的肺部炎症、脑部出血,最终导致病羊死亡。因此,对于羊源肺炎克雷伯菌需要建立有效的预防措施,为养羊业发展起到有效的保护作用。
肺炎克雷伯菌在国内仅有少数检测方法,针对羊源肺炎克雷伯菌的检测并没有相应研究。间接免疫荧光是利用特异性抗体先和样品中相应抗原进行结合,再加入用荧光素标记的抗抗体同抗原-抗体复合物中的一抗进行结合,经过处理后,未知抗原或抗体在荧光显微镜下出现特异性荧光的检测方法[10]。与16S rRNA检测方法及李富祥等[11]建立的荧光定量PCR检测方法相比,这种方法在检测过程中不需要复杂的仪器设备,实验过程简易,结果的判定明显,是建立快速诊断方法的首选[12]。
本试验是将羊肺分离并鉴定后的肺炎克雷伯菌的菌体,灭活制成免疫抗原,经4次免疫健康家兔,制备兔抗羊肺炎克雷伯菌多克隆抗体[13]。通过间接ELISA法,进行棋盘滴定测定制备的多克隆抗体的效价为1∶12 800[14]。
利用兔抗羊源肺炎克雷伯菌多克隆抗体建立的间接免疫荧光检测方法,多克隆抗体的稀释度为1∶80;FITC标记抗体的稀释度为1∶400,一抗孵育时间为30 min,荧光二抗孵育时间为30 min,在筛选后的工作条件下,阳性样本出现了大量的黄绿色特异性荧光,没有非特异性荧光产生。在异源抗原的检测中,兔抗羊源肺炎克雷伯菌多克隆抗体同大肠杆菌、沙门菌、枯草芽孢杆菌和巴氏杆菌菌体进行间接免疫荧光方法检测后结果为阴性,同肺炎克雷伯菌进行间接免疫荧光方法检测后结果为阳性,证明建立的间接免疫荧光具有较强的特异性。为进一步验证建立的检测方法在临床中的实际效果,本试验对124份山东省内不同羊场的羊病料进行了间接免疫荧光检测和细菌的分离鉴定对比[15],2种方法的符合率为98.4%。在临床的检测中间接免疫荧光的测定准确性强,灵敏度高,操作简易,耗时少,在羊源肺炎克雷伯菌抗原的快速诊断中具有良好的应用前景[16]。
本试验成功建立了羊源肺炎克雷伯菌的间接免疫荧光检测方法,经过临床试验后证明该检测方法的特异性强,灵敏度高,可以满足生产中的检测要求,为羊肺炎克雷伯菌流行病学调查、临床诊断和快速诊断试剂盒的研制奠定基础。
