雷帕霉素眼用缓释膜的制备及体外释放分析
2020-02-22颜志超游秀华邓彩彬
颜志超,游秀华,邓彩彬
(1.广州医科大学附属第二医院眼科,广东广州 510260;2.中山大学药学院,广东广州 510006;3.中山大学中山眼科中心眼科学国家重点实验室,广东广州 510060)
青光眼是世界上第一位不可逆致盲眼病[1],虽然青光眼的治疗手段有很多,但降低眼内压是目前最明确的治疗手段[1-3]。多数患者早期可以通过药物控制眼压,但到了后期仍然需要接受手术降眼压治疗[1,4]。滤过性手术是目前治疗青光眼最常用的手术方式[4-5],然而滤过泡瘢痕化则是导致手术失败的主要原因[6],因此抗滤过泡瘢痕化已成为当前的研究热点。尽管目前应用于滤过区抗瘢痕形成的药物很多,例如丝裂霉素C(mito⁃mycin C,MMC)[6-7]和5-氟尿嘧啶(5-FU)[6,8],但是,这些药物的应用可能导致术后持续性低眼压、角膜上皮损伤、眼内炎、滤过泡渗漏、白内障[2,9-14]等诸多并发症的发生,且远期效果不理想。因此,寻找一种安全、有效、低毒、作用持久的药物一直是青光眼研究领域的重要课题之一。雷帕霉素(rapamycin,RAPA)又称西罗莫司(sirolimus),是从吸水性链霉素发酵液中提取的三烯大环内酯类抗排斥药物,是目前最新的强效免疫抑制剂之一[15-16],具有低毒、高效的特性[17],临床上已用于自身免疫性疾病和器官移植后抗排斥反应的治疗[16-18]。有研究[19]表明,RAPA对人Tenon′s囊成纤维细胞的有较强的抑制作用,因此它极有可能成为理想的抗瘢痕增殖的新药。根据青光眼滤过术后伤口的愈合过程可知,术后2周内为成纤维细胞增生最活跃的时期[19],由此我们设计以具有良好生物相容性的PLGA作为载体,制备RAPA药物缓释膜,拟在术中置入手术区域的Tenon′s囊下,使RAPA能够持续稳定地释放,在局部达到一定的有效浓度,从而控制术后成纤维细胞的增殖达15 d之久。因此,本研究通过研制RAPA眼用缓释膜,并对该缓释膜的药物含量进行测定及体外释放进行验证研究。
1 材料与方法
1.1 RAPA眼用缓释膜的制备
用精密分析天平(925M-202A-DRSCS PRE⁃CISA)称取聚乙二醇-4000(PEG-4000,化学纯,广东汕头市西陇化工厂)36 mg于5 mL离心管中,加入1.5 mL二氯甲烷,用涡旋混合器(Scientific industries Vortexgenie2)涡旋溶解。
称取PLGA 50:50 poly(DL-Lactide-co-Gly⁃colide,特性粘度0.55~0.75 dL/g,Durect Corpora⁃tion Birmingham)42 mg,PLGA 50:50 poly(DLLactide-co-Glycolide,特性粘度0.17 dL/g,Durect Corporation Birmingham)15.6 mg,RAPA 14 mg于2 mL离心管中,加入1.1.1中溶液600 μL,涡旋溶解10 min,静置5 min,将制得的溶液均匀滴加到载玻片中,置于通风橱中3 d,待溶剂挥干,脱膜。将制得的膜片裁剪成2.5 mm×2.5 mm小片(图1),即得。
1.2 缓释膜中RAPA含量测定方法学的建立
1.2.1 色谱条件 使用高效液相色谱仪(Agilent 1200美国)和色谱柱GraceSMart RP18(250 mm×4.6 mm,5 μm),流动相设置为:甲醇∶水为80∶20,检测波长为278 nm,流速为1 mL/min,进样量为10 μL,柱温为45 ℃。
1.2.2 RAPA标准曲线制备 用精密称取RAPA固体粉末(090901LP,纯度99.5%,杭州中美华东制药有限公司)10.2 mg于10 mL容量瓶中,用适量无水乙醇溶解,并定容至刻度,即得浓度为1.02 mg/mL RAPA无水乙醇溶液。
取1.02 mg/mL RAPA标准液2 mL,于25 mL棕色容量瓶中,用体积分数0.3%十二烷基硫酸钠(SDS,分析纯,天津福晨化学试剂厂)溶液定容至刻度,即得浓度为81.6 μg/mL RAPA储备液。
分别取RAPA标准储备液5、2.5、1.25 mL,和625、250、125、50 μL于10 mL容量瓶中,加体积分数0.3% SDS溶液定容至刻度,即得浓度为40.8、20.4、10.20、5.1、2.04、1.02和0.408 μg/mL RAPA标准液。注意避光操作。取上述标准液10 μL注入色谱仪,记录色谱图,以峰面积对RAPA浓度进行线性回归。
1.2.3 专属性考察 取PLGA空白膜,加入0.5 mL乙腈溶解,取0.25 mL于10 mL容量瓶中,加体积分数0.3% SDS溶液定容至刻度,过滤,按1.2.1项色谱条件进样分析,考察辅料对RAPA含量测定是否存在干扰。
1.2.4 回收率及精密度测定 取PLGA空白膜9片,于2 mL离心管中,分高、中、低3组,每组平行3份。高、中、低组分别加入RAPA 61.2、122.4和183.6 μg,加入乙腈至0.5 mL涡旋溶解,取0.25 mL于10 mL容量瓶中,加体积分数0.3% SDS溶液定容至刻度,过滤,按1.2.1项色谱条件进样分析,记录色谱峰面积,同时取浓度与样品浓度接近的RAPA标准液10 μL注入色谱仪,按外标法计算回收率。
1.2.5 缓释膜中RAPA含量测定 取RAPA缓释眼膜6片于2 mL离心管中,加入0.5 mL乙腈涡旋溶解,取0.25 mL于10 mL容量瓶中,加0.3% SDS溶液定容至刻度,过滤,取样品10 μL注入色谱仪进样分析,记录色谱图及峰面积,同时取浓度与样品浓度接近的RAPA标准液10 μL注入色谱仪,按外标法计算膜片中RAPA含量。
1.2.6 RAPA稳定性测定 分别于0、1、5、10和15 d进样测定,考察RAPA在0.3% SDS溶液中的稳定性。
1.3 RAPA眼用缓释膜体外释放考察
1.3.1 RAPA在不同溶剂中的溶解度考察 取过量的RAPA固体粉末,分别加入2 mL体积分数0.1%、0.5%失水山梨醇单油酸酯聚氧乙烯醚(Tween-80,化学纯,天津市百世化工有限公司)及体积分数20%乙醇、30%乙醇、0.3%SDS涡旋溶解5 min,再放入37 ℃水浴恒温振荡器(SHA-B江苏省金坛市宏华仪器厂)中,以100 r/min(r=25 mm)振摇48 h,离心取上清液,稀释,按1.2.1项下色谱条件进样分析。
1.3.2 RAPA眼用缓释膜体外释放 取RAPA眼膜1片 于20 mL西林瓶中,加 入0.3% SDS溶液10 mL,封口,置于37 ℃的水浴恒温振荡器中,转速100 r/min(r=25 mm),分别于第0、1、2、3、5、8、11和15 d取出样品0.5 mL,再加入新鲜介质0.5 mL。样品液过滤,按1.2.1项下色谱条件进样分析,平行测定3份。
1.4 数据处理
采用SPSS 18.0软件进行统计学分析。数值变量符合正态分布以()描述,不符合正态分布以中位数和四分位数间距描述,分类变量以例数(n)及其百分比(%)描述。RAPA浓度与峰面积的关系采用简单线性回归,R2>0.99提示呈良好的线性关系。RAPA在不同溶剂中的溶解度考察以及RAPA眼用缓释膜体外释放结果比较,不同组别之间数值变量比较采用单因素方差分析(one-way ANOVA),有统计学差异的两两比较使用LSD-t检验。
2 结果
2.1 RAPA缓释膜的特性及RAPA含量测定
2.1.1 RAPA标准曲线 经线性回归得出RAPA标准曲线。可知RAPA浓度在0.408~40.8 μg/mL范围内,与峰面积呈良好的线性关系(图2)。
2.1.2 专属性考察 药膜中辅料及0.3% SDS溶液对RAPA含量测定没有干扰,含量测定专属性好(图3)。
2.1.3 回收率及精密度测定 高浓度药物含量组的回收率为100.34%~105.43%,平均回收率为103.35%,精密度为2.58%;中浓度药物含量组的回收率为98.08%~103.32%,平均回收率为101.47%,精密度为2.90%;低浓度药物含量组的回收率为101.69%~106.01%,平均回收率为103.67%,精密度为2.41%(表1)。
2.1.4 缓释膜中RAPA含量测定结果 缓释膜中RAPA的含量在98.68~125.34 μg之间,平均含量为(112.6±10.1)μg/片,RSD为8.99%(表2)。
图3 专属性考察Fig.3 Specificity test of RAPA

表1 回收率及精密度测定Table 1 Test of recovery and relative standard deviation(RSD)
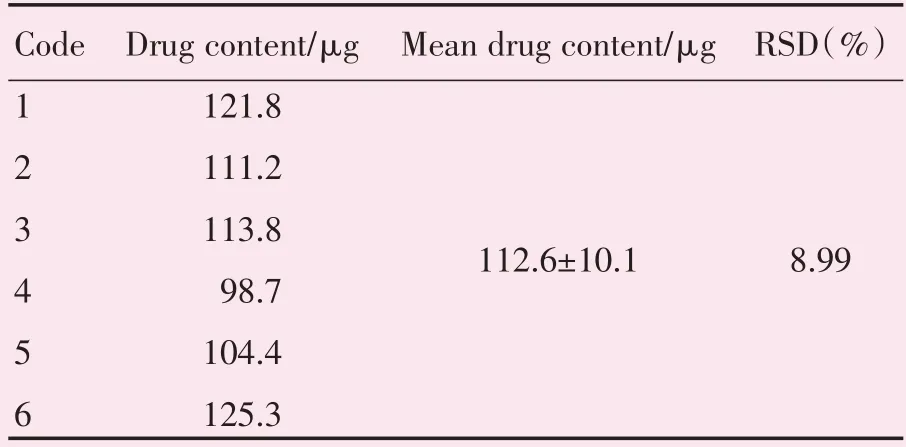
表2 缓释膜中RAPA含量测定Table 2 Determination of drug content of the sustained release film
2.1.5 RAPA稳定性测定 通过RAPA稳定性测定表明,以0.3% SDS溶液为释放介质的RAPA在0~15 d的峰面积为101.5~112.3,平均约107.4,提示以0.3%SDS溶液为释放介质的RAPA在15 d内稳定性好(表3)。

表3 RAPA稳定性测定Table 3 Stability test of RAPA
2.2 RAPA眼用缓释膜体外释放分析结果
2.2.1 RAPA在不同溶剂中的溶解度考察 RAPA在20%乙醇、30%乙醇、0.1% Tween-80、0.5%Tween-80和0.3% SDS中的溶解度分别为:(15.0±6.1)、(100.0±8.4)、(6.5±4.6)、(14.8±6.2)、(548.0±25.4)μg/mL(图4)。统计学两两比较分析提示,RAPA在20%乙醇、0.1% Tween-80、0.5% Tween-80中的溶解度均无统计学差异(P>0.05),在30%乙醇、0.3%SDS中的溶解度与上述3组均有统计学差异(P<0.05),在30%乙醇与0.3%SDS中的溶解度有统计学差异(P<0.05)。
RAPA在20%乙 醇、0.1% Tween-80、0.5%Tween-80中溶解度均较低,在30%乙醇中溶解度一般,均难达到漏槽条件,而在0.3% SDS溶液中的溶解度最大(图4),满足漏槽条件。
2.2.2 RAPA眼用缓释膜体外释放结果分析 通过RAPA眼用缓释膜体外释放研究发现,药物释放量随时间推移逐渐增加。第1、2、3、5、8、11和第15天的峰值浓度分别为(50.97±12.28)%、(58.30±16.45)%、(57.39±12.35)%、(93.66±5.36)%、(95.46±2.98)%、(90.74±3.08)%、(90.18±3.98)%。统计学两两比较分析提示,第1、2、3天之间的差异无统计学意义(P>0.05),第5、8、11、15天的差异无统计学意义(P>0.05),第3天与第5天的差异具有统计学意义(P<0.05,图5)。RAPA体外释放在第5天时基本达到峰值浓度,并持续维持至15 d。
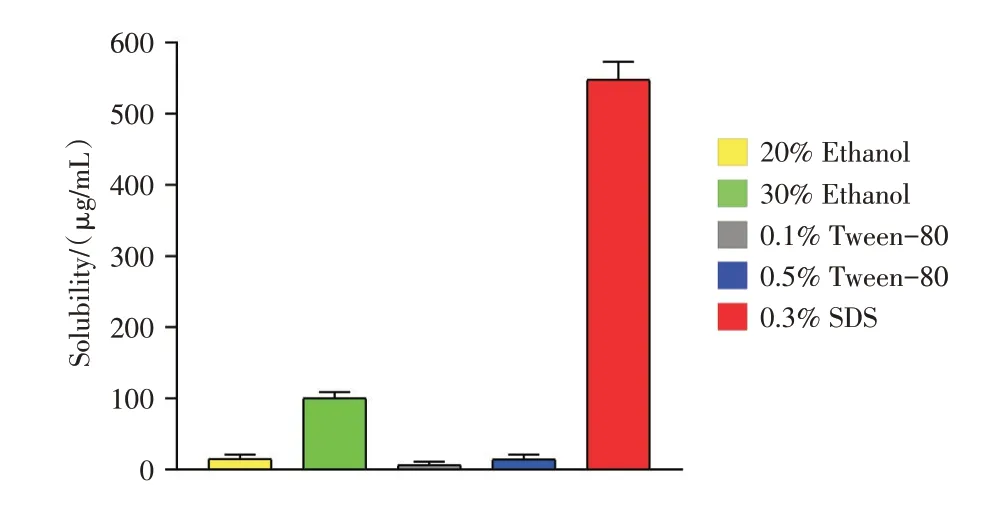
图4 RAPA在不同溶剂中的溶解度Fig.4 Solubility of RAPA in different solvents
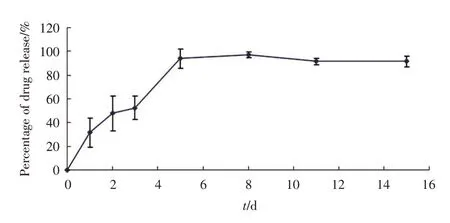
图5 RAPA眼用缓释膜体外释放曲线Fig.5 Release profile of RAPA sustained-release film
3 讨论
通过本实验发现,以PLGA为载体的RAPA眼用缓释膜,其15 d内RAPA含量及稳定性良好,同时体外释放研究发现,药物释放量随时间推移逐渐增加,在第5天左右达到峰值浓度,并持续维持至15 d左右,达到预期要求。
目前临床上RAPA用于自身免疫性疾病和器官移植后抗排斥反应的治疗以全身给药为主,但因全身给药而带来的口腔溃疡(10%~19%)、间质性肺疾病(4%~17%)、高脂血症(30%~64%)、贫血(12%~76%)、白细胞减少(11%)、蛋白尿(10%)、淋巴水肿(6.4%~12%)等副作用不可避免[20]。常规抗青光眼手术中抗代谢药的使用均以局部应用为主,例如MMC、5-FU在术中的应用[7-8],且常为术中单次应用,术后除了少数眼部并发症外,未见全身严重并发症报导[10,13-14]。因此本课题设计仍是以局部给药,本实验结果显示每片缓释膜的RAPA平均含量很低为(112.6±10.1)μg,给药剂量远比全身给药的量小[21],同时制成缓释制剂,通过在青光眼滤过术区局部释放15 d,达到局部抗瘢痕化的作用[19]。
既往很多研究表明PLGA具有良好的生物相容性,作为RAPA的常用载体已被多数人所采用[22-23],因此本研究同样选择PLGA作为RAPA的载体材料。由于不同粘度PLGA降解时间不同,对药物释放的速度和程度有不同影响。本实验发现,当DL-PLGA50/50的特性粘度为0.55~0.75 dL/g时,其降解时间为1~2月,而当DL-PLGA50/50的特性粘度为0.15~0.25 dL/g时,其降解时间为2~4周,但粘度偏小不易成膜,结合PLGA(特性粘度0.55~0.75 dL/g)使用容易成膜,且膜光滑无气泡。文献报道[24],RAPA在37 ℃,pH为7.4的磷酸缓冲介质中半衰期仅为13 h,又由于RAPA为难溶性药物,在水中溶解度仅为2.6 μg/mL,本实验结果显示RAPA在20%、30%乙醇,和0.1%、0.5%Tween-80中溶解度均较低,难达到漏槽条件,而在0.3% SDS溶液中的溶解度最大,满足漏槽条件,故实验选择对RAPA稳定,且能达到漏槽条件的0.3% SDS溶液作为RAPA眼膜体外释放介质。我们的动物实验结果也表明[19],RAPA眼用缓释膜在兔子抗青光眼手术后滤过泡的抗瘢痕化的作用明显,术后滤过泡形态可维持至28 d后,术后房水中RAPA的有效药物浓度维持时间达2周以上,且无出现术后并发症,而空白组和术中单用RAPA棉片浸泡组其滤过泡均在1周内消失,因此,该RAPA眼用缓释膜可明显提高抗青光眼手术成功率。
综上所述,一定行为学参数的RAPA眼用缓释膜具有良好的缓释性能,具有青光眼术后抗瘢痕化的应用潜力。
