LncRNA Xist通过调控SDF-1/CXCR4轴促进大鼠骨髓间充质干细胞增殖与迁移
2020-02-22段亚妮木拉提阿比来列提朱雁秋唐镭蕾朱俊颖
段亚妮,木拉提·阿比来列提,朱雁秋,唐镭蕾,朱俊颖,覃 杰
(1.中山大学附属第三医院放射科,广东广州 510630;2.喀什地区第一人民医院心内科,新疆喀什 844000)
急性心肌梗死(acute myocardial infarction,AMI)是临床上常见的危急重症之一,我国AMI的发病率逐年升高[1]。传统的药物、介入及外科手术治疗只能延缓心梗后心衰的发展[2]。近年来兴起的干细胞治疗心肌梗死表现出良好的应用前景,骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)由于其易得性,被大量应用于心肌梗死的研究之中[3-5]。BMSC有多种发挥作用的方式,包括旁分泌作用、免疫调节、分化为心肌和血管等,其中旁分泌作用及免疫调节均要求BM⁃SC迁移至缺血心肌附近。因此提高BMSC的迁移率是改善干细胞治疗心肌梗死疗效的重要途径。LncRNA是一种长度>200 nt的非编码RNA[6-7]。近年来发现,许多lncRNA在间充质干细胞的调控中发挥重要作用[8]。XIST是一种定位于X染色体失活中心(XCI)的非编码RNA,参与雌性X染色体的失活[9]。XIST在多数肿瘤中上调,并促进肿瘤的远处转移[10]。但其是否参与BMSC的迁移及其机制尚不清楚。趋化因子受体4(chemokine re⁃ceptor 4,CXCR4)是一种趋化因子受体,其配体是基质细胞衍生因子-1(stromal cell-derived factor,SDF-1),SDF-1/CXCR4是已知参与细胞迁移的最重要的信号通路[11]。因此,本研究通过siRNA干扰BMSC中lncRNA Xist的表达,从而探讨lncRNA Xist在BMSC增殖、迁移中的作用,同时研究其与SDF-1/CXCR4轴的关系,为提高间充质干细胞移植治疗心肌梗死时移植细胞迁移率提供方向。
1 材料与方法
1.1 材 料
1.1.1 实验细胞与动物 Sprague-Dawley(SD)大鼠,雌性SPF级,3周龄,动物质量合格编号为No.44002100021160,用于大鼠骨髓间充质干细胞的提取,购自中山大学实验动物中心,饲养条件遵照《实验动物环境及设施国家标准(GB14925-2001)》规定,对实验动物的处理根据中山大学动物实验中心的实验动物操作标准进行。
1.1.2 试剂 胰酶(Gibco,美国);胎牛血清(Gib⁃co,美国);L-DMEM培养基(Gibco,美国);Lipo⁃fectamine 2000(Invitrogen,美国);siRNA(锐博,中国);Trizol(Invitrogen,美国);反转录试剂盒(Taka⁃ra,日本);qPCR试剂盒(Takara,日本);β-tubulin抗体(Cell Signaling Technology,美国);CXCR4抗体(Abcam,美国);Transwell小室(Corning,美国);CD34-FITC抗体(BD,美国);CD90-PE抗体(BD,美国);CD105-Alexa Fluor 647(BD,美国);CD11b-FITC抗体(Biolegend,美国);CD45-FITC抗体(Bio⁃legend,美国);CD44-FITC抗体(Biolegend,美国)。
1.2 方 法
1.2.1 大鼠BMSC的分离与培养 取3周龄SD雌性大鼠,腹腔注射3%戊巴比妥钠麻醉后断颈处死,75%乙醇浸泡5 min,超净台中分离双侧胫腓骨,剪断两侧干骺端,用含10% FBS L-DMEM培养基冲洗至骨髓腔发白,收集BMSC,置于体积分数5% CO2培养箱中培养。48 h半量换液,72 h全量换液,待细胞长满后传代。
1.2.2 流式细胞术鉴定BMSC取P3细胞,消化计数,离心后用PBS重悬至2×107/mL,向流式检测管中各加入50 μL细胞悬液及50 μL PBS,按照各抗体使用说明加入适宜体积的抗体,并用PBS补齐至20 μL。冰上及摇床上孵育30 min后,离心弃上清,加入PBS重悬,重复3次,最后补齐至500 μL用于流式检测。
1.2.3 总RNA提取-逆转录-聚合酶链式反应用Trizol试剂提取总RNA并检测浓度及纯度,并根据Takara反转录试剂盒说明书反转录成cD⁃NA。qPCR所用引物均由上海生工生物公司合成,以GAPDH作为内参基因,相关引物序列如下:GAPDH上游5′-CAAGGTCATCCATGACAACTTTG-3′和下游5′-GTCCACCACCCTGTTGCTGTAG-3′;Xist上 游5′-CAAGGCTGCGGACTGTCATCATAG-3′和下游5′-CTGCTGAAGGTGGTGGTGTGAG-3′;SDF-1上游5′-CGAGAGTCACTCAGCTCAAGGTT⁃G-3′和下游5′-GCATTGGCAGGTCAGGCTACAG-3′;CXCR4上游5′-CAGCCTGTGGATGGTGGTGTT⁃C-3′和下游5′-CCTTGGAGTGTGACAGCTTGGA⁃G-3′;根据Takara qPCR试剂盒说明书配置qPCR反应体系,扩增反应条件设置为预变性95 ℃30 s;PCR反应:95 ℃3 s,60 ℃30 s,循环40次。
1.2.4 细胞瞬时转染 根据Lipofectamine 2000说明书,将适宜浓度si-Xist或si-NC转染到BMSC细胞中,4~6 h换液后继续培养。相关siRNA靶序列如下,si-Xist1:5′-GCACGATCAAGAAATGTAA-3′;si-Xist2:5′-GGAATGAGATAATGCTTAA-3′;si-Xist3:5′-GAATAGTAGAAATAGTTAA-3′;si-NC为与大鼠所有基因无同源性的随机序列,由锐博公司提供。
1.2.5 CCK-8检测细胞增殖能力 转染48 h后消化各组细胞,以5 000个/孔的密度接种至96孔板中,每组设6个复孔,置于体积分数5%CO2培养箱中培养,分别于12、24、48 h 3个时间点进行CCK-8检测。检测时每孔加入10 μL CCK-8试剂,37 ℃孵育40~50 min,酶标仪450 nm处检测吸光度值,去除大小值后进行统计分析。
1.2.6 划痕实验及Transwell迁移实验 划痕实验:在六孔板底部用马克笔划五条平行横线,转染后待细胞长到80%左右时,用200 μL枪头在每孔相同位置作纵向划痕,利用纵向划痕与横线标记的交点定位,在倒置显微镜下定点拍照。5% CO2培养箱中继续培养24 h,在与之前相同位置拍照。Image J软件测量划痕区域面积。计算伤口愈合百分比,伤口愈合百分比(%)=(1-24 h划痕面积/0 h划痕面积)×100%。Transwell迁移实验:使用无血清培养基调整细胞浓度为1×105/mL,上室加入300 μL细胞悬液,下室加入500 μL 20%FBS L-DMEM培养基,培养箱中培养6 h,PBS清洗两次,加入40 g/L多聚甲醛固定20 min,PBS清洗两遍,1%结晶紫染色液染色10 min,用PBS清洗至干净为止,拍照前用棉签抹去上层未迁移细胞,随机取10个视野(100×)在正置显微镜下拍照,计算各孔迁移细胞数。
1.2.7 免疫印迹检测 常规提取细胞总蛋白,检测膜蛋白时免去煮沸步骤。用适宜浓度SDSPAGE凝胶电泳分离,转膜至PVDF膜上,5% BSA封闭1 h,必要时丽春红染色查看蛋白条带,1×TBST洗膜后4 ℃孵育一抗过夜,1×TBST洗膜10 min 3次,室温孵育相应二抗1 h,1×TBST洗膜10 min 3次,加入ECL工作液,于凝胶成像仪中检测蛋白条带。
1.3 统计学方法
统计分析采用IBM SPSS Statistics 25软件,呈正态分布的定量数据表示为Mean±SD,两组间比较,数据呈正态分布且方差齐的数据采用t检验;呈正态分布但方差不齐的数据采用秩和检验。多组间比较数据呈正态分布且方差不齐,采用完全随机设计的单因素方差分析,组内两两比较采用Games-Howell检验。所有统计学分析均为双侧检验,α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 BMSC的鉴定
BMSC P3代细胞呈梭形、漩涡状生长;流式细胞术检测CD11b、CD34、CD45、CD44、CD90、CD105表达,BMSC阳性表达CD44、CD90、CD105,而阴性表达CD11b、CD34、CD45,符合BMSC表面标志物的特征,可用于后续实验(图1)。
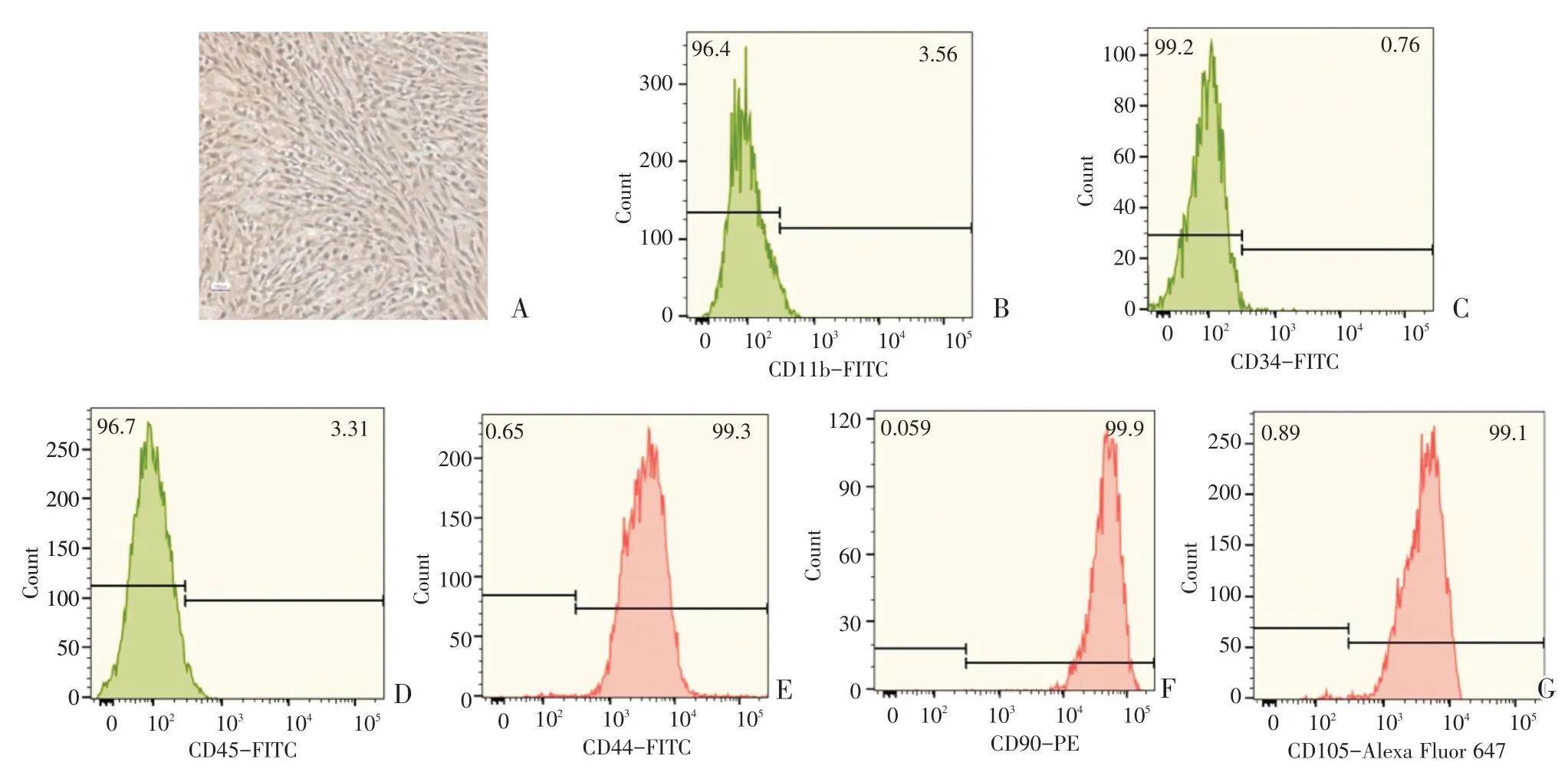
图1 流式细胞术鉴定BMSCFig.1 Identification of BMSC with flow cytometry
2.2 筛选lncRNA Xist沉默效率高的siRNA
设计3条siRNA,分别用siRNA-1、siRNA-2、siRNA-3及阴性对照si-NC转染BMSC,48 h后qRT-PCR检测lncRNA Xist的相对表达量。经方差分析4组间差异有统计学意义(F=2 748,P<0.001),进一步进行Games-Howell检验,除siR⁃NA-1组和siRNA-2组之间差异无统计学意义外,其他任何两组间在沉默lncRNA Xist效率上的差异均具有统计学意义(P<0.001)。即3条siRNA均对lncRNA Xist有沉默作用,沉默效率分别为67.92%、68.72%、98.32%,沉默效率最佳的siRNA-3被用于后续实验(图2)。
2.3 lncRNA Xist对BMSC增殖和迁移能力的影响
2.3.1 lncRNA Xist对BMSC增殖能力的影响 分别使用si-Xist和si-NC转染BMSC P3细 胞,转染后消化至96孔板中,分别于12 h、24 h、48 h行CCK-8实验,检测450 nm处吸光度值。12 h时si-Xist组与si-NC组OD值差异无统计学意义(Z=-1.732,P=0.083)。24 h时si-Xist组OD值为0.940±0.056,si-NC组OD值 为1.217±0.062,48 h时,si-Xist组OD值为1.145±0.063,si-NC组OD值为1.460±0.092。24 h及48 h时,si-Xist组吸光度值明显低于si-NC组(t24h=6.639,P<0.001;t48h=5.668,P=0.001;图3A)。
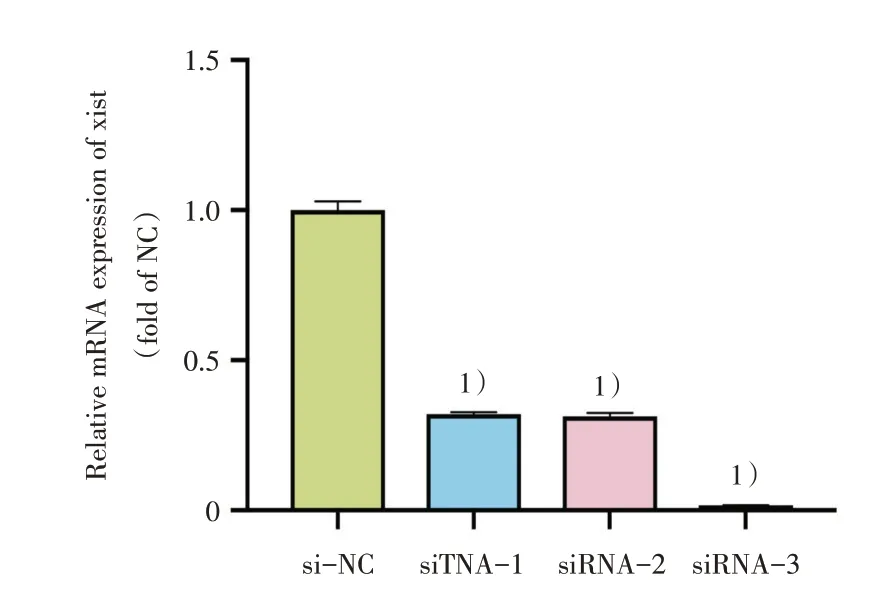
图2 三条siRNA对lncRNA Xist沉默效率的比较Fig.2 Comparison of silencing efficiency of three siRNAs in silencing lncRNA Xist
2.3.2 lncRNA Xist对BMSC迁移能力的影响 分别使用si-Xist和si-NC转染BMSC P3细胞,待细胞长满后行划痕实验,分别在0 h、24 h拍照,测量划痕区域面积,计算伤口愈合百分比。si-Xist组和si-NC组伤口愈合百分比分别为(16.3±6.3)%、(41.2±8.4)%,si-Xist组伤口愈合百分比明显低于si-NC组(t=4.105,P=0.015)(图3B、C)。转染后48 h行Transwell迁移实验,迁移6 h后拍照计数。si-Xist组和si-NC组迁移细胞数(个)分别为139±21、326±15,si-Xist组迁移细胞数明显低于si-NC组(t=12.56,P<0.001;图3D、E)。
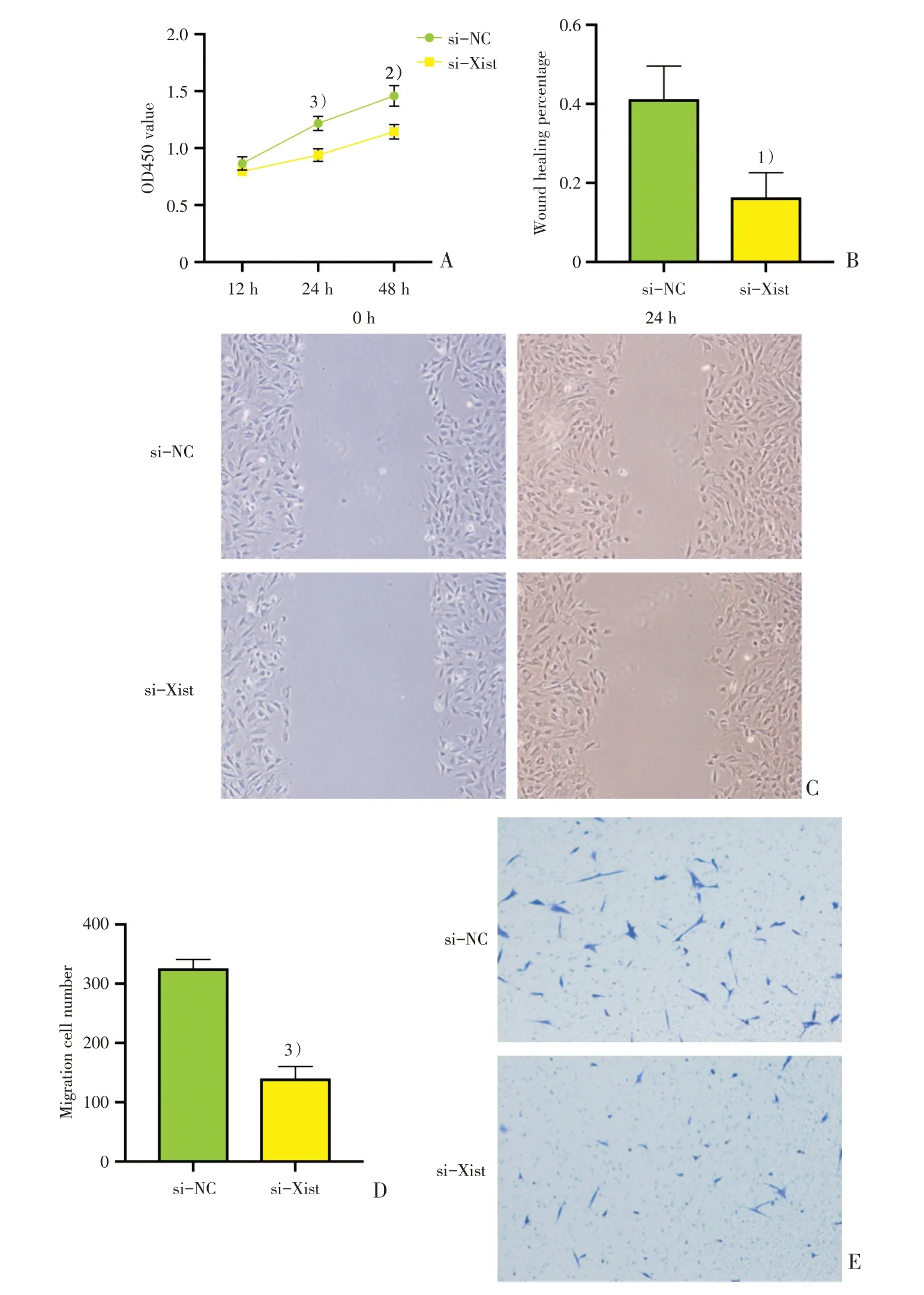
图3 lncRNA Xist对BMSC增殖和迁移能力的影响Fig.3 Effects of lncRNA Xist on BMSC proliferation and migration
2.4 lncRNA Xist调控SDF-1/CXCR4轴

图4 lncRNA Xist对BMSC SDF-1/CXCR4轴的影响Fig.4 Effect of lncRNA Xist on BMSC SDF-1/CXCR4 axis
分别使用si-Xist和si-NC转染BMSC P3细胞,转染后48 h,提取总RNA进行qRT-PCR,分别检测GAPDH、Xist、CXCR4、SDF-1 mRNA。在干扰lncRNA Xist表达后,si-Xist组lncRNA Xist相对表达量明显降低,相当于si-NC组的0.43±0.08倍(t=11.02,P<0.001);同时,干扰后si-Xist组CX⁃CR4 mRNA的相对表达量下降为si-NC组的0.59±0.12倍(t=4.60,P=0.010);两组间SDF-1 mRNA的相对表达量差异无统计学意义(t=-1.14,P=0.318;图4A)。转染后72 h,提取总蛋白进行western blot检测,si-Xist组和si-NC组灰度值分别为0.56±0.04、0.72±0.07,即si-Xist组CXCR4蛋白相对表达量低于si-NC组(t=3.32,P=0.029;图4B、C)。
3 讨论
在本研究中,我们发现在降低lncRNA Xist的表达后,BMSC的迁移能力下降,其机制可能是ln⁃cRNA Xist通过降低BMSC膜受体CXCR4的表达,从而抑制BMSC迁移。
间充质干细胞治疗心肌梗死有多种机制,包括免疫调节和抗炎作用、抗纤维化、分化为心肌和血管等,其发挥作用要求BMSC归巢至缺血心肌附近,因此提高BMSC的迁移能力是改善干细胞治疗心梗疗效的第一步[12]。许多研究者对此作了诸多探索,如低氧预适应、细胞因子预处理、基因修饰等[13]。LncRNA作为一种非编码RNA,由于其广泛的调节作用,有望成为干细胞修饰的新靶点,如LOC101928674等参与调节MSC的免疫功能[14],lncTCF7可在缺氧条件下维持MSCs的干性[15],LincRNA-p21在体外促进缺氧条件下MSCs的迁移和存活等[16]。LncRNA XIST是一种位于雌性失活X染色体上的长链非编码RNA,lncRNA XIST在肿瘤中的研究较多,如在非小细胞癌、乳腺癌、肝癌等多种肿瘤中均表达上调,促进肿瘤远处转移[10]。但lncRNA XIST在BMSC中的作用尚不清楚。我们在敲低BMSC中lncRNA Xist的表达后,发现BMSC的增殖能力和迁移能力均显著下降,提示lncRNA Xist参与了BMSC迁移的调节,与其在肿瘤中观察到的作用一致。
CXCR4是一种重要的趋化因子,可与配体SDF-1结合,共同参与趋化过程,是参与间充质干细胞迁移与归巢的主要信号通路[11]。我们的研究发现,在敲低lncRNA Xist后,BMSC中SDF-1的表达量无明显变化,而CXCR4在mRNA和蛋白水平的表达量均显著下降,提示lncRNA Xist可能直接或间接地作用于CXCR4,从而参与BMSC的迁移过程。另外,我们观察到,在干扰lncRNA Xist后,CXCR4表达在mRNA和蛋白水平虽然均有统计学差异,但在mRNA水平的变化较蛋白水平更为明显,提示可能还有其他机制参与CXCR4的表达调节,如转录后磷酸化修饰等,这有待于进一步研究证实。此外需要注意的是,在转染时,由于受细胞状态、细胞密度的影响,每次实验siRNA的沉默效率之间的差异较大,我们在每次转染后,qPCR检测同批同组细胞中的lncRNA Xist的表达量,以此保证实验结果的可靠性。
尽管我们初步证明了lncRNA Xist可通过CXCR4来调节BMSC的增殖和迁移能力,但研究仍存在许多不足之处。首先,本研究仅做了低表达实验,未进行过表达实验,因此不能完全确证lncRNA Xist的作用。其次,由于没有在体外模拟缺氧环境,因而不能反映体内复杂环境下BMSC的迁移过程。此外,本实验仅证明lncRNA Xist可以通过CXCR4发挥作用,但未对调控lncRNA Xist和直接调控CXCR4对BMSC的影响进行对比,这有待于进一步的研究。
