α-细辛醚对秦岭滑蜥断尾后芽基形成时期细胞增殖的影响
2020-02-21寇曌婷高燕燕邵晓忠
赵 禹 李 琳 寇曌婷 高燕燕 邵晓忠 杨 纯*
(1.山西师范大学现代文理学院,临汾,041004;2.山西师范大学生命科学学院,临汾,041004)
许多蜥蜴类爬行动物在受到攻击时尾部能够主动断离作为一种逃避手段,随后进行完整的形态再生和功能恢复,其中包括皮肤、肌肉、软骨和脊髓等组织或细胞的重构,是极具潜力的爬行动物的再生模型[1-2],可为我们深入理解物种再生能力的演化提供重要的线索[3]。细辛醚为天南星科(Araceae)植物金钱蒲(Acorusgramineus,异名石菖蒲Acorustatarinowii)挥发油中的主要成分之一,包括α-细辛醚、β-细辛醚和γ-细辛醚3个同分异构体[4],具有抑菌、镇静、降血脂、抗炎、神经保护等作用[5]。金钱蒲及其组分细辛醚能够通过调控ERK蛋白激酶的级联反应直接促进神经干细胞增殖和神经发生[6]。注射α-细辛醚是否会影响蜥蜴断尾再生过程,值得探讨。
中国特有的卵胎生蜥蜴秦岭滑蜥(Scincellatsinlingensis)的相关研究主要集中于部分器官、系统的组织形态学[7-9]。秦岭滑蜥具有断尾再生能力,其断尾再生过程包括4个时期,涉及伤口愈合、芽基形成、细胞分化和尾生长,并依据其再生持续时间可细分为7个阶段。在整个3—5阶段中细胞继续增殖,随着芽基细胞大小的增加,新血管的发育和室管膜管的生长与之匹配[10]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)首次发现于系统性红斑狼疮患者的血清中,在DNA合成和损伤修复、细胞周期调控中具有重要作用,可标记增殖细胞[11]。在豹纹守宫(Eublepharismacularius)断尾后的伤口表皮下聚集的高度增殖的间充质样细胞形成芽基,由其进一步分化出不同的替换性组织。断尾再生过程中 PCNA 和pSMAD2共定位表明大量芽基细胞增殖并对TGF β/activin作出积极相应[12]。本实验旨在研究α-细辛醚对秦岭滑蜥断尾后芽基形成过程中细胞增殖的影响。
1 材料与方法
1.1 实验动物
秦岭滑蜥采自山西省临汾市太岳山七里峪(36°21′—36°45′N,110°40′—112°21′E),于透明玻璃箱中饲养,通风良好并辅以光照。提供黄粉虫及自来水,确保其自由饮食,以维持机体健康。
1.2 取样与处理
随机选取大小相近且健康的秦岭滑蜥27只,48.08 mm≤SVL≤57.08 mm,2.13 g≤BW≤2.74 g,雌雄兼有,随机分为3组。空白组为同等饲喂条件的原尾组。对照组为挤压断尾组。实验组为挤压断尾并腹腔注射α-细辛醚组(10 mg/ kg,连续注射2 W)。实验蜥蜴分别于断尾后15 d、18 d和20 d取材,每批每组3只。将断尾后样品切成约0.5 cm放入4 %的多聚甲醛溶液中,以备制作切片。
1.3 冰冻切片准备
将所取材料放入4 %多聚甲醛中固定1—3 d后于脱钙液中脱钙3 d。随后依次在10 %、20 %、30 %蔗糖溶液中沉降后用OCT包埋剂包埋。徕卡CM-1850冰冻切片机25 μm连续切片,用于免疫组织化学染色。
1.4 免疫组织化学染色切片准备
多聚甲醛后固定30 min。PBS缓冲液洗3×5 min/次。3% 过氧化氢封闭,室温孵育20 min。PBS缓冲液洗3×5 min/次。用滤纸将切片周围的PBS缓冲液吸干。BSA封闭液封闭30 min滴加一抗,4℃冰箱孵育48 h。PBS缓冲液洗3×5 min/次。加二抗,37 ℃孵育4 h。PBS缓冲液洗3×5 min/次。加SABC试剂,室温孵育1 h。PBS缓冲液洗3×5 min/次。DAB显色,室温避光孵育至棕黄色。蒸馏水终止显色 10 min。水溶性封片剂封片,光学显微镜下观察显色结果并拍照。
1.5 数据测量及统计
取空白组、对照组、实验组中15 d、18 d、20 d材料应用ImageJ软件,分别测得在脊髓、皮肤和肌肉中PCNA阳性细胞的平均灰度值,所有数据用平均值±标准误表示,用SPSS 23.0进行单因素方差分析(one way ANOVA),检测组间差异性,以P<0.05表示有显著性差异[13]。
2 实验结果
2.1 PCNA阳性细胞的分布特点
秦岭滑蜥空白组原尾和再生时间为15 d(图1 A、B、C)、18 d(图2 A、B、C)和20 d(图3 A、B、C)的再生尾外形极其相似,横切面呈圆形或卵圆形,但显微结构差异明显。空白组、对照组和实验组的皮肤、肌肉、神经、骨胳组织中均可观察到PCNA阳性细胞。以脂肪细胞和皮肤组织中阳性细胞数量多,阳性强呈深棕色。
对照组断尾后15 d(图1 D、E、F)、18 d(图2 D、E、F)和20 d(图3 D、E、F)和断尾后注射α-细辛醚实验组15 d(图1 G、H、I)、18 d(图2 G、H、I)和20 d(图3 G、H、I)的横切面可观察到大量PCNA阳性细胞。其中注射α-细辛醚20 d实验组(图3 H、I)芽基的皮肤与肌肉中的PCNA阳性细胞较同期对照组更明显(图2 D、E、F)。
2.2 PCNA表达强度变化
在空白组、对照组和实验组,PCNA阳性反应的灰度值在皮肤、肌肉和脊髓中各不相同(图4,图5,图6)。所有空白组的上述组织中PCNA阳性反应的灰度值均显著高于实验组(P<0.05),其中以20 d实验组脊髓阳性反应最强,其灰度值低至123.10±2.91。在皮肤,15 d和18 d的对照组与实验组PCNA灰度值差异不显著,而20 d实验组灰度值为125.23±2.89,明显低于对照组145.61±3.77。肌肉中PCNA灰度值强度变化与皮肤类似,仅20 d实验组灰度值显著低于对照组。在脊髓,实验组的PCNA灰度值均显著低于对照组,表明α-细辛醚对再生脊髓细胞增殖促进作用明显。
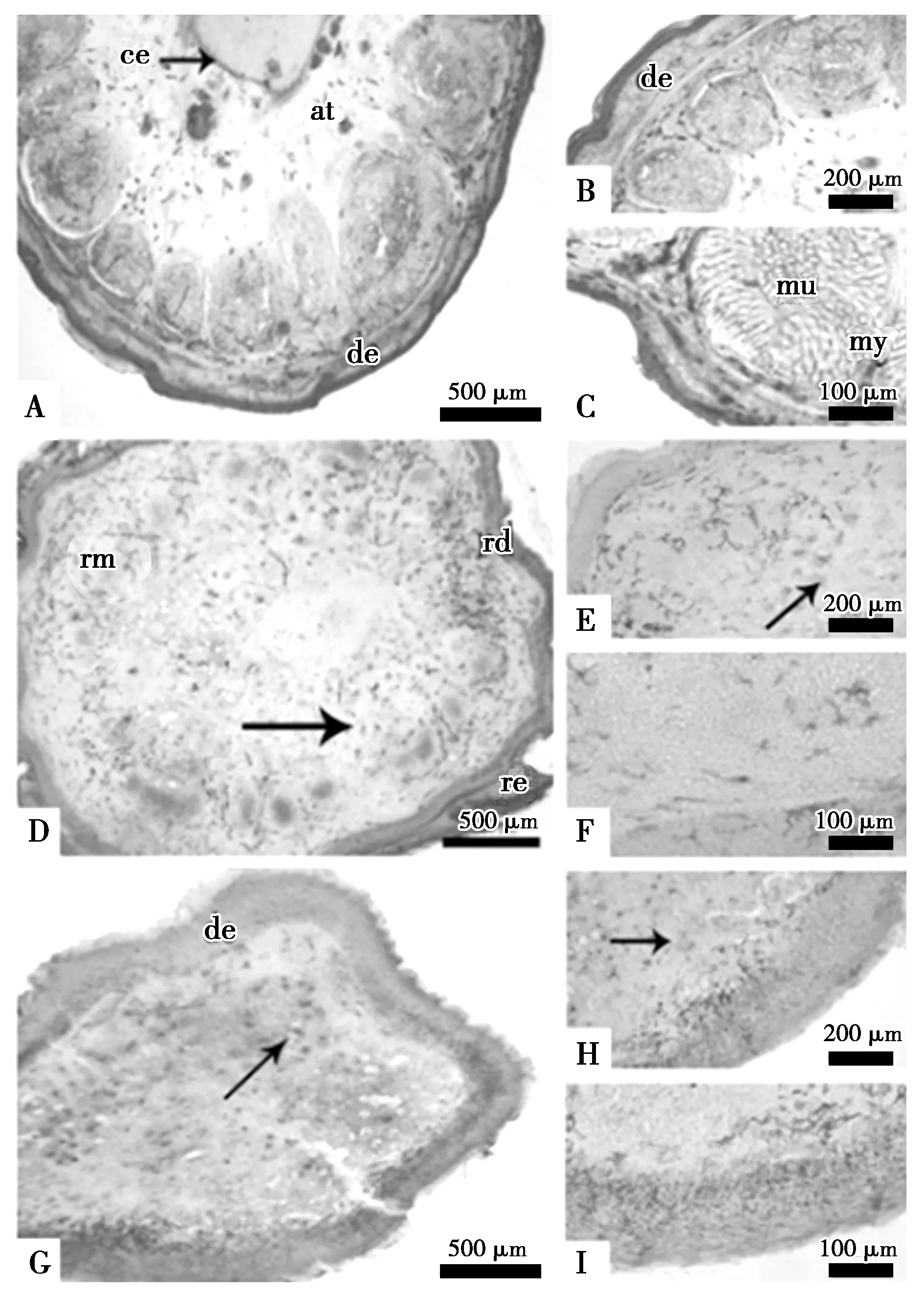
图1 α-细辛醚注射后15 d再生尾PCNA阳性细胞分布Fig.1 Distribution of PCNA-positive cells in the regenerated tails after 15 days of α-asarone injection 注:A、B、C示空白组;D、E、F示对照组;G、H、I示实验组。de,真皮;at,脂肪组织;no,脊索;sc,脊髓;mu,肌肉;ce,中心椎体;my,肌隔;cc,软骨椎;ep,表皮;rm,再生肌肉;rd,再生真皮;re,再生表皮;bv,血管。(图2,图3同) Notes:A,B,C showing blank group.D,E,Fshowing control group.G,H,I showing experimental group.de,dermis.at,adipose tissue.no,notochord.sc,spinal cord.mu,muscle.ce,central vertebral.my,myoseptum.cc,cartilage cone.ep,epidermis.rm,regenerative muscle.rd,regenerative dermis.re,regenerated epidermis.bv,blood vessel.(Figure 2,3 is the same)
3 讨论
低等脊椎动物的再生模型集中在鱼类、两栖类,而在系统进化上更靠近哺乳动物的蜥蜴类爬行动物的再生机制研究相对滞后[14],加强后者再生机制的研究则更有借鉴意义。国内学者对于快步麻蜥(Eremiasvelox)[15],胎生蜥蜴(Lacertavivipara)[16]和南草蜥(Takydromussexlineatus)[17]等的断尾再生现象进行了观察。断尾再生的组织形态学、生物化学和免疫细胞化学等方面的基础资料主要来自对绿色安乐蜥(Anoliscarolinensis)[18]和豹纹守宫[19-20]为代表的蜥蜴亚目6科30余种蜥蜴的持续研究,为探究断尾再生分子机制奠定了坚实基础[3]。蜥蜴类在断尾后可进行形态结构的再生和功能的恢复。秦岭滑蜥再生尾与原尾外观形态相似,显微结构明显不同[10]。
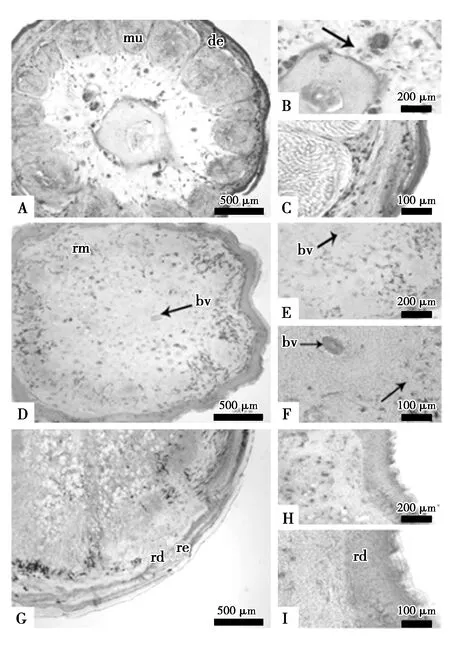
图2 α-细辛醚注射后18 d再生尾PCNA阳性细胞分布Fig.2 Distribution of PCNA-positive cells in the regenerated tails after 18 days of α-asarone injection
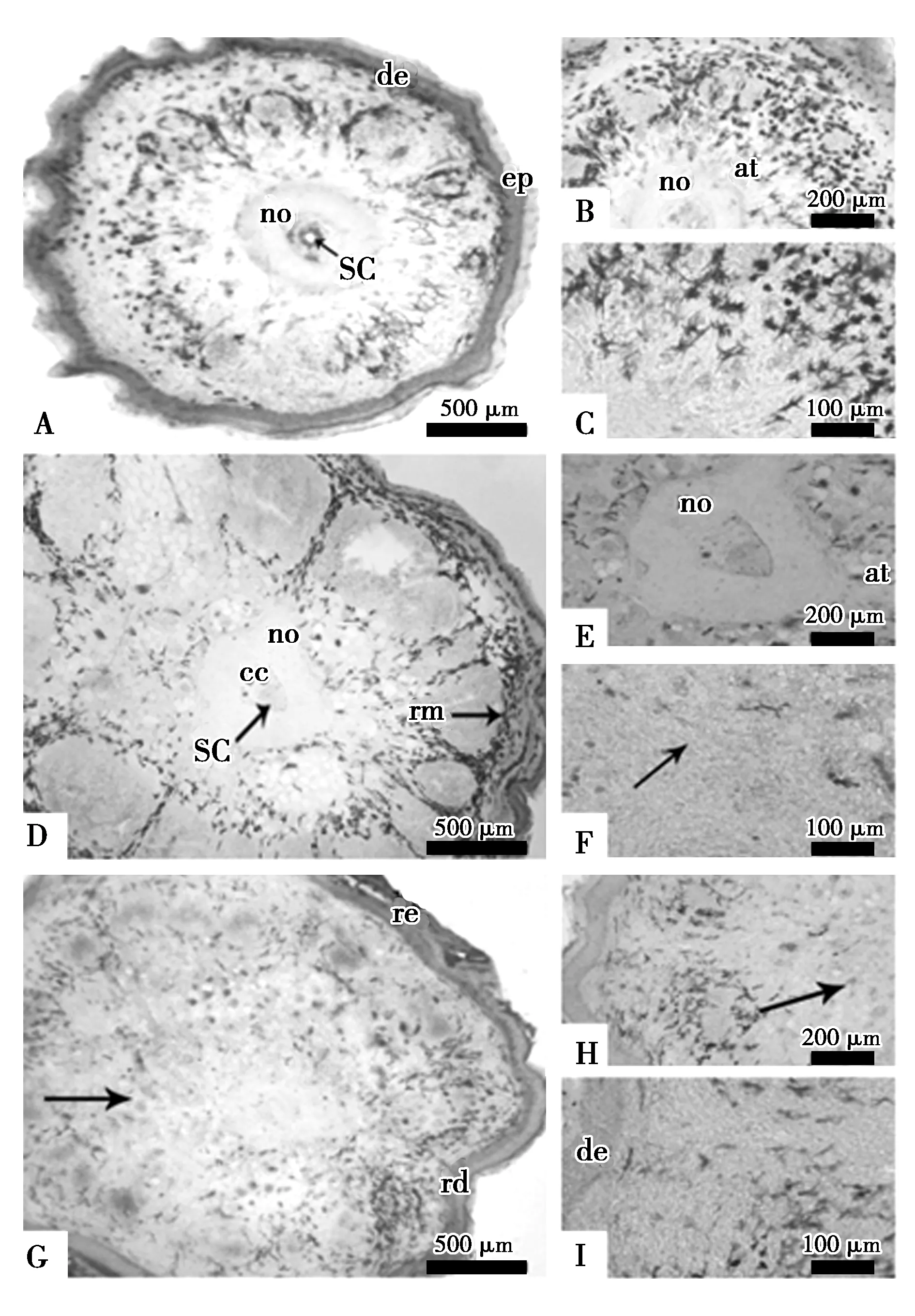
图3 α-细辛醚注射后20 d再生尾PCNA阳性细胞分布Fig.3 Distribution of PCNA-positive cells in the regenerated tails after 20 days of α-asarone injection
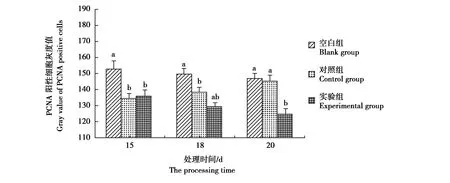
图4 秦岭滑蜥皮肤中PCNA阳性细胞灰度值Fig.4 Column chart of gray value of PCNA positive cells in skin of Scincella tsinlingensis
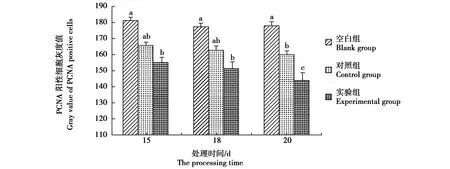
图5 秦岭滑蜥肌肉中PCNA阳性细胞灰度值Fig.5 Column chart of gray value of PCNA positive cells in muscle of Scincella tsinlingensis
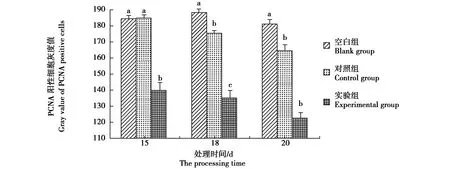
图6 秦岭滑蜥脊髓中PCNA阳性细胞灰度值Fig.6 Column chart of gray value of PCNA positive cells in spinal cord of Scincella tsinlingensis 注:上标不同字母表示组间差异显著(P<0.05) Note:Different letters means significant difference between groups(P<0.05)
同一物种不同组织器官的再生可能采用了不同的细胞来源途径,而某一器官的再生在不同动物模型中可通过相似或多样化的机制实现再生器官的重建[21]。蜥蜴断尾再生可分为伤口愈合期、芽基形成期、细胞分化期和成熟期4个时期。芽基的细胞来源于原尾大部分组织的细胞增殖和迁移。豹纹守宫的原尾与再生尾表皮、成纤维细胞、血管内皮细胞和软骨细胞等中都可观察到PCNA阳性细胞,而且豹纹守宫再生尾的新生血管、神经组织、肌肉、再生上皮和软骨等部位PCNA的表达都有所不同[22-23]。在绿色安乐蜥大量组织的强烈增殖维持断尾再生。断尾后用BrdU标记细胞,在再生14 d和21 d的芽基、伤口表皮和再生鳞片中仍有分布[24]。伤口表皮基底层BrdU标记细胞已更多的迁移到再生表皮的中间层和外层,支持再生尾部的表皮扩张过程。在秦岭滑蜥断尾后芽基形成期的15 d、18 d和20 d,主要处于芽基形成和细胞分化阶段,经历新生血管的形成和脊髓再生,其皮肤、肌肉和脊髓中均有PCNA阳性细胞分布,细胞增殖较原尾活跃。在实验组,上述3种组织中PCNA阳性反应的灰度值均明显低于对照组(P<0.05)。在皮肤,PCNA均匀分布于整个表皮,表明大部分不规则鳞片尚未分化出明显的外表面和内表面。15 d和18 d的对照组与实验组PCNA灰度值差异不显著,而20 d对照组灰度值为145.61±3.77显著高于实验组的125.23±2.89。肌肉中PCNA表达强度与皮肤类似,仅20 d实验组灰度值显著低于对照组。
蜥蜴断尾后脊髓再生的形态和功能重建中涉及的神经再生能力引人注目。蜥蜴脊髓再生过程中,去分化和再分化形成胶质细胞和神经元是神经再生的关键,涉及相关干细胞或者前体细胞的增殖、迁移及分化。神经发生是多疣壁虎(Gekkojaponicus)尾部脊髓再生期间的早期事件,其成体脊髓中干细胞数量较高等动物多,神经干细胞分化为神经元的比例更高,断尾后神经干细胞最早出现在2 W[25]。豹纹守宫原始脊髓的室管膜层贮存的神经干/祖细胞在断尾再生期间被激活[20]。在秦岭滑蜥,注射α-细辛醚的实验组,再生脊髓PCNA细胞呈强阳性、灰度值均显著低于对照组,20 d实验组脊髓阳性反应灰度值低至123.10±2.91,神经组织细胞增殖最为活跃。这表明细辛醚不仅对大鼠的神经再生有促进作用[26-27],也能促进秦岭滑蜥的再生脊髓细胞增殖。蜥蜴断尾再生与炎症或低水平免疫细胞活化相关[28]。α-细辛醚的抗炎作用很可能降低了秦岭滑蜥断尾再生早期阶段的炎性反应,促进细胞增殖、利于断尾再生。
