病毒性肝炎患者外周血T细胞亚群与病毒载量、胃蛋白酶原水平及胃黏膜病变程度的相关研究①
2020-02-20韩凌飞刘建民安徽省马鞍山市临床检验中心马鞍山243000
朱 翔 韩凌飞 杨 燕 魏 澄 贺 松 刘建民 (安徽省马鞍山市临床检验中心,马鞍山 243000)
乙型病毒性肝炎(简称乙肝)是由乙肝病毒(hepatitis B Virus,HBV)感染引起的一种感染性肝脏疾病,该疾病在全球广泛分布,我国是乙肝大国,HBsAg流行率约为6.1%,约有3 000万慢性乙型肝炎患者[1]。肝脏为人体重要免疫器官,机体的免疫状态对HBV的清除及机体的病变程度起决定性作用:HBV通过免疫反应间接损伤肝细胞,随着病情进展,可发展成肝硬化,造成严重肝功能损害和门脉高压,甚至癌变。T淋巴细胞亚群是反映机体免疫状态的重要指标,根据分化抗原的表达,临床一般以CD3+CD4+辅助/诱导性T 细胞和CD3+CD8+抑制性/细胞毒T细胞的比例来衡量机体的免疫平衡状态。肝脏还是消化道外最大的消化腺体,临床研究表明[2]:HBV的感染除了影响肝脏功能外,还会影响机体消化功能、胃的分泌功能,导致胃黏膜病变。胃蛋白酶原(pepsinogen,PG)是胃蛋白酶的前体,包括PGⅠ和PGⅡ两个亚群,有1%的PG会经过毛细血管进入外周血,外周血PG的水平及比值能反映胃黏膜病变程度[3]。本研究试图探讨乙肝、乙肝性肝硬化患者的T细胞亚群分布与HBV载量、PG水平和胃黏膜病变程度之间的关系,旨在为乙肝患者及胃部病变的临床研究提供理论参考价值。
1 资料与方法
1.1资料
1.1.1基本资料 以市人民医院和传染病院于2016年12月至2018年12月期间收治的136例慢性乙型肝炎患者为乙肝组,纳入84例乙型肝炎型肝硬化患者为肝硬化组,并纳入50例无HBV感染的健康志愿者为对照组。其中乙肝组男性89例,女性47例;年龄30~70岁,平均(45.15±10.76)岁。肝硬化组男性62例,女性22例;年龄35~74岁,平均年龄(48.12±7.61)岁。对照组男性36例,女性14例;年龄32~75岁,平均年龄(46.28±9.36)岁。三组患者的性别(χ2=1.920,P=0.382)、年龄(F=2.440,P=0.089)差异无统计学意义,具有可比性。
纳入标准:①乙肝组和肝硬化组患者符合《慢性乙型肝炎防治指南》[4]中的诊断标准,确诊为乙肝/肝硬化;②乙肝组患者血清HBV DNA 超过2×104U/ml,血清ALT值超过正常人群上限的两倍(正常范围:0~40 U/L);③乙肝组和肝硬化组HBsAg阳性超过6个月;④肝硬化组患者病因为HBV感染;⑤所有患者检测前未进行过抗病毒治疗;⑥患者及家属均签署知情同意书。
排除标准:①排除酒精性肝病、药物性肝病引起的肝损伤患者;②排除患者自身免疫性肝炎患者;③排除合并患者恶性肿瘤患者;④排除有吸毒史或毒品接触患者;⑤排除合并伴有免疫缺陷类疾病的患者;⑥排除合并感染其他类型肝炎病毒患者;⑦排除既往有胃溃疡等胃部疾病史的患者。
1.1.2材料与仪器 PCR检测采用安普利9800型RT-PCR检测系统,所用试剂由厦门安普利生物工程有限公司提供;血清PG检测试剂盒由苏兰必欧瀚提供;流式细胞仪为FACSCalibur;相关试剂由BD公司提供;胃镜为OLYMPUS电子纤维胃镜。
1.2方法
1.2.1血清HBV-DNA 载量 患者治疗前清晨空腹抽取外周静脉血5 ml,平均分为两份,其中一份3 000 r/min离心取上清,测定患者血清HBV-DNA载量。所有操作严格按照说明书进行。最终将血清HBV-DNA 载量进行对数转换后进行比较。
1.2.2血清PG测定 取1.2.1中血清,采用ELISA法检测血清PGⅠ和PGⅡ并计算两者的比值,正常参考范围:PGⅠ:70~165 μg/L,PGⅡ:3~15 μg/L,PGⅠ/PGⅡ:7~20,所有操作按照说明书严格执行。
1.2.3外周血T细胞亚群测定 另一份外周静脉血加入EDTA抗凝管。采用溶血素法人工去除红细胞,检测CD3+T细胞、CD4+T细胞和CD8+T细胞百分比,并计算CD4+/CD8+,所有操作严格按照说明书进行。
1.2.4胃黏膜检测 所有患者上午空腹8 h进行胃镜检查,检测胃黏膜,对于胃壁黏膜发生严重溃烂者取胃黏膜活体标本进行进一步组织学检测。
2 结果
2.1HBV病毒载量比较 对照组未检测到HBV DNA,肝硬化组HBV DNA载量显著高于乙肝组(P<0.05),差异有统计学意义(P<0.05)。
2.2血清PG水平比较 三组PGⅠ、PGⅡ和PGⅠ/PGⅡ差异均具有统计学意义(P<0.05);肝硬化组PGⅠ、PGⅠ/PGⅡ显著低于乙肝组,乙肝组显著低于对照组;肝硬化组PGⅡ显著高于乙肝组,乙肝组显著高于对照组。见表2。
2.3胃黏膜检测结果 对照组、乙肝组和肝硬化组胃黏膜病变程度差异有统计学意义(P<0.05),对照组正常和浅表性胃炎比例为76.0%,乙肝组正常和浅表性胃炎比例为41.17%,肝硬化组正常和浅表性胃炎比例为19.05%;萎缩性胃炎比例:肝硬化组>乙肝组>对照组,差异有统计学意义(P<0.05);详见表3。
2.4外周血T细胞亚群 三组患者CD3+、CD4+、CD8+、CD4+/CD8+差异均具有统计学意义(P<0.05),且对照组>乙肝组>肝硬化组,组间两两比较,差异均具有统计学意义(P<0.05);详见表4。


GroupsnHBVDNAload(log10U/ml)Controlgroup500Hepatitisgroup1365.24±1.31Cirrhosisgroup845.83±1.47t3.096P0.002

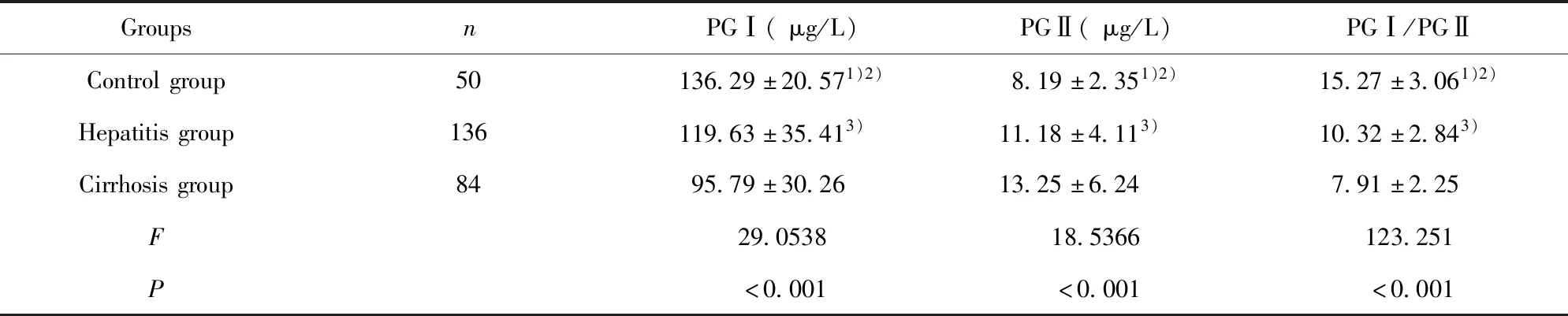
GroupsnPGⅠ(μg/L)PGⅡ(μg/L)PGⅠ/PGⅡControlgroup50136.29±20.571)2)8.19±2.351)2)15.27±3.061)2)Hepatitisgroup136119.63±35.413)11.18±4.113)10.32±2.843)Cirrhosisgroup8495.79±30.2613.25±6.247.91±2.25F29.053818.5366123.251P<0.001<0.001<0.001
Note:Comparison between control group and hepatitis B group,1)P<0.05;comparison between control group and cirrhosis group,2)P<0.05;comparison between hepatitis B group and cirrhosis group,3)P<0.05.
表3 胃黏膜病变程度比较
Tab.3 Comparison of gastric mucosal lesions degree
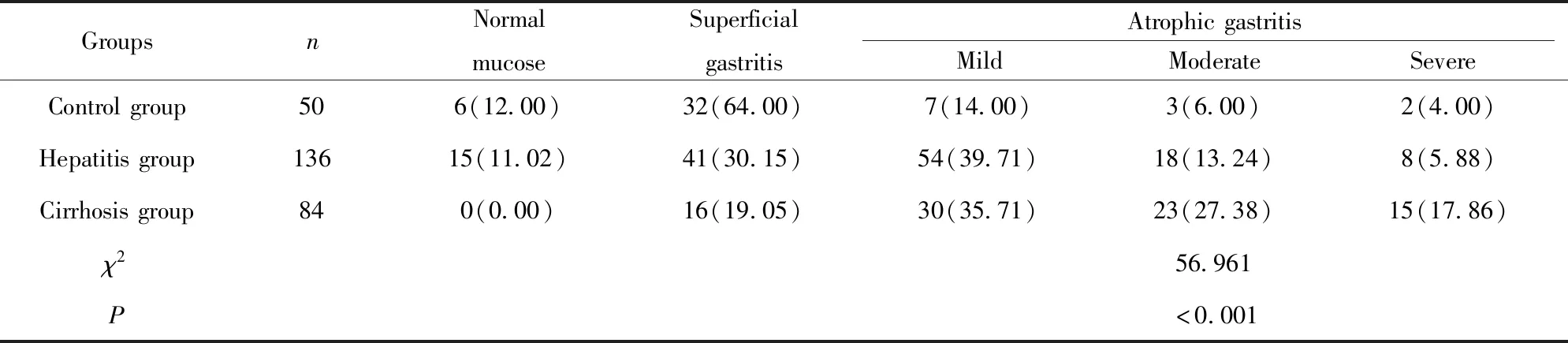
GroupsnNormalmucoseSuperficialgastritisAtrophicgastritisMildModerateSevereControlgroup506(12.00)32(64.00)7(14.00)3(6.00)2(4.00)Hepatitisgroup13615(11.02)41(30.15)54(39.71)18(13.24)8(5.88)Cirrhosisgroup840(0.00)16(19.05)30(35.71)23(27.38)15(17.86)χ256.961P<0.001
Note:Pairwise comparison by rank sum test between the two groups showed thatP<0.05.
表4 外周血T细胞亚群比较
Tab.4 Comparison of T lymphocyte subsets in peripheral blood

GroupsnCD3+(%)CD4+(%)CD8+(%)CD4+/CD8+Controlgroup5067.56±5.811)2)49.62±8.811)2)32.04±5.231)2)1.59±0.471)2)Hepatitisgroup13664.37±7.433)44.65±7.363)31.57±6.483)1.38±0.353)Cirrhosisgroup8461.46±8.0237.66±9.1128.98±7.761.29±0.33F7.96336.4404.83710.465P<0.001<0.0010.006<0.001
Note:Comparison between control group and hepatitis B group,1)P<0.05;comparison between control group and cirrhosis group,2)P<0.05;comparison between hepatitis B group and cirrhosis group,3)P<0.05.
表5 T细胞亚群与HBV DNA载量、血清PG和胃黏膜病变程度的相关性分析
Tab.5 Correlation analysis of T cell subsets with HBV DNA load,serum PG and gastric mucosal lesions

IndexHBVDNAloadrPPGⅠrPPGⅡrPPGⅠ/PGⅡrPGastricmucosallesionsrPCD3+(%)-0.0540.3770.0150.8130.0210.7310.0660.279-0.0110.857CD4+(%)-0.0960.1150.0220.7190.0160.7940.0540.377-0.0410.502CD8+(%)0.0750.219-0.0310.612-0.0250.683-0.0690.259-0.0480.432CD4+/CD8+-0.4750.0000.1180.052-0.1050.0850.2960.000-0.3150.000
2.5相关性分析 分别采用Pearson、Spearman相关性分析外周血T细胞亚群与HBV DNA载量、血清PGⅠ、PGⅡ、PGⅠ/PGⅡ以及胃黏膜病变程度,结果发现CD3+、CD4+、CD8+与HBV DNA载量、血清PGⅠ、PGⅡ、PGⅠ/PGⅡ以及胃黏膜病变程度无显著相关性(P<0.05);而CD4+/CD8+与HBV DNA载量、胃黏膜病变程度呈负相关性(P<0.05),与PGⅠ、PGⅡ无显著相关性(P>0.05),与PGⅠ/PGⅡ呈正相关性(P<0.05);详见表5。
3 讨论
HBV是一种正嗜肝DNA病毒,能在人体的肝细胞内繁殖,对肝细胞具有高度亲和性。全世界HBV携带者超过3.5亿人,我国的HBV携带者约1.2亿,HBV感染导致的慢性乙型肝炎至今仍是侵害人类健康的主要疾病之一[5]。我国是乙肝高负担国家,随着HBV感染、病情的进展和肝功能的损害,5年内有10%~20%的乙肝患者可发展成肝硬化,其中又有6%~15%的患者可能进一步发展成肝癌[6]。乙肝的发病机制较为复杂,但目前认为病毒感染后患者的免疫功能紊乱是导致乙肝发生和病情进展的重要原因。
乙肝的发病机制主要是免疫系统对HBV的清除作用引发的肝细胞病理改变,其中以细胞免疫为主导:HBV在感染人体后,未被单核巨噬细胞及时清除的残余病毒会在肝脏中复制,引起肝细胞的细胞免疫应答反应[7]。因而病毒载量、被感染的细胞数量以及体内的病毒清除作用的平衡是决定患者肝脏损伤严重程度的主要原因。本研究发现肝硬化组HBV DNA载量显著高于乙肝组,这与以往报道基本一致[8]。T细胞是主导细胞免疫反应的主要效应细胞,T淋巴细胞亚群又是反映细胞免疫平衡的重要指标。CD3+是所有成熟的T细胞总和,代表的是机体整体的免疫功能,CD3+T淋巴细胞根据其功能和表面标志物可以分为细胞毒性T细胞(表面标志物为CD8+)和辅助性T细胞(表现标志物为CD4+)。其中CD4+参与抗原识别和信号转导,其主要作用是促进B淋巴细胞、CD8+毒性细胞和多种免疫细胞的增殖分化,对机体的体液免疫和细胞免疫均具有重要调节作用[9]。CD8+T细胞能杀灭产生特殊抗原的目标细胞,通过分泌性膜溶解途径或泛素凋亡途径清除HBV,其含量是决定HBV清除的关键因素[10],CD4+/CD8+则是反映机体的免疫平衡状态的指标,一般认为二者比值下降表明机体免疫功能变弱[11]。本研究发现随着病情加重,外周血中的CD3+、CD4+、CD8+、CD4+/CD8+均显著下降,相关性分析发现CD4+/CD8+与HBV DNA载量呈负相关性,认为T淋巴细胞含量及CD4+/CD8+下降主要是由于辅助性T细胞功能受到抑制,CD4+和CD8+含量下降,导致HBV病毒无法及时清除,引发肝细胞损伤,胡亚南等[12]发现乙肝患者外周血Th17/Treg比例失衡,与本研究有相似之处,这进一步证实了乙肝和肝硬化患者存在免疫平衡紊乱。
HBV是一种泛嗜性病毒,除了肝脏外,同时也存在于许多肝外脏器组织中,研究报道HBV感染与非肝细胞癌有显著的非特异性关联[13]。胃黏膜病变是常见的肝外表现之一。HBV可能参与了乙肝患者的胃黏膜损伤,这主要是由HBV本身对胃黏膜的损伤作用和病毒清除过程中CD8+细胞对胃黏膜细胞的损伤作用引起的[14]。临床已经发现肝硬化患者多伴有门脉高压性胃病,是一种特殊的胃黏膜病变[15]。陈轶等[16]报道慢性乙肝、肝硬化、肝癌的胃黏膜病变发生率均在90%以上,且发现HBV是影响乙肝患者胃黏膜炎症严重程度的关键因素。 PGⅠ主要由胃底的主细胞和颈黏液细胞分泌,PGⅡ可由多种胃黏膜细胞分泌(包括主细胞、颈黏液细胞、幽门、贲门以及十二指肠等),两者的含量和比值常作为胃黏膜分泌功能的反映指标。本研究发现乙肝组和肝硬化组PGⅠ、PGⅠ/PGⅡ显著降低,但PGⅡ维持在一个较高水平。胃镜下结果发现随着病情加重,胃黏膜正常和浅表性胃炎比例下降,萎缩性胃炎的比例升高,且严重程度增加。周晓蕾等[17]发现肝硬化患者血清PGⅠ水平与Child-Paugh分级存在一定的关联系。分析认为,HBV在感染胃肠道后,胃窦、胃底是多发部位,在胃黏膜损伤早期,持续的炎症反应主要损伤胃底的主细胞,导致PGⅠ下降,随着炎症反应加重,胃黏膜通透性增加,更多的PGⅡ进入外周血循环,导致两者比值下降,此时胃镜下表现为黏膜呈花斑样病变;当胃黏膜持续损伤发展成为萎缩性胃炎时,胃黏膜上皮和腺体萎缩,数量明显减少,PGⅠ含量进一步下降,而PGⅡ可由多种腺体分泌仍然保持在一个较高水平,两者比值进一步下降,此时胃镜下主要表现为充血、水肿和糜烂[18]。
机体的免疫平衡状态是决定HBV病毒载量、乙肝进程的关键因素,那么其是否与乙肝人群的胃黏膜病变相关?本研究进行相关性分析发现,CD3+、CD3+CD4+、CD3+CD8+虽然与血清PG水平和胃黏膜病变无显著相关性,但CD4+/CD8+与血清PGⅠ/PGⅡ呈正相关性,与胃黏膜病变炎症程度呈负相关性。刘跃平等[19]在慢性萎缩性胃炎中发现随着胃黏膜病变级别加重,CD4+/CD8+下降,认为随着机体的免疫功能降低,胃黏膜病变加重;与杨善峰等[20]发现幽门螺杆菌阴性的疣状胃炎患者外周血T淋巴细胞亚群的比例可以间接反映胃黏膜病变状况。认为当乙肝患者的CD4+/CD8+比值下降时,代表机体的免疫平衡状态趋向于免疫抑制状态,这不利于HBV DNA清除,逃逸的HBV对胃黏膜产生损伤,导致血清PGⅠ/PGⅡ水平下降,提示免疫功能是决定乙肝患者病情以及胃黏膜损伤的关键因素。