汉黄岑素通过调节P53信号通路增强宫颈癌对顺铂的化疗敏感性①
2020-02-20李恩萍杨长春史天云徐方方南阳市第一人民医院妇科南阳473000
王 博 李恩萍 杨长春 史天云 陈 鹤 徐方方 (南阳市第一人民医院妇科,南阳 473000)
宫颈癌(cervical cancer,CC)是最常见的妇科恶性肿瘤之一,在我国CC也是癌症相关死亡的最常见原因之一[1]。近年来,随着女性过早发生性行为、有多个性伴侣及高危型人乳头瘤病毒携带者的人数增加,CC发病率持续上升,且呈现年轻化的趋势[2]。顺铂(Cisplatin,DDP)是目前化疗的常用药物,研究报道DDP对CC细胞有增殖抑制和凋亡诱导作用[3]。DDP在杀灭肿瘤细胞的同时对患者的正常生理功能和免疫系统也具有较大的负面影响[4]。临床上常使用其他的药物联合DDP共同使用,实现CC对DDP的化疗敏感性。汉黄岑素是黄岑有效成分之一,具有抗病毒、抗肿瘤及保护神经的生物活性[5]。汉黄岑素也可以抑制肺癌细胞的增殖和分化并促进其凋亡[6]。研究表明黄芩素可以显著降低细胞侵袭浸润能力[7]。但目前汉黄岑素通过调节信号通路对CC化疗敏感性的影响研究较少。本文旨在研究汉黄岑素通过调节P53信号通路增强CC对DDP的化疗敏感性,以期了解黄岑素通过调节P53信号通路增强CC对DDP的化疗敏感性影响的作用机理,从而为CC治疗提供一定的参考数据。
1 材料与方法
1.1材料
1.1.1主要细胞 宫颈癌细胞株购自中国科学院细胞库。
1.1.2主要试剂与仪器 汉黄岑素(纯度>98%)购自成都康辉生物科技有限公司;Caspase-3、Bcl-2、Bax抗体购自武汉华联科技有限公司;Annexin V-FITC 凋亡检测试剂盒购自杭州四季青生物工程材料有限公司;LC3抗体购自美国Sigma公司;cytC抗体购自Santa Cruze Biotechnology 公司;LC3Ⅱ/LC3Ⅰ试剂盒购自江莱生物有限公司;Ki67、PCNA抗体购自北京傲锐东源生物科技有限公司;Beclin1、 P62抗体购自Sino Biolocgical公司;磷酸盐缓冲液PBS购自天津科密欧有限公司;RPMI1640 培养基购自广州威佳科技有限公司;DMEM基础培养基购自赛默飞世尔科技公司;青霉素钠购自哈药集团制药总厂。
细胞培养箱购自美国Forma公司;低温离心机购自湖南恒诺离心机有限公司;光学显微镜购自东莞市同创仪器有限公司;荧光分光光度计购自上海仪电分析仪器有限公司;流式细胞仪购自赛默飞世尔科技有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司。
1.2方法
1.2.1分组干预 分别使用0、5、10、15、20、25、30、35、40、45、50 μmol/L的汉黄岑素处理正常宫颈细胞系建立DDP敏感性的CC细胞株,并检测IC50后将细胞分为:空白对照组、贝伐单抗组、顺铂组、低剂量汉黄岑素组、中剂量汉黄岑素组、高剂量汉黄岑素组、P53抑制剂组和汉黄岑素+P53抑制剂组,其中贝伐单抗组使用2.5 μg/ml的贝伐单抗处理;顺铂组使用10 mg/L 的DDP处理;低剂量汉黄岑素组使用DDP 10 mg/L+WG 5 μmol/L处理;中剂量汉黄岑素组使用DDP 10 mg/L+WG 10 μmol/L处理;高剂量汉黄岑素组使用DDP 10 mg/L+WG 20 μmol/L处理;P53抑制剂组使用DDP 10 mg/L+P53抑制剂 Pifithrin-α处理;汉黄岑素+P53抑制剂组使用DDP 10 mg/L+WG20 μmol/L+P53抑制剂 Pifithrin-α处理。
1.2.2细胞培养 将宫颈癌细胞株培养于含10% FBS、100 U/ml 青霉素和100 U/ml链霉素的RPMI1640 培养基中,保存在37℃、5%CO2培养箱中,取对数生长期细胞进行实验。
1.2.3流式细胞仪分析检测细胞凋亡 分别将各组细胞培养24 h后使用胰酶消化,在4℃ 3 500 g离心5 min 收集细胞;收集细胞后加入100 μl Binding Buffer重悬细胞并加入5 μl Annexin V-FITC和5 μl PI,轻轻混匀;室温避光孵育15 min并加入400 μl Binding Buffer,使用流式细胞仪检测细胞凋亡情况。
1.2.4Western blot 检测蛋白表达水平 取对数期细胞,吸除培养皿中的培养基保存于灭菌离心管中。1 200 r/min离心10 min后加入裂解液重悬细胞,放置于冰中裂解30 min,再次以1 200 r/min离心10 min,加入200 μl的Loading Buffer 缓冲液,100℃煮沸10 min;使用BCA法测定蛋白浓度后,使用SDS-PAGE电泳提取总蛋白,半干法将蛋白转移到PVDF膜后放入 TBST 溶液中缓慢摇动洗膜5 min,再将 PVDF 膜放入配制好的一抗液中孵育,室温下缓慢摇动30 min后放入4℃恒温箱中过夜。取出后使用TBST洗涤3遍后放入二抗反应液中室温孵育2 h;封闭液∶二抗为 2 000∶1;曝光后以GADPH为内参蛋白,目的蛋白条带灰度值/内参条带灰度值为相对蛋白表达水平。
1.2.5免疫荧光检测自噬情况 取对数生长期CC细胞,调整细胞浓度为2.5×105个/ml,2 ml接种于6孔板,37℃,5%CO2条件下,过夜培养(约16 h)。按照 LC3荧光试剂盒说明书加入固定液固定10 min,弃掉固定液,PBS洗3次,加入免疫染色液,室温封闭1 h,加入DAPI染液,室温染色5 min,洗涤液洗涤2次,加入抗淬灭剂,荧光显微镜下观察。
1.3统计学方法 本研究数据分析和作图采用的软件为SPSS22.0和GraphPad Prism5,使用单因素方差分析,当组间差异存在统计学意义时,采用SNK方法进行进一步的比较;使用单因素方差分析时,若P<0.05则表明数据差异有统计学意义。
2 结果
2.1汉黄岑素对宫颈癌细胞生长情况的影响 由图1A可以看出,随着使用汉黄岑素的浓度增加CC细胞生存率显著降低,且当汉黄岑素浓度超过25 μmol/L 时差异有统计学意义(P<0.05);由图1B可以看出,DDP敏感性的CC细胞株IC50为50 mg/L;由图1C可以看出,相比空白对照组,贝伐单抗组CC细胞生存率显著下降(P<0.05),相比顺铂组,低剂量汉黄岑素组、中剂量汉黄岑素组CC细胞生存率显著下降(P<0.05),相比顺铂组,高剂量汉黄岑素组CC细胞生存率显著下降(P<0.01)。由图1D、E可以看出,相比空白对照组,贝伐单抗组CC细胞Ki67、PCNA蛋白表达水平显著降低(P<0.05),相比顺铂组,低剂量汉黄岑素组、中剂量汉黄岑素组CC细胞Ki67、PCNA蛋白表达水平显著降低(P<0.05),相比顺铂组,高剂量汉黄岑素组CC细胞Ki67、PCNA蛋白表达水平显著降低(P<0.01)。
2.2汉黄岑素对宫颈癌细胞凋亡情况的影响 由图2A可以看出,相比空白对照组,贝伐单抗组CC细胞凋亡显著增加,相比顺铂组,使用汉黄岑素处理各组CC细胞凋亡显著增加;由图2B可以看出,相比空白对照组,贝伐单抗组CC细胞Bcl-2蛋白表达显著降低(P<0.05),Bax、Caspase-3、cytC蛋白表达水平显著升高(P<0.05);相比顺铂组,低剂量汉黄岑素组Bcl-2蛋白表达显著降低(P<0.05),Bax、Caspase-3、cytC蛋白表达水平显著升高(P<0.05);相比低剂量汉黄岑素组,中剂量汉黄岑素组Bcl-2蛋白表达显著降低(P<0.05),Bax、Caspase-3、cytC蛋白表达水平显著升高(P<0.05);相比中剂量汉黄岑素组,高剂量汉黄岑素组Bcl-2蛋白表达显著降低(P<0.05),Bax、Caspase-3、cytC蛋白表达水平显著升高(P<0.05)。
2.3汉黄岑素对宫颈癌细胞自噬情况的影响 由图3A可以看出,相比空白对照组,贝伐单抗组CC细胞荧光强度显著增强;相比顺铂组,低剂量汉黄岑素组、中剂量汉黄岑素组和高剂量汉黄岑素组CC细胞荧光强度显著增强。由图3B可以看出,相比空白对照组,贝伐单抗组CC细胞LC3Ⅱ/LC3Ⅰ、Beclin1水平显著升高(P<0.05),P62显著降低(P<0.05);相比顺铂组,低剂量汉黄岑素组CC细胞LC3Ⅱ/LC3Ⅰ、Beclin1水平显著升高(P<0.05),P62显著降低(P<0.05);相比低剂量汉黄岑素组,中剂量汉黄岑素组CC细胞LC3Ⅱ/LC3Ⅰ、Beclin1水平显著升高(P<0.05),P62显著降低(P<0.05);相比中剂量汉黄岑素组,高剂量汉黄岑素组CC细胞LC3Ⅱ/LC3Ⅰ、Beclin1水平显著升高(P<0.05),P62显著降低(P<0.05)。
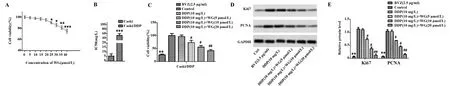
图1 汉黄岑素对宫颈癌细胞生长情况影响
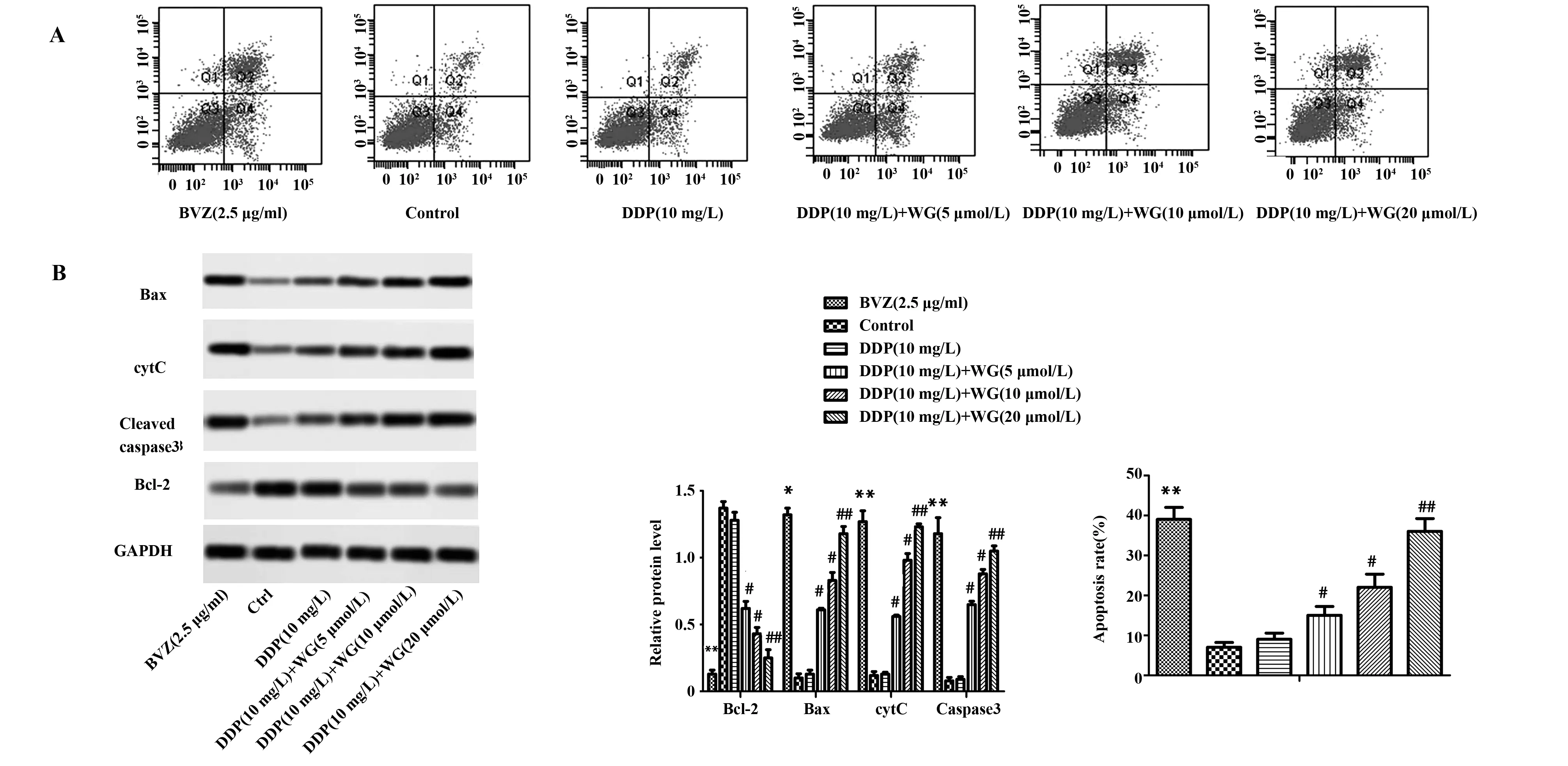
图2 汉黄岑素对宫颈癌细胞凋亡情况的影响
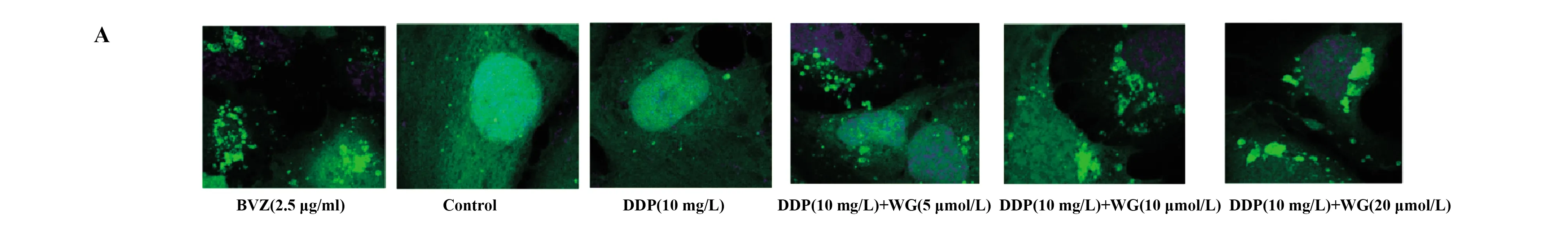
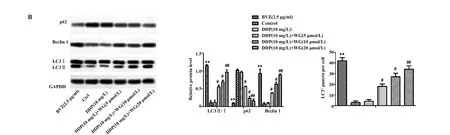
图3 汉黄岑素对宫颈癌细胞自噬情况的影响
Fig.3 Effects of Wogonin on autophagy of cervical cancer cells
Note: A.The results of immunofluorescence detection;B.The expression of autophagy-related protein.Compared with control group,**.P<0.01;compared with DDP(10 mg/L) group,#.P<0.05,##.P<0.01.
2.4不同浓度汉黄岑素对宫颈癌细胞的影响 由图4A、B可以看出,相比顺铂组,使用5、10、20 μmol/L汉黄岑素处理各组P53蛋白表达显著降低(P<0.05),相比顺铂组,使用P53抑制剂组,P53蛋白表达显著降低(P<0.05);与P53抑制剂组相比,汉黄岑素+P53抑制剂组P53蛋白表达显著升高(P<0.05);由图4D、E、F可以看出,相比顺铂组,高剂量汉黄岑素组CC细胞存活率显著下降(P<0.05),CC细胞凋亡率、单个细胞内LC3+荧光点数显著升高(P<0.05);相比P53抑制剂组,汉黄岑素+P53抑制剂组CC细胞存活率显著下降(P<0.05),CC细胞凋亡率、单个细胞内LC3+荧光点数显著升高(P<0.05)。
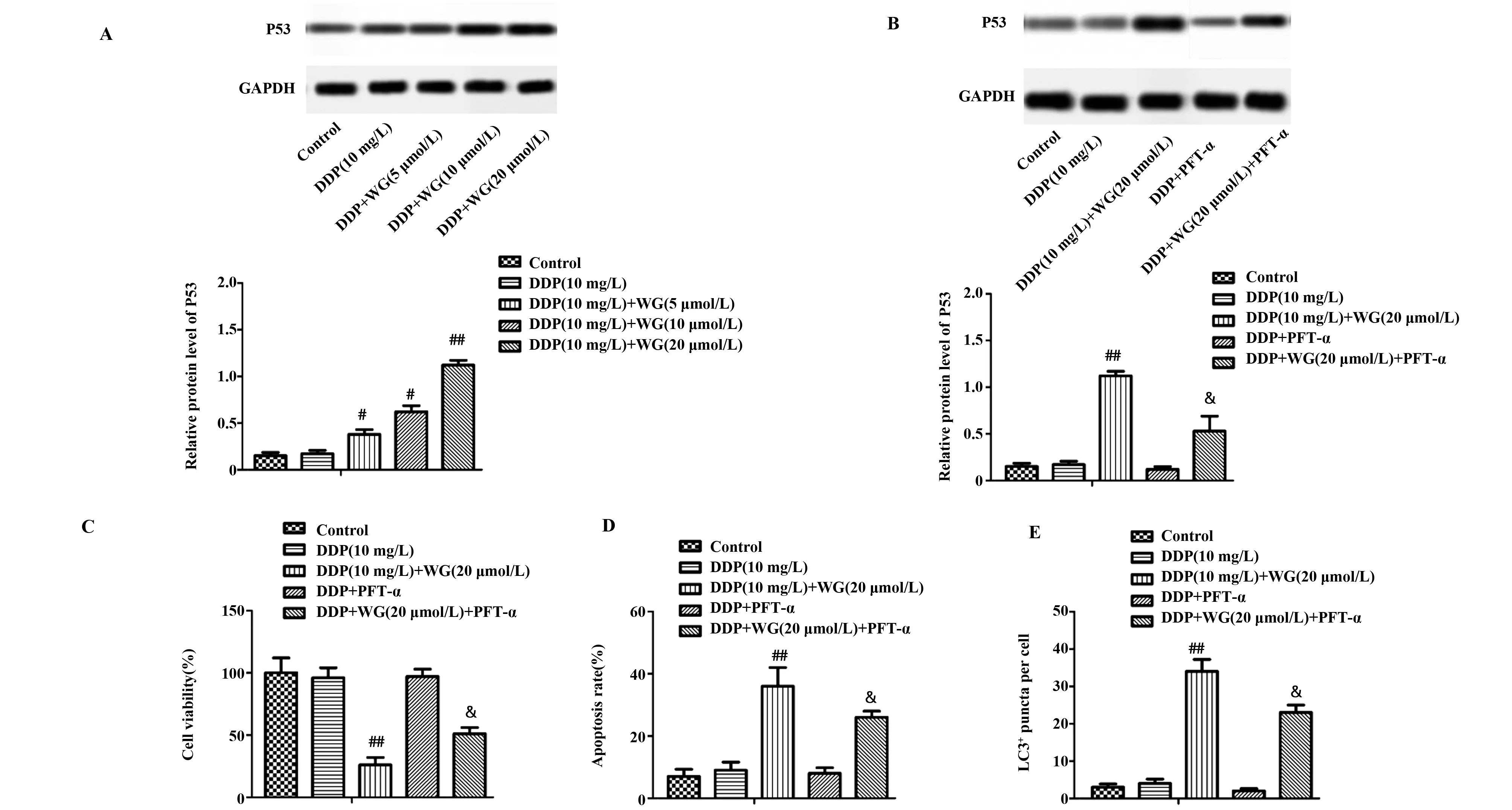
图4 不同浓度汉黄岑素对宫颈癌细胞影响
3 讨论
细胞的增殖和分化受到相关蛋白调控,目前研究较多的调控细胞增殖的蛋白包括:增殖细胞核抗原(PCNA)和增殖细胞周期相关核抗原(Ki67)。Boehm等[6]研究表明PNCA是细胞增殖分化的重要蛋白之一。牛建新等[7]研究表明:PNCA指数越高,细胞的分裂增殖越快,最终会让细胞获得无限增殖的能力并使细胞在形态和结构机能上改变,达到促进细胞增殖的作用。Ki67是一种细胞核内与细胞分裂增殖相关的蛋白抗原,其表达水平反映细胞增殖能力。石小燕等[8]研究表明:Ki67的表达与细胞增殖密切相关,是调节细胞周期的重要组成部分。本研究发现:使用汉黄岑素处理后CC细胞的Ki67、PCNA蛋白表达水平显著降低,且随着汉黄岑素处理浓度的增加Ki67、PCNA蛋白表达水平下降的越显著。说明汉黄岑素可以通过降低细胞增殖相关蛋白水平,达到降低抑制CC细胞的增殖,吴克等[9]研究表明:抑制Ki67、PCNA蛋白表达可以有效抑制CC细胞的增殖,与本研究得出的结论相一致。
抑制CC的发展除了抑制CC细胞的增殖,同时促进其凋亡也是重要的方式之一。细胞凋亡是一种有序或程序性的细胞死亡(programmedcell death,PCD)方式[10],这种程序性死亡是受相关基因调控的细胞主动性死亡过程[11]。其中Caspase是细胞凋亡的核心,Caspase-3、Caspase-9等是Caspase家族的凋亡因子[12]。贾晓鹏等[13]通过前列腺腺癌细胞实验分析得出:Caspase-9基因处于Caspase 家族激活基因的顶端,是Caspase家族中最常见的凋亡启动子,通过自身的裂解使得 proCaspase-3 产生有活性的 Caspase-3。这种有活性的 Caspase-3是执行凋亡的基因,主要作用机理是通过剪切另外的 Caspase 底物引起级联反应,最终导致细胞凋亡。细胞凋亡的调控因子较多,不仅有 Caspase 家族,Bcl-2 家族也是一种常见的凋亡控制基因。Bcl-2 家族中主要是由Bcl-2和Bax这两种蛋白表达量决定细胞是否凋亡[14-16]。Bax和Bcl-2表达呈相反趋势,当Bcl-2表达下降时 Bax 表达上升,此时会促进细胞的凋亡;当Bcl-2 表达升高,而 Bax 表达降低时,则会抑制细胞的凋亡。本实验中可以看出,使用汉黄岑素处理后,CC细胞Bcl-2蛋白表达显著降低(P<0.05),Bax、Caspase-3蛋白表达水平显著升高,说明CC细胞的凋亡受到了促进,这可能是汉黄岑素通过促进促凋亡蛋白的表达,抑制抑凋亡蛋白的表达而实现的。张卫霞等[17]研究表明:通过抑制Bax 表达、促进Bcl-2和Caspase-3的表达可以促进CC细胞的凋亡,与本研究得出的结论相一致。
控制癌细胞的发展除了抑制其增殖促进其凋亡外,调控其自噬(Autophagy)也是重要途径之一。自噬又称为Ⅱ型程序性细胞死亡,是真核细胞为了维持细胞内环境稳定的一种正常生理活动[18]。溶酶体参与的细胞自噬可以被缺氧和化疗药物等抑制,自噬行为可以将细胞内老化或失去功能的长半衰期蛋白和细胞器清除。真核细胞的生命免疫应答、衰老、神经退化和癌症的发生均需要自噬的参与。仇志富等[19]研究表明在自噬复合物中,Beclin-1是核心组成部分,可以对自噬反应的发生进行调节和控制。吴伟等[20]研究表明当小鼠体内缺失了 Beclin-1 杂合之后,就会引发淋巴瘤、肝癌以及自发性肺癌,证明了肿瘤形成可通过自噬反应进行抑制。P53 是一种泛素结合蛋白,这种蛋白与蛋白质的泛素化密切相关。P53可以参与细胞信号转导调控及自噬过程[19]。在自噬过程中,P53 与泛素化的蛋白质结合,再与定位于自噬小体内膜上的 LC3Ⅱ蛋白形成复合物,在自噬溶酶体内降解。细胞出现自噬时,在细胞质中 P53 蛋白不断被降解,自噬活性减弱或者细胞存在自噬功能缺陷时,P53蛋白会在细胞质中不断累积。陈飞等[20]研究表明:P53 是反映自噬活性的标记蛋白之一,P53含量越高细胞内自噬水平较低,其含量间接反映自噬小体清除水平。本研究发现:使用汉黄岑素处理后,CC细胞LC3Ⅱ/LC3Ⅰ、Beclin1水平显著升高,P53显著降低。说明CC细胞内的自噬程度增加。殷雷等[21]研究表明,提高癌细胞的自噬可以提高癌细胞对化疗药物的敏感性,与本研究得出的结论相一致。
综上所述汉黄岑素可以通过调节P53信号通路增强CC细胞的自噬和凋亡,抑制其增殖,实现增强CC对DDP的化疗敏感性,且在一定剂量范围内对汉黄岑素呈剂量依赖性。后续可以进行小鼠体内试验,进一步验证黄岑素通过调节P53信号通路增强CC对DDP的化疗敏感性。
