高温胁迫终止后Bt棉蕾杀虫蛋白的恢复特征及相关生理机制
2020-02-20刘震宇王桂霞李丽楠蔡泽洲梁潘潘吴莘玲陈德华
刘震宇 王桂霞 李丽楠 蔡泽洲 梁潘潘 吴莘玲 张 祥 陈德华
高温胁迫终止后Bt棉蕾杀虫蛋白的恢复特征及相关生理机制
刘震宇 王桂霞 李丽楠 蔡泽洲 梁潘潘 吴莘玲 张 祥 陈德华*
扬州大学江苏省作物遗传生理国家重点实验室培育点 / 粮食作物现代产业技术协同创新中心, 江苏扬州 225009
以大面积生产应用的Bt棉常规种‘泗抗1号’和杂交种‘泗抗3号’为材料, 于扬州大学遗传生理重点实验室人工气候室, 以盆栽方式设计高温胁迫试验。2017年设蕾期38℃高温持续胁迫72 h终止、2018年设38℃高温持续胁迫96 h终止处理后不同时间(0、12、24、48、72和96 h)研究棉蕾Bt杀虫蛋白表达量变化及相关氮代谢生理。结果表明, 盛蕾期38℃持续胁迫72 h、96 h终止后棉蕾Bt杀虫蛋白表达量均能恢复到相应对照水平, 并且恢复所需时间随胁迫持续时间的延长而增加。胁迫72 h终止后, 常规种泗抗1号经72 h、杂交种泗抗3号经48 h蕾的Bt杀虫蛋白表达量与对照已无显著差异; 胁迫96 h终止后, 泗抗1号经96 h、泗抗3号经72 h, 棉蕾Bt杀虫蛋白表达量与对照已无显著差异。相关分析表明, 高温胁迫终止后, 蕾中可溶性蛋白表达量、谷氨酸丙酮酸转氨酶(GPT)活性、谷氨酸草酞乙酸转氨酶(GOT)活性与Bt杀虫蛋白表达量呈极显著正相关 (相关系数分别为0.964**、0.981**、0.971**); 而游离氨基酸含量、蛋白酶和肽酶的活性与Bt杀虫蛋白表达量呈极显著负相关(相关系数分别为-0.894**、-0.912**、-0.834**)。因此, 生产上可根据高温持续时间预测棉蕾Bt杀虫蛋白表达量的恢复程度, 合理防治棉铃虫等相关害虫。
Bt棉; 棉蕾; 高温胁迫; Bt杀虫蛋白; 氮代谢
转基因抗虫棉表达的Bt蛋白, 对棉铃虫等鳞翅目害虫有较好杀虫效果, 减少了化学农药的应用, 降低了植棉成本和对农田生态环境的破坏[1], 具有良好的社会、经济和生态效益。我国自1997年在生产上大面积推广应用Bt转基因抗虫棉以来, 以转基因为主的抗虫棉的种植面积不断扩大[2-3], 已占我国植棉面积的80%以上[4], 但在其生长过程中, Bt抗虫性的表达存在“时空差异”并受极端环境影响。具体表现在不同发育阶段、不同器官或部位抗虫性的明显差异。邢朝柱等[5]研究表明, 同一器官或组织的抗虫性随生育进程呈下降趋势。王永慧等[6-9]研究表明棉花叶片抗虫性较强, 花蕾等生殖器官的抗虫性较弱。环境因子如高温和低温、干旱和渍水也会显著影响抗虫性。Benedict等[10]通过研究Bt棉在美国不同地域棉区的抗虫性表现与Bt蛋白表达量及棉株可溶性蛋白变化, 推测温度、土壤湿度和肥料影响Bt棉的抗虫性表达。Chen等[11]等研究表明, 铃期37℃高温胁迫24 h和48 h会引起棉株叶片中Bt杀虫蛋白表达量显著下降。王俊等[12]研究则表明, 转基因抗虫棉在盛铃期受到高温胁迫后引起铃壳氮代谢生理活性变化。其他研究者也根据Bt棉的抗虫性在棉花生育过程中的表达特性, 推测抗虫性变化除与遗传、生理年龄及氮代谢有关外, 还与环境影响密切相关[13-15]。已有研究表明Bt棉抗虫性受极端环境影响, 但环境影响是阶段性的, 在极端环境胁迫解除后Bt棉抗虫性能否得到恢复或部分恢复则少见报道, Chen等[16]研究了高、低温胁迫终止后叶片Bt蛋白表达量的恢复特征, 但缺乏棉铃虫首选危害的生殖器官抗虫性在温度逆境下恢复特征的研究, 因此进一步研究高温胁迫终止后Bt棉蕾杀虫蛋白表达量的变化, 对于明确其抗虫性恢复情况及安全应用具有重要理论与实践意义。
1 材料与方法
1.1 试验材料与设计
2017—2018年在扬州大学遗传生理实验室人工气候室, 盆栽转基因抗虫棉常规种‘泗抗1号’和杂交种‘泗抗3号’(分别以SK-1和SK-3表示), 盆钵直径35 cm, 高30 cm, 每盆装土20 kg, 2年均于4月6日播种, 5月17日移植至盆中。盆钵用土为自然风干、过筛去杂后的沙质壤土, 用水沉实, 含有机质1.88%、水解氮134.7 mg kg-1、速效磷22.5 mg kg-1和速效钾81.3 mg kg-1。运用营养钵育苗移栽的方式, 定期浇水, 保持盆中土壤含水量接近田间持水量。按当地高产栽培技术进行肥料与化控的运筹, 按单株定量, 等量均分原则施用。棉株长至盛蕾时标记棉株3~5台果枝第一果节现蕾日期, 待标记蕾长至15日龄时移至人工气候室进行高温胁迫试验。2017年以临界高温38℃持续胁迫72 h、2018年在2017年基础上胁迫时间由72 h增加至96 h, 待胁迫终止后, 将棉株移至对照棉株所在人工气候室(温度为27℃), 分别于胁迫终止后的0、12、24、48、72和96 h取棉蕾样, 液氮速冻后放入超低温冰箱保存待测。
1.2 测定项目与方法
1.2.1 Bt杀虫蛋白含量 参见何钟佩所编《农作物化学控制实验指导》[17], 应用酶联免疫法(ELISA)测定, 试剂盒由中国农业大学提供。
1.2.2 可溶性蛋白含量和游离氨基酸含量 分别应用G-250考马斯亮蓝比色法和抗坏血酸茚三酮染色法测定可溶性蛋白含量和游离氨基酸含量[18-19]。
1.2.3 谷氨酸丙酮酸转氨酶(GPT)和谷氨酸草酰乙酸转氨酶(GOT)活性 用赖氏比色法测定[20]。
1.2.4 蛋白酶活性、肽酶活性 分别运用考马斯亮蓝、茚三酮和抗坏血酸比色法测定可溶性蛋白质含量、游离氨基酸含量, 进而计算蛋白酶和肽酶活性[21]。
1.2.5 数据处理与统计分析方法 运用Microsoft Excel等软件统计分析数据, 用SigmaPlot 10.0绘制图表。
2 结果与分析
2.1 临界高温胁迫终止后棉蕾Bt杀虫蛋白表达量的变化
由图1可知, 在盛蕾期临界38℃高温持续胁迫解除后, 随着恢复时间的延长, SK-1和SK-3两个品种棉蕾Bt蛋白表达量都呈上升趋势。SK-1在胁迫72 h终止时, 蕾中Bt杀虫蛋白含量仅为对照的35%, 但胁迫终止后12、24、48、72、96 h, 蕾中Bt杀虫蛋白含量分别为相应对照的41%、52%、75%、100%、100.75%, 即在胁迫终止72 h后, 棉蕾的Bt杀虫蛋白含量与对照已无显著差异; SK-3在持续胁迫72 h终止后0、12、24、48、72、96 h, 棉蕾Bt蛋白表达量分别为相应对照的42%、59%、78%、100%、100%、98%, 说明胁迫解除后48 h, Bt蛋白表达量已恢复至对照水平, 且在胁迫终止后24 h内恢复速率相对较快。由图2可知, SK-1在胁迫96 h终止时, 蕾中Bt蛋白表达量仅为对照的28%, 但胁迫终止后12、24、48、72、96 h, 蕾中Bt杀虫蛋白含量分别为相应对照的33%、42%、61%、85%、102%, 即在胁迫终止96 h后, 棉蕾的Bt杀虫蛋白表达量与对照已无显著差异; SK-3在胁迫96 h终止后0、12、24、48、72、96 h, 棉蕾Bt蛋白表达量分别为对照的30%、40%、59%、86%、101%、101%, 说明至胁迫终止后72 h, Bt蛋白含量与相应对照已无显著差异。

图1 高温持续胁迫72 h终止后棉蕾Bt蛋白表达量变化
不同小写字母表示0.05显著水平下相同品种、相同处理间与对照间的差异。T: 高温胁迫72 h; CK: 对照。
Bt toxin contents at the recovery time with different lowercase letters are significantly different from the control at< 0.05 under the same high temperature duration for the same cultivar. T: reatments for 72 hours; CK: control.
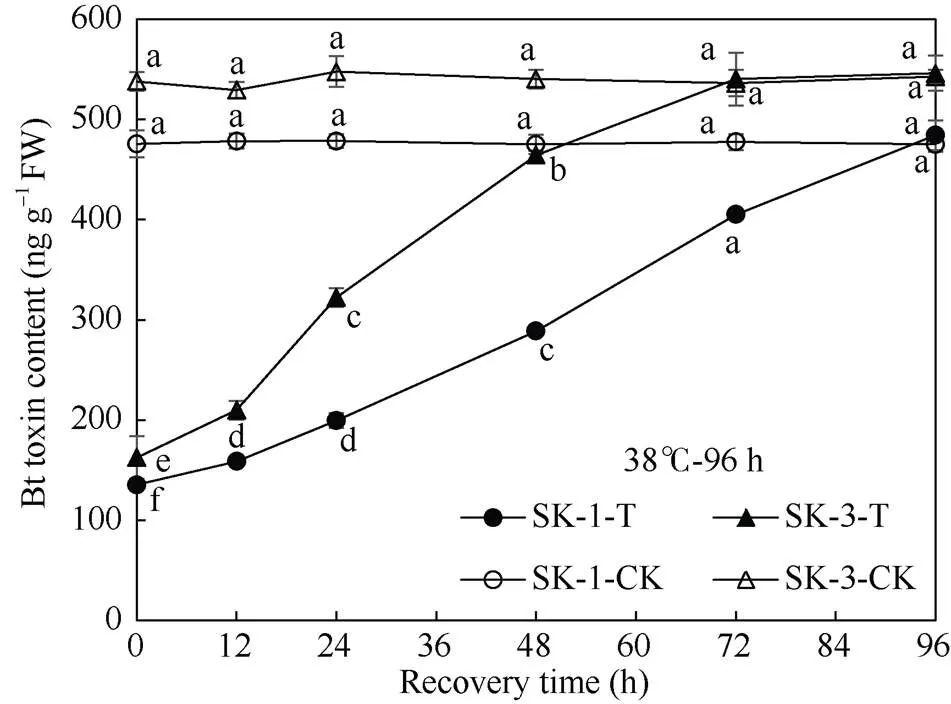
图2 高温持续胁迫96 h终止后棉蕾Bt蛋白表达量变化
不同小写字母表示0.05显著水平下相同品种、相同处理间与对照间的差异。T: 高温胁迫96 h; CK: 对照。
Bt toxin contents at the recovery time with different lowercase letters are significantly different from the control at< 0.05 under the same high temperature duration for the same cultivar. T: treatments for 96 hours; CK: control.
由此可见, 盛蕾期持续高温胁迫终止后, 2个品种棉蕾Bt杀虫蛋白表达量均可恢复至相应的对照水平, 但随高温胁迫时间的延长, 恢复时间相应延长。品种间则以常规种SK-1恢复所需时间长。
2.2 临界高温胁迫终止后Bt棉蕾氮代谢生理特征
2.2.1 可溶性蛋白和游离氨基酸含量的变化 由表1可知, 盛蕾期临界38℃高温分别持续胁迫72 h与96 h终止后, 随恢复时间的延长, 棉蕾中可溶性蛋白含量都呈上升趋势。SK-1在持续胁迫72 h终止后0、12、24、48、72、96 h, 蕾中可溶性蛋白表达量分别为相应对照的47%、50%、63%、84%、102%和101%, 表明在胁迫终止后72 h, 蕾的可溶蛋白含量与对照已无显著差异。SK-3在持续胁迫72 h解除后0、12、24、48、72、96 h, 蕾的可溶性蛋白含量分别为相应对照的52%、61%、75%、98%、100%和100%, 表明胁迫终止后48 h, 蕾的可溶性蛋白含量已与对照无显著差异。SK-1在38℃高温持续胁迫96 h终止后0、12、24、48、72、96 h, 蕾的可溶性蛋白含量分别为相应对照的41%、43%、53%、67%、83%、98%, 表明至胁迫解除后96 h, 蕾的可溶性蛋白含量与相应对照无显著差异; SK-3在38℃持续胁迫96 h终止后0、12、24、48、72、96 h, 蕾的可溶性蛋白含量分别为对照的49%、56%、69%、89%、99%、100%, 表明至胁迫终止后72 h, 蕾的可溶性蛋白含量恢复至相应对照水平。
38℃高温持续胁迫72 h终止后96 h内, 棉蕾中游离氨基酸含量明显下降。SK-1在胁迫72 h终止后0、12、24、48、72、96 h, 棉蕾游离氨基酸含量分别为对照的293%、277%、251%、189%、95%、97%; 而在SK-3中分别为对照的246%、222%、184.95%、103%、101%、100%。表明SK-1在持续胁迫72 h解除后72 h内游离氨基酸含量已基本恢复, SK-3在胁迫解除后48 h内已基本恢复。在38℃持续胁迫96 h终止后0、12、24、48、72、96 h, SK-1蕾游离氨基酸含量分别为对照的382%、369%、342%、274%、198%、101%; 而在SK-3中分别为对照的327%、304%、264%、125%、99%、106%。表明常规种在胁迫终止后96 h, 杂交种在胁迫终止后72 h, 蕾中游离氨基酸含量基本下降到相应对照水平。
可见, 无论常规种还是杂交种, 在胁迫终止后, 蕾中可溶性蛋白表达量与游离氨基酸含量均能恢复到相应对照水平, 恢复时间随着胁迫时长的增加而增加; 品种间表现为杂交种的恢复时间短于常规种。相关分析表明, 蕾中可溶蛋白表达量和Bt杀虫蛋白表达量极显著正相关(= 0.964**), 而蕾游离氨基酸含量和Bt杀虫蛋白表达量极显著负相关(=-0.894**)。表明棉蕾蛋白质合成能力的增强有利于Bt蛋白表达量的恢复。
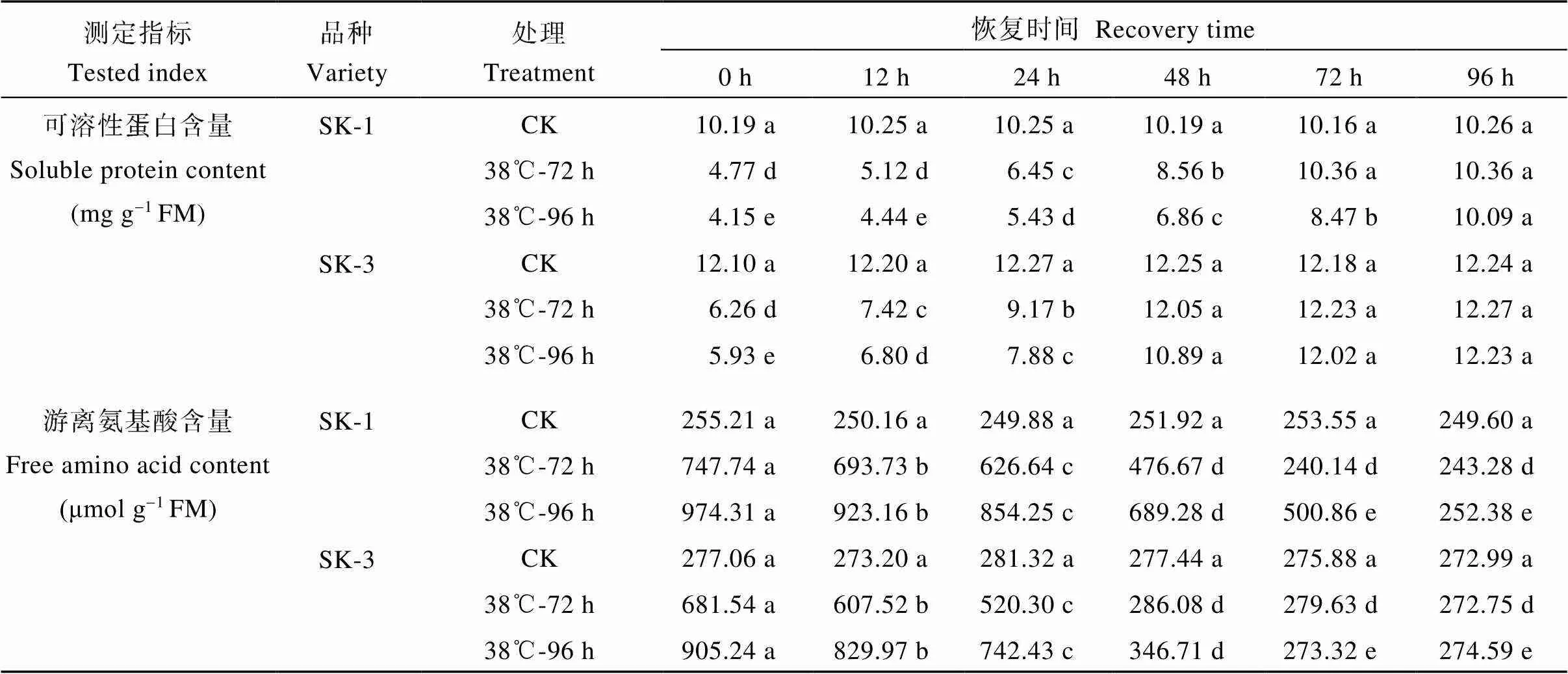
表1 高温持续胁迫终止后蕾中可溶性蛋白与游离氨基酸含量变化
不同小写字母表示0.05显著水平下相同品种、相同处理间与对照间的差异。
Values within a column followed by different lowercase letters are significantly different from the control at< 0.05 under the same high temperature duration for the same cultivar.
2.2.2 GOT、GPT活性的变化 由表2可知, 盛蕾期临界38℃高温持续胁迫终止后一段时间, 棉蕾中GOT、GPT活性都有明显上升。SK-1在持续胁迫72 h终止时, 棉蕾中GOT活性仅为对照的28%, 但胁迫终止后12、24、48、72、96 h, 棉蕾中GOT活性分别为对照的36%、48%、66%、103%、101%, 表明在胁迫终止后72 h, 蕾中GOT活性与对照已无显著差异。SK-3在持续胁迫72 h终止时棉蕾中GOT活性仅为相应对照的41%, 但胁迫终止后12、24、48、72、96 h, 分别为相应对照的56%、77%、104%、102%、104%, 表明在胁迫终止后48 h, 蕾中GOT活性已与相应对照无显著差异。SK-1在持续胁迫96 h终止时, 蕾中GOT活性仅为对照的17%, 但胁迫终止后12、24、48、72、96 h, 分别为对照的22%、31%、50%、76%、109%, 表明在胁迫终止后96 h内, 蕾中GOT活性已恢复到相应对照水平; SK-3在持续胁迫96 h终止时, 蕾中GOT活性仅为对照的28%, 但胁迫终止后12、24、48、72、96 h, 分别为对照的38%、50%、89%、104%、104%, 表明在胁迫终止后72 h内蕾中GOT活性已恢复到相应对照水平。
SK-1在临界高温持续胁迫72 h终止后0、12、24、48、72、96 h, SK-1蕾中GPT活性分别为对照的33%、41%、50%、69%、101%、102%, 表明在胁迫终止后72 h内, 蕾中GPT活性已恢复到相应对照水平; SK-3蕾中GPT活性分别为对照的38%、53%、66%、103%、98%、99%, 表明胁迫终止后48 h, 蕾中GPT活性与相应对照无显著差异。临界高温持续胁迫96 h终止后0、12、24、48、72、96 h, SK-1蕾中GPT活性分别为对照的23%、29%、35%、52%、74%、99%, 表明胁迫终止后96 h, 蕾中GPT活性与相应对照无显著差异; SK-3蕾中GPT活性分别为相应对照的28%、35%、47%、86%、98%、101%, 表明在胁迫终止后72 h内, 蕾中GPT活性已恢复至相应对照水平。
可见, 不论是常规种还是杂交种, 临界高温胁迫终止后, 蕾中GOT、GPT活性均可上升至相应对照水平, 但恢复所需时间随高温胁迫时间的延长而增加。品种间则以常规种恢复较慢。相关分析表明,蕾中GOT、GPT活性均与Bt杀虫蛋白表达量极显著正相关(GOT= 0.971**、GPT= 0.981**), 因此, GOT、GPT活性恢复有利于蛋白质合成, 从而使Bt蛋白表达量相应增加。

表2 高温持续胁迫终止后蕾中GOT与GPT活性变化
不同小写字母表示0.05显著水平下相同品种、相同处理间与对照间的差异。
Values within a column followed by different lowercase letters are significantly different from the control at< 0.05 under the same high temperature duration for the same cultivar.
2.2.3 蛋白酶活性与肽酶活性的变化 由表3可知, 盛蕾期临界38℃高温持续胁迫72 h和96 h终止后, 棉蕾中蛋白酶活性与肽酶活性均下降。其中SK-1在持续高温胁迫72 h终止后0、12、24、48、72、96 h, 蕾中蛋白酶活性分别为对照的363%、336%、287%、216%、101%、101%, 表明在胁迫终止后72 h, 蕾中蛋白酶活性已与对照无显著差异; SK-3蕾蛋白酶活性分别为对照的288%、244%、204%、96%、104%、99%, 在胁迫终止后48 h内, 蕾中蛋白酶活性已恢复至对照水平。38℃高温持续胁迫96 h终止后0 h、12、24、48、72、96 h, SK-1的蕾中蛋白酶活性分别为对照的445%、427%、377%、314%、217%、102%, 表明在胁迫终止后96 h, 蕾中蛋白酶活性与对照无显著差异; SK-3分别为相应对照的356%、300%、258%、153%、108%、103%, 在胁迫终止后72 h内, 蕾中蛋白酶活性已恢复至对照水平。
盛蕾期临界38℃高温持续胁迫终止后0、12、24、48、72、96 h, SK-1蕾中肽酶活性分别为对照的268%、253%、238%、194%、99%、99%, 表明在胁迫解除后72 h内, 蕾中肽酶活性已恢复至相应对照水平; SK-3蕾中肽酶活性分别为对照的195%、172%、143%、96%、101%、99%, 在胁迫终止后48 h内, 蕾中肽酶活性已恢复到对照水平。38℃持续胁迫96 h终止后0、12、24、48、72、96 h, SK-1蕾中肽酶活性分别为对照的318%、306%、289%、248%、196%、102%, 表明在胁迫终止后96 h, 蕾中肽酶活性已恢复到对照水平; SK-3分别为对照的232%、216%、192%、128%、99%、99%, 在胁迫终止后72 h内, 蕾中肽酶活性已与对照无差异。
由此可见, 2个类型品种在临界高温胁迫终止后, 蕾中蛋白酶与肽酶活性均能下降至相应对照水平, 且下降至相应对照水平所需时间均与高温胁迫持续期有关。胁迫时间越长, 这2个酶下降至对照水平的时间也越长。相关分析表明, 蕾蛋白酶、肽酶活性均与Bt杀虫蛋白表达量极显著负相关(蛋白酶=-0.912**、肽酶=-0.834**)。可见, 胁迫终止后蛋白质分解能力的快速下降有利于Bt蛋白表达量的增加。

表3 高温持续胁迫终止后蕾中蛋白酶与肽酶活性变化
不同小写字母表示0.05显著水平下相同品种、相同处理间与对照间的差异。
Values within a column followed by different lowercase letters are significantly different from the control at< 0.05 under the same high temperature duration for the same cultivar.
3 讨论
3.1 高温胁迫持续时间影响胁迫解除后棉蕾Bt蛋白表达量的恢复
对于高温胁迫解除后Bt棉杀虫蛋白的恢复特征, Chen等[16]研究表明, 盛铃期叶片中Bt蛋白表达量在37℃持续胁迫24 h终止后24 h内基本恢复到对照水平; 在持续胁迫48 h条件下, 恢复时间较长, 泗抗1号叶片Bt蛋白表达量在胁迫终止后72 h恢复, 泗抗3号在胁迫终止后48 h恢复到对照水平。本研究进一步表明, 盛蕾期38℃高温胁迫72 h和96 h解除后, 棉蕾中Bt蛋白表达量恢复至对照水平所需时间不同, 胁迫时间越长, 胁迫解除后恢复至对照水平所需时间也越长。由此可见, 高温胁迫期的长短影响Bt棉抗虫性恢复快慢。由于本研究仅设计了72 h和96 h这2个高温持续胁迫时间, 如高温持续时间进一步延长, 棉蕾Bt蛋白表达量的恢复程度及能否恢复至原来水平还有待于进一步研究。此外, 棉花生长在昼夜变温条件下, 高温往往出现在白天, 晚上高温胁迫会得到解除, 因此昼夜变温条件下高温胁迫解除后对棉蕾Bt蛋白表达量恢复特征的影响可能也不一样。因此, 进一步研究昼夜变温条件下高温胁迫后Bt棉生殖器官杀虫蛋白表达量的变化对于明确Bt棉抗虫性变化特征及预防棉铃虫具有重要意义。此外, 高温胁迫解除后棉蕾Bt杀虫蛋白表达量恢复的快慢还与品种类型有关, 常规种恢复较慢, 杂交种恢复较快, 这可能与杂种优势有关。
3.2 高温胁迫解除后, 棉蕾Bt杀虫蛋白表达的恢复快慢同样与其氮代谢有关
大量研究已表明, Bt棉叶片与生殖器官中杀虫蛋白表达量的高低与氮代谢密切相关[22-23], 且高温胁迫解除后叶片中Bt杀虫蛋白表达的恢复也与氮代谢有关[24]。本研究则表明高温胁迫解除后, 随终止后时间的延长, 棉蕾中可溶性蛋白含量逐渐增加, GPT和GOT活性逐渐上升, 相反, 蕾中的游离氨基酸含量逐渐下降, 蛋白酶活性和肽酶活性逐步降低。可见, 蛋白质合成能力的逐步恢复, 分解能力的下降导致Bt蛋白表达量增加。相关分析表明高温胁迫解除后棉蕾可溶性蛋白表达量、GOT和GPT活性与Bt蛋白表达量呈极显著正相关, 与氨基酸含量、蛋白酶和肽酶活性等极显著负相关。
4 结论
在棉花生产遇到高温影响时, 需及时注意高温持续时间及应用的品种类型以便确定棉蕾Bt蛋白的恢复程度和恢复至原有水平所需时间, 从而为Bt棉抗虫性的合理应用与防治提供依据。同时, 高温胁迫解除后蛋白质合成能力的增强、分解能力的下降是棉蕾Bt蛋白表达量得以恢复的主要原因。
[1] 郑志明, 黄磊, 袁连卿, 孙玉德. 转基因抗虫棉的特性及病虫草害综合防治技术. 见: 陈汝涌, 赵永民, 韩吉宝, 李明远主编. 黄河三角洲棉花生产发展论坛论文集. 山东: 中国社会出版社, 2005. pp 231–235. Zheng Z M, Huang L, Yuan L Q, Sun Y D. The characteristics of transgenic insect-resistant cotton and pests integrated control techniques. In: Chen R Y, Zhao Y M, Han J B, Li M Y, eds. Collected Papers of the Forum on Cotton Production and Development in the Yellow River Delt. Shandong: China Society Press, 2005. pp 231–235 (in Chinese).
[2] 郭香墨, 范术丽, 王红梅, 严根土. 我国棉花育种技术的创新与成就. 棉花学报, 2007, 19: 323–330. Guo X M, Fan S L, Wang H M, Yan G T. Achievements of technical innovation about cotton genetics and breeding in China., 2007, 19: 323–330 (in Chinese with English abstract).
[3] 夏敬源, 邹奎, 马志强, 夏文省, 柏长青. 国产转基因抗虫棉技术集成创新与推广应用. 中国棉花, 2006, 33(10): 2–5. Xia J Y, Zou K, Ma Z Q, Xia W X, Bai C Q. Domestic transgenic cotton technology integration innovation and application., 2006, 33(10): 2–5 (in Chinese).
[4] 魏艳丽, 黄玉杰, 李红梅, 孙红星, 杨合同. 棉花转基因技术研究. 山东科学, 2008, 21(3): 38–41. Wei Y L, Huang Y J, Li H M, Sun H X, Yang H T. A survey of cotton transgene technology., 2008, 21(3): 38–41 (in Chinese with English abstract).
[5] 邢朝柱, 靖深蓉, 崔学芬, 郭立平, 王海林, 袁有禄. 转基因棉杀虫蛋白含量时空分布及对棉铃虫产生抗虫的影响. 棉花学报, 2011, 13: 11–15. Xing C Z, Jing S R, Cui X F, Guo L P, Wang H L, Yuan Y L. The spatio-temporal distribution of() insecticidal protein and the effect of transgenic Bt cotton on bollworm resistance., 2001, 13: 11–15 (in Chinese with English abstract).
[6] 温四民, 董合忠, 辛呈松. Bt棉抗虫性差异表达的研究进展. 河南农业科学, 2007, (1): 9–13. Wen S M, Dong H Z, Xin C S. Research progress on the differential expression of insect resistance of Bt cotton., 2007, (1): 9–13 (in Chinese).
[7] 王永慧, 陈建平, 高进, 张祥, 陈源, 陈德华. 盐胁迫对Bt棉棉蕾杀虫蛋白表达的影响. 应用生态学报, 2018, 29: 3017–3023. Wang Y H, Chen J P, Gao J, Zhang X, Chen Y, Chen D H. Effect of soil salinity on insecticidal protein expression in flower buds of Bt cotton., 2018, 29: 3017–3023 (in Chinese with English abstract).
[8] 赵红霞, 王士杰, 朱继杰, 李妙, 王国印. 不同遗传背景转基因抗虫棉Bt蛋白表达与氮代谢关系研究. 棉花学报, 2018, 30: 498–504. Zhao H X, Wang S J, Zhu J J, Li M, Wang G Y. Relationship between Bt protein expression and nitrogen metabolism in insect-resistant transgenic cotton lines with different genetic backgrounds., 2018, 30: 498–504 (in Chinese with English abstract).
[9] 肖海兵, 王鹏军, 李先锋, 董红强, 杨明禄. 转Bt棉主茎叶Cry1Ab/c蛋白含量的时空分布分析. 生物技术通报, 2017, 33(12): 108–111. Xiao H B, Wang P J, Li X F, Dong H Q, Yang M L. Tempo-spatial distribution of Cry1Ab/c protein in the main stem leaves of transgenic Bt cotton., 2017, 33(12): 108–111 (in Chinese with English abstract).
[10] Benedict J H, Altman D W, Deaton W R, Kohel R J, Ring D R, Berberich S A, Sachs E S. Field performance of cottons expressing transgenic CrylA insecticidal proteins for resistance to Helicoverpa., 1996, 89: 230–238.
[11] Chen D H, Ye G Y, Yang C Q, Chen Y, Wu Y K. The effect of high temperature on the insecticidal properties of Bt cotton., 2005, 53: 333–342.
[12] 王俊, Eltayib A, 花明明, 衡丽, 吕春花, 陈德华. 高温胁迫对Bt棉铃壳中Bt蛋白含量及氮代谢的影响. 应用生态学报, 2015, 26: 3202–3206. Wang J, Eltayib A, Hua M M , Heng L, Lyu C H, Chen D H. Effects of high temperature on Bt protein content and nitrogen metabolic physiology in boll wall of Bt cotton., 2015, 10: 3202–3206 (in Chinese with English abstract).
[13] 王淑民. 影响Bt转基因棉花抗虫效果因素. 棉花学报, 1999, 11: 336. Wang S M. Factors affecting the insect resistance of Bt transgenic cotton., 1999, 11: 336 (in Chinese).
[14] Warren G W. Field evaluation of transgenic tobacco containing a Bt insecticial protein gene., 1992, 85: 1651–1659.
[15] Fitt G P, Mares C L, Liewellyn D J. Field evaluation and potential ecologicalimpact of transgenic cottons in Australia., 1994, 4: 535–548.
[16] Chen Y, Wen Y, Chen Y, Zhang X, Wang Y, Chen D. The recovery of Bt toxin content after temperature stress termination in transgenic cotton., 2013, 11: 438–446.
[17] 陈松, 吴敬音, 何小兰, 黄骏麒, 周宝良, 张荣铣. 转基因抗虫棉组织中Bt毒蛋白表达量的ELISA测定. 江苏农业学报, 1997, 13(3): 27–29. Chen S, Wu J Y, He X L, Huang J Q, Zhou B L, Zhang R X. Quantification using ELISA of Bacillus thuringiensis insecticidal protein expressed in the tissue of transgenic insect resistant cotton., 1997, 13(3): 27–29 (in Chinese with English abstract).
[18] 邵金良, 黎其万, 董宝生, 刘宏程, 束继红. 茚三酮比色法测定茶叶中游离氨基酸总量. 中国食品添加剂, 2008, (2): 162–165. Shao J L, Li Q W, Dong B S, Liu H C, Shu J H. Determination of total free-amino acid in tea by Nihydrin colorimetry., 2008, (2): 162–165 (in Chinese with English abstract).
[19] 扬州大学农学院. 作物栽培生理研究法实验讲义. 扬州: 扬州大学出版社, 2007. pp 3–6. Agricultural College, Yangzhou University. Crop Cultivation Physiological Study Lab Handouts. Yangzhou: Yangzhou University Press, 2007. pp 3–6 (in Chinese).
[20] 吴良欢, 蒋式洪, 陶勤南. 植物转氨酶(GOT 和 GPT)活度比色测定方法及其应用. 土壤通报, 1998, 29(3): 41–43. Wu L H, Jiang S H, Tao Q N. Plant aminotransferase (GOT and GPT) determination method and its application of activity colorimetric., 1998, 29(3): 41–43 (in Chinese).
[21] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000. Zou Q. Experimental Guide of Plant Physiology. Beijing: China Agriculture Press, 2000 (in Chinese).
[22] 路献勇, 李淑英, 朱加保, 程福如, 刘方志, 於春. 昼夜不同温度对2种Bt棉苗期叶片杀虫蛋白表达量和棉铃虫死亡率的影响. 中国农学通报, 2015, 31(36): 103–108. Lu X Y, Li S Y, Zhu J B, Chen F R, Liu F Z, Yu C. Effects of alternating temperatures day and night on cotton bollworm mortality and insecticidal protein expression of two kinds of Bt cottons., 2015, 31(36): 103–108 (in Chinese with English abstract).
[23] 陈源, 韩勇, 王俊, 花明明, 顾超, 李国生, 张祥, 陈德华. 高温对Bt棉盛蕾期蕾中Bt蛋白表达及氮代谢生理的影响. 应用生态学报, 2014, 25: 2623–2628. Chen Y, Han Y, Wang J, Hua M M, Gu C, Li G S, Zhang X, Chen D H. Effects of high temperature on Bt proteins expression and nitrogen metabolic physiology in square of Bt cotton at the peak squaring stage., 2014, 25: 2623–2628 (in Chinese with English abstract).
[24] 陈德华, 杨长琴, 陈源, 聂安全, 吴云康. 高温胁迫对Bt棉叶片杀虫蛋白表达量和氮代谢影响的研究. 棉花学报, 2003, 15: 288–292. Chen D H, Yang C Q, Chen Y, Nie A Q, Wu Y K. The effects of the high temperature stress on the leaf Bt protein content and nitrogen metabolism of Bt cotton., 2003, 15: 288–292 (in Chinese with English abstract).
Recovery characteristics of Bt insecticidal protein and relative physiological mechanisms after high temperature stress termination in square of Bt cotton
LIU Zhen-Yu, WANG Gui-Xia, LI Li-Nan, CAI Ze-Zhou, LIANG Pan-Pan, WU Xin-Ling, ZHANG Xiang, and CHEN De-Hua*
Jiangsu Key Laboratory of Crop Genetics and Physiology / Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, Jiangsu, China
The experiments were conducted at Key Laboratory of Genetics and Physiology of Yangzhou University. The conventional cultivar Sikang-1 and hybrid cultivar Sikang-3 were used as the experimental materials. The potted cotton at squaring stage was moved to artificial climatic chamber with 38℃ for 72 h , and 38℃ for 96 h respectively in 2017 and 2018 cotton growth season, and moved to natural conditions, then the squares were collected to measure the Bt protein concentration and nitrogen metabolic physiology at 0, 12, 24, 48, 72, 96 hours respectively after the high temperature termination. The square Bt insecticidal protein contents were able to recover to the corresponding control level, the time for the recovery was in need of longer as the stressed high temperature period increased. In 72 h high temperature treatment, the square Bt insecticidal protein content could recover to the corresponding control level at 72 h for Sikang-1 and at 48 h for Sikang-3. In 96 h high temperature treatment, the square Bt insecticidal protein content could recover to the corresponding control level at 96 h for Sikang-1 and at 72 h for Sikang-3. There were significantly positive correlations of Bt toxin content with soluble protein content, glutamate pyruvate transaminase activity and glutamate oxaloacetate transaminase activity (the correlation coefficients were 0.964**, 0.981**,and 0.971**, respectively), and significantly negative correlations of Bt toxin content with free amino acid contents, and activitied of protease and peptidase (the correlation coefficients were-0.894**,-0.912**, and-0.834**, respectively). Therefore, the recovery degree of Bt insecticidal protein content of cotton square can be predicted according to the duration of high temperature stress, reasonably controllingand related pests in production.
Bt cotton; square; high temperature stress; Bt protein; nitrogen metabolism
2019-05-27;
2019-09-26;
2019-10-14.
10.3724/SP.J.1006.2020.94080
陈德华, E-mail: cdh@yzu.edu.cn, Tel:0514-87979357
E-mail: 1127317278@qq.com
本研究由国家自然科学基金项目(31671613), 国家现代农业产业技术体系棉花岗位专家项目(CARS-18-18)和江苏省高等教育优势学科发展计划(PAPD)资助。
This study was supported by the National Natural Science Foundation of China (31671613), the China Agriculture Research System (Cotton Post Expert Project) (CARS-18-18), and the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20191014.0857.002.html
