超声造影对乳腺癌新辅助化疗疗效的评估及其与乳腺癌不同分子分型的相关性
2020-02-18胡晓芳吴仕吉冷晓玲
胡晓芳, 吴仕吉, 冷晓玲
(1乌鲁木齐市妇幼保健院影像科, 乌鲁木齐 830001; 2新疆喀什地区第一人民医院超声科, 新疆 喀什 844000;3新疆医科大学附属肿瘤医院超声诊断科, 乌鲁木齐 830011)
乳腺癌目前居于我国女性癌症发病率的首位,是常见的恶性肿瘤和主要的因肿瘤死亡病因,并且其发病率有明显上升趋势[1]。通过新辅助化疗(neoadjuvant chemotherapy,NAC)可缩小肿瘤的体积,降低肿瘤的临床分期,使原本无法手术的乳腺癌患者获得手术机会,使原本不可能保乳的患者获得保留乳腺的机会。它同时也可以作为一项重要的体内药敏试验,比体外试验更为精准,减少了手术后化疗的盲目性[2]。虽然NAC给大部分乳腺癌患者带来了福音,但对于一些对化疗药物耐药的患者,有研究表明若不能及时准确地判断NAC对这些患者无效,也有很大可能会拖延其真正有效的治疗时间[3]。因此,在NAC过程中及时准确监测治疗效果是十分必要的。本研究收集了2017年1-12月就诊于新疆医科大学附属肿瘤医院的50例行手术治疗前先进行NAC治疗的乳腺癌患者,均为女性,采用超声造影技术(contrast-enhanced ultrasound, CEUS)评估NAC的疗效,旨在为临床提供一种较为合理的NAC疗效的评估方法。
1 资料与方法
1.1 一般资料收集2017年1-12月就诊于新疆医科大学附属肿瘤医院的乳腺癌患者50例,均为女性,患者年龄27~63岁,平均年龄(46.52±7.60)岁。纳入标准:在开始治疗前已行空心针活检并取得组织病理学结果报告(包括乳腺癌相关的免疫组化指标),临床已确诊为Ⅱb期及Ⅲ期,在进行NAC治疗后行手术治疗并且取得完整的术后病理结果的乳腺癌患者。排除其他部位原发灶的乳腺转移性癌、多灶性癌、双乳癌,以及经辅助检查发现存在远处转移的临床VI期病例。在患者知情同意的前提下,在第一次新辅助化疗治疗前和手术治疗之前均进行超声造影检查。
1.2 仪器与试剂检查设备采用GE公司Logic E9型彩色多普勒超声仪,选用9L-4探头,机械指数设定为0.16。超声造影剂选用声诺维(sono Vue)(瑞士Bracco公司)。
1.3 超声造影在二维灰阶模式下选取病灶显示完整、清晰,血流信号较丰富,包括部分正常腺体组织作对照的切面作为观察切面,于肘静脉团注造影剂后即刻开始记录2 min动态造影过程,直至增强影像消失。收集病灶的定性指标参数,包括肿瘤的增强效果、是否灌注缺损、造影模式和造影剂进入肿瘤顺序。在之后图像分析过程中手动画出病灶中感兴趣区域 (region of interest,ROI),生成时间—强度曲线,收集相关造影定量参数,包括峰值强度(peak intensity,PI)、上升斜率、始增强度、消除斜率(Wash-in slope,WIS)、达峰时间(time to peak,TTP)和曲线下面积(area under the cure,AUC)。
1.4 新辅助化疗疗效评价标准肿瘤大小的评价标准——实体肿瘤反应评价标准(response evaluation criteria in solid tumors,RE-CIST),即RECIST标准[4-5],以病灶长径的变化作为标准,将化疗反应分4类个类别:(1)完全反应(completeresponse,CR):病灶完全消失;(2)部分反应(partial response,PR):原发肿瘤最长径缩小30%以上;(3)静止型病变(stable disease,SD):原发肿瘤的变化介于PR及PD之间;(4)进展型病变(progressive disease,PD):原发病灶长径增加,并超过原本肿瘤长径的20%,或者发现了新的病灶。
新辅助化疗的病理评价标准—使用Miller及Payne(MP)分级系统[6]进行浸润性癌组织的病理评价:l级:数量无变化;2级:数量减少比例≤30%;3级:数量明显减少比例介于30%~90% ;4级:减少比例≥90% ,仅可见少数散在分布的残余肿瘤细胞;5级:所有的病理切片中均未见浸润癌组织残存,部分可见残留的导管内癌成分。其中化疗反应分级为4级和5级的被称为组织学显著反应(MHR),而1~3级被称为组织学非显著反应(NMHR)[7]。
1.5 乳腺癌不同分子分型采用文献[8]标准对乳腺癌进行分子分类:分为Luminal A型[ER阳性/PR阳性,HER-2阴性,Ki-67低表达(<20%)];Luminal B型 [ER阳性或PR阳性,HER-2阴性Ki-67高表达(>20%)或者ER、PR及HER-2均为阳性];HER-2过表达型[ER、PR阴性,HER-2阳性,Ki-67阳性高表达];基底细胞样(basal-like)型[Luminal A和 Luminal B型肿瘤相关基因均为阴性]。
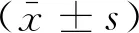
2 结果
本研究共收集了50例女性病例,年龄最大者63岁,最小者27岁,平均年龄为(46.52±7.60)岁。采用Miller及Payne(MP)标准对50例乳腺癌患者的NAC疗效进行评估,将所收集病例分为两组,其中病理反应为MP1—MP3级的为组织学非显著反应组,共30例,MP4—MP5级的为组织学显著反应组,共20例。所收集病例均需完成完整周期(3~6周期)术前化疗,之后进行手术治疗获得完整的病理结果。
2.1 NAC前、后病灶最大径比较NAC前、后二维超声测量病灶最大径分别为(3.30±2.65)、(2.20±1.55) cm,二维超声所测量病灶最大径较NAC之前明显缩小,差异具有统计学意义(t=6.199,P<0.05);NAC前、后CEUS测量病灶最大径分别为(3.70±3.00)、(1.65±1.32) cm,较NAC前明显缩小,差异有统计学意义(t=10.585,P<0.05),详见表1。乳腺癌病灶NAC前、后CEUS增强范围变化的差值为(2.00±1.35)cm,与病理评价标准MP评级间呈正相关(r=0.467,P=0.003)。
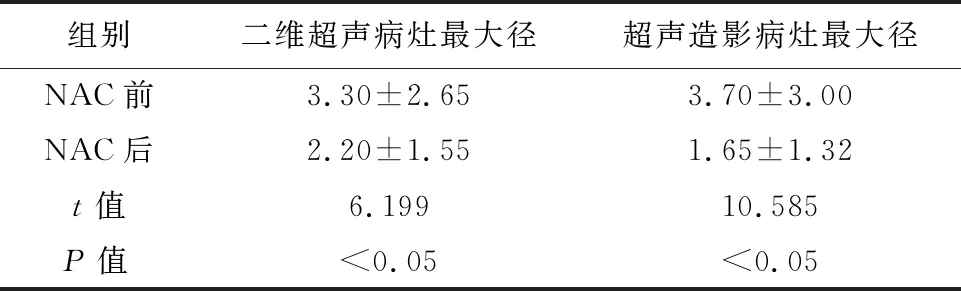
表1 NAC前、后病灶大小比较/cm
2.2 NAC前、后病灶CEUS的定性指标变化新辅助化疗前病灶CEUS的定性指标多数表现为速升缓降高增强、造影剂呈向心性进入肿瘤,而NAC后多数表现出整体性增强、同升同降低增强、无增强或等增强,差异有统计学意义(P<0.05),见表2、3。NAC前、后,NMHR与MHR之间CEUS定性指标中肿瘤增强效果、造影剂进入肿瘤顺序及造影模式的变化差异均具有统计学意义(P<0.05),而灌注缺损的变化差异无统计学意义(P>0.05),见表4。
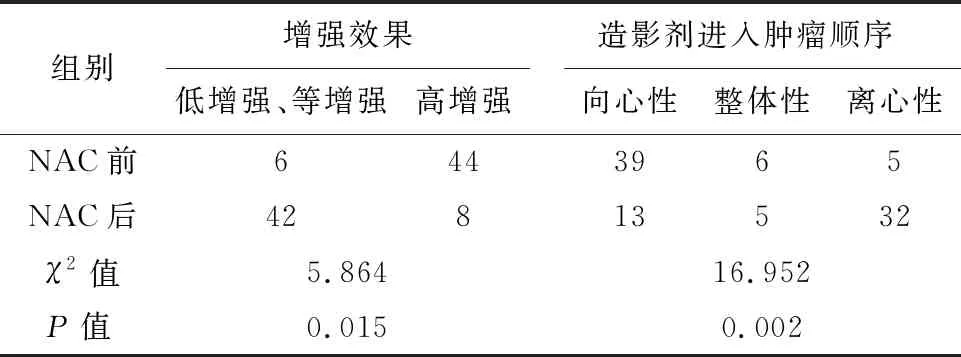
表2 50例乳腺癌患者新辅助化疗前后CEUS定性指标的变化/例
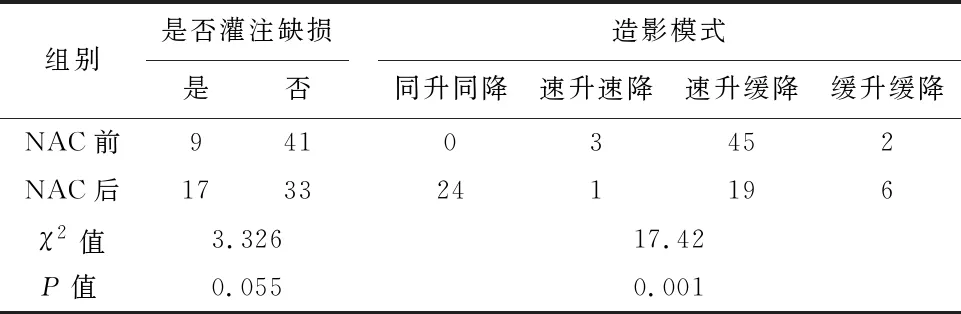
表3 50例乳腺癌患者新辅助化疗前后CEUS定性指标的变化/例
2.3 CEUS的时间—强度曲线定量指标评估NAC的疗效NAC后肿瘤感兴趣区域的峰值强度(PI)、上升斜率较前降低,曲线下面积(AUC)较化疗前减小,差异有统计学意义(P<0.05);而新辅助化疗前、后病灶ROI的消除斜率(WIS)、始增强度和达峰时间的变化差异无统计学意义(P>0.05),见表5。
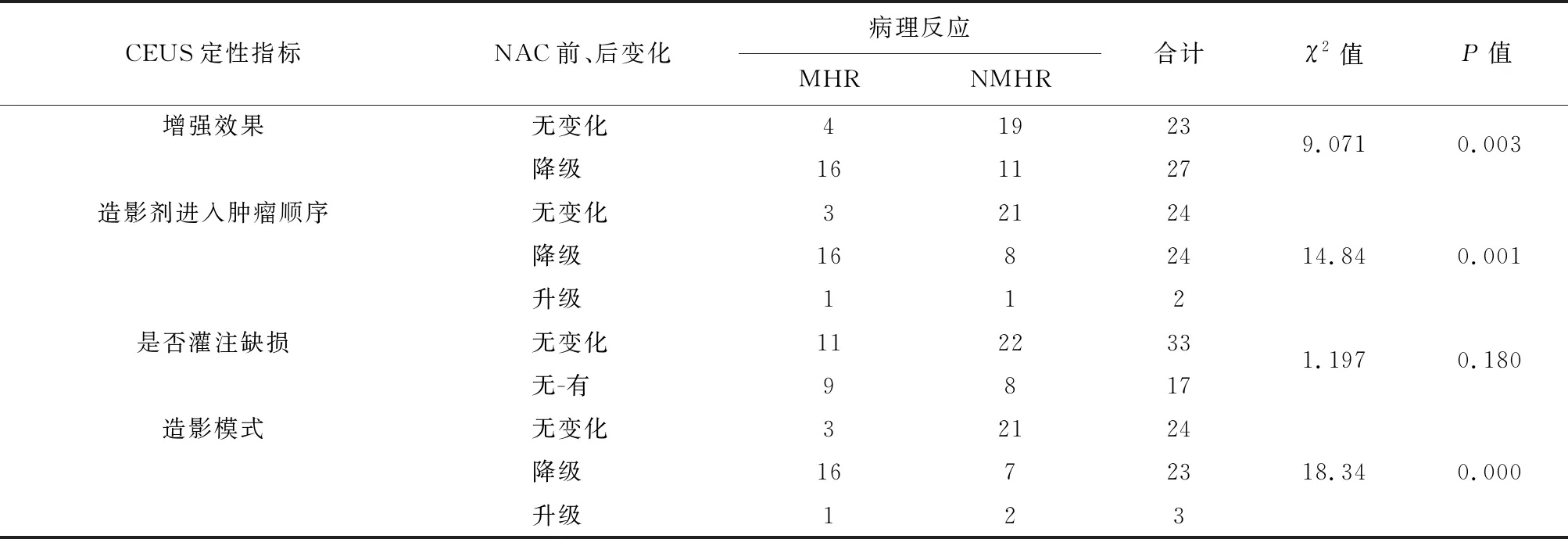
表4 乳腺癌患者NAC前、后CEUS定性指标变化与病理反应间的关系/例
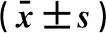
表5 乳腺癌患者NAC前、后CEUS定量指标变化
2.4 CEUS定性指标与乳腺癌不同分子分型之间的相关性列联系数法分析结果表明,CEUS定性指标与乳腺癌不同分子分型之间具有相关性(χ2=5.474,P>0.05),详见表6。单因素方差分析结果表明,乳腺癌不同分子分型间定量指标的差异均无统计学意义(P>0.05)(见表7),表明CEUS的定性及定量指标与乳腺癌不同分子分型之间均不存在相关性。
3 讨论
全球每年新发乳腺癌约有167.1万,并且每年约有52.2万人因乳腺癌而死亡[9-11]。超声造影剂作为纯血池造影剂,能够实时监测肿瘤组织局部的微循环灌注过程,并且因微气泡是无法透过血管壁细胞间隙而进入组织间隙中,所以观察造影剂在肿瘤内的分布能够真实地反映出肿瘤内微血管的分布。同时有研究显示[12],在乳腺癌NAC疗效的评估方面血流灌注的变化较大小的变化更有意义。CEUS可反映病灶的浸润范围及微循环灌注特征,并从定性及定量两个方面来评估NAC疗效。
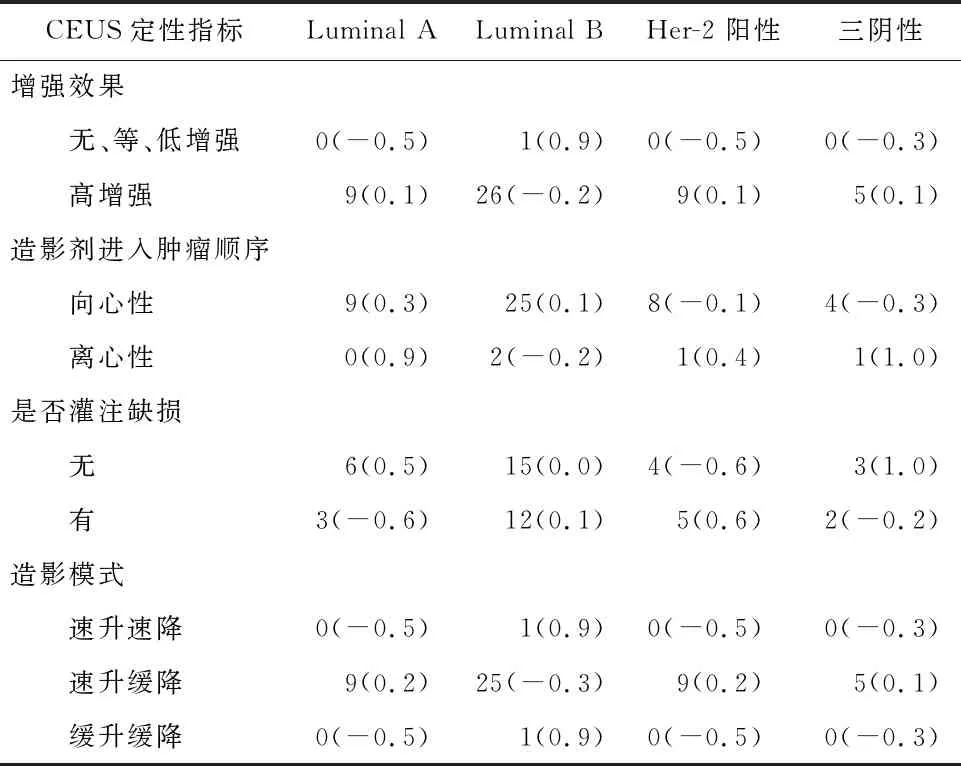
表6 CEUS定性参数与乳腺癌分子分型间的相关性/例
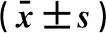
表7 乳腺癌不同分子分型间的定量指标比较
3.1 CEUS测量病灶大小对NAC疗效的评估价值乳腺癌NAC后病理表现为间质纤维组织增生、淋巴细胞及泡沫细胞灶状浸润,此时临床医生可以触到肿块的存在,常规超声也可以探及不规则低回声区,但镜下已无或只有少量肿瘤细胞存在,从而产生临床无效而病理有效的情况。本研究结果显示,NAC治疗后,二维超声和CEUS测量的肿瘤最大径均较NAC前变小,差异具有统计学意义,但其中有12例患者在术后大体标本中仅余灰白残腔,这种情况下,二维超声测量的可能是残腔的大小,所以此时仅根据病灶大小评估NAC疗效误差较大,和张林等[13]的研究结果相同。有研究表明,CEUS测量NAC后乳腺癌原发灶的大小较二维超声更接近病理测量大小[14-16]。但NAC后,病灶的退缩模式并不均呈向心性,部分病灶呈斑片状退缩或仅残余散在、孤立性的卫星灶,此时测量病灶的最大径就较为困难。有研究表明,在恶性肿瘤新生血管生成后,其形态学才随之产生变化,而目前微血管的密度被临床上公认为评估肿瘤血管生成的“金标准”,而CEUS可以通过观察微气泡随血流的灌注,显示肿瘤向周边组织浸润时所形成的不规则的新生血管,同时显示出常规超声观察不到的病灶边缘癌细胞浸润周围正常组织的范围[17-19]。所以CEUS显示肿瘤增强范围反映的是肿瘤微循环血流灌注的范围,优于肿瘤的形态学范围,具有较高的临床应用价值。
3.2 CEUS定性参数对乳腺癌NAC疗效评估价值在本研究中,NAC后,CEUS各定性指标均有不同程度的良性转归,其中病灶增强效果、造影剂进入肿瘤顺序、造影模式可以作为NAC疗效评估的参数,而灌注缺损的变化是否存在评估价值需进一步探讨。
NAC后,乳腺癌灶在病理上表现为病灶内大量血管的萎缩和闭塞,癌组织的正常结构消失,同时可能伴有原位癌的形成[20]。Liu等[21]的研究发现肿瘤CEUS的增强模式与它的病理特征是密切相关的。所以NAC治疗之后,病灶CEUS定性指标的变化可能与药物对肿瘤血管的破坏使造影剂无法顺利进入肿瘤,或者是由于残存的肿瘤细胞的活性降低,肿瘤病灶已完全消失,周围组织血流量减少,病灶内肉芽组织形成等有关。有研究显示,肿瘤内部发生灌注缺损的概率会随肿瘤体积的增大而增加,均因恶性肿瘤的生长较迅速,代谢较旺盛,氧气和营养物质供给相对不能满足其生长需求,病灶局部缺血坏死的发生率升高,因此CEUS显示肿瘤内部的微气泡分布多不均匀,甚至发生灌注缺损[22]。在本研究中,灌注缺损在NAC前、后出现的差异无统计学意义,所以NAC后病灶出现灌注缺损这一指标不能对乳腺癌NAC疗效进行评估。
3.3 CEUS定量参数对乳腺癌NAC疗效评估价值在本研究中,NAC后乳腺癌病灶ROI的峰值强度、上升斜率对乳腺癌NAC治疗评估具有较高价值。有研究表明,CEUS定量指标虽然不能直观反映病灶的形态学特点,但可以从更为客观地反映出病灶CEUS定性参数变化[23]。肿瘤的微血管内微气泡的流量和流速随着时间的变化而发生变化的过程可以由CEUS的时间—强度曲线的形态变化来反映。在本研究中,癌灶的造影模式在NAC前多呈快进慢退,即曲线的上升支斜率较大,曲线较为陡峭,而下降支表现较为平缓。有研究认为超声造影时间—强度曲线表现为“快进”,是因为病灶在早期血流灌注流量大、流速快,在病理上可以解释为肿瘤的新生血管的管壁因缺乏肌层而且管壁较薄,血管走行比较迂曲,故容易生成动静脉瘘,从而导致异常的高速血流出现,而“慢退”表现则是因为恶性肿瘤组织内新生血管的管壁结构不完整,导致恶性肿瘤内部的血管壁通透性增高,静脉血管同时和淋巴管内的癌栓也会导致病灶间质内的水肿,致使很多的微气泡停留于肿瘤的血管床内[20]。在NAC前,肿瘤内的血流灌注量大,血流流速快,所以在时间—强度曲线上表现为峰值强度较高,而在CEUS定性指标上表现为高增强,所以说CEUS定量与定性指标是相对应的,而定量参数是CEUS定性参数数据上的精确反映。
3.4 CEUS参数与乳腺癌不同分子分型间的相关性乳腺癌分子分型这个概念是在2000年由Perou等[24]初次提出,他们依据基因检测结果提出的这个概念,为乳腺癌基因表达谱的深入研究作出很大贡献,为促进肿瘤的针对性治疗也提出了新的发展方向。但由于肿瘤基因表达谱的技术较为复杂,且价格较高,所以目前该技术在乳腺癌临床治疗中应用并不广泛,现在临床上对于乳腺癌分子分型进行分类主要是依据免疫组化结果进行[25]。本研究分别分析了CEUS的定性及定量指标与乳腺癌不同分子分型之间的相关性,结果其相关性不具有统计学意义,这与贾宛儒[26]研究结果一致。但林韵等[27]的研究表明,不同类型乳腺癌具有不同的CEUS参数表现。分析不同研究的结果存在的差异性,可能原因有:(1)结果受不同超声医生的主观因素、判断标准的影响;(2)不同的医院所使用的免疫组化试剂及不同病理科医生的诊断水平不同;(3)本研究收集的样本量较少,存在代表性不足的问题。
综上所述,CEUS增强范围的变化,增强效果、造影剂进入肿瘤的顺序、造影模式的变化、PI、上升斜率和AUC,对于乳腺癌NAC疗效的评估存在较高的临床价值,可以用来监测乳腺癌NAC治疗后的反应,协助临床适时调整NAC治疗方案、选择合适的手术方式与时机。而CEUS参数与乳腺癌不同的分子分型之间不存在相关性,但这个课题值得进一步收集更多、更具有代表性的样本进行深入研究,希望能够在乳腺癌的个体化治疗方面为临床上提供更有价值的信息。
