GRINA基因DNA甲基化水平与冠心病的关联性研究
2020-02-18付真彦马依彤
刘 帅, 李 洋, 韩 敏, 魏 娴, 付真彦, 马依彤
(新疆医科大学1第一临床医学院暨第一附属医院, 2第一附属医院心脏中心, 乌鲁木齐 830054)
心脑血管疾病已成为严重危害人类健康的全球性疾病。心脑血管疾病(尤其是脑卒中和冠心病)的高发病率和高死亡率已成为制约我国社会和经济发展的重要因素。而血脂代谢异常是导致心脑血管疾病的根本原因,50%左右的心脑血管疾病的发生发展均与血脂代谢异常有关[1]。最新研究显示,在人群中,全胆固醇水平在5.2~6.2 mmol/L会使心血管疾病发病率上升三倍[2]。因此研究血脂代谢异常的机制,对其进行早期干预,可以有效降低心脑血管疾病的发病率。
表观遗传学改变是指基因的核苷酸序列不发生改变的情况下,基因表达发生可遗传变化的现象。表观遗传学改变涉及DNA甲基化和组蛋白修饰。DNA甲基化异常主要为基因启动子区发生特异性的甲基化从而影响基因的正常表达[3]。GRINA基因是参与脂质代谢过程的关键基因。但是尚未有研究报道过该基因的DNA甲基化水平是否与冠心病相关。本研究通过检测冠心病病例组和对照组外周血中GRINA基因的DNA甲基化水平表达差异,初步探讨GRINA基因的DNA甲基化与冠心病的关系。
1 资料与方法
1.1 研究对象选择2012-2015年在新疆医科大学第一附属医院心脏中心就诊的35例冠心病患者作为病例组,并从研究人群中随机选取年龄、性别匹配的36例患者作为对照组进行病例对照研究。冠心病定义:患者由2名经验丰富的临床医师完成冠脉造影,结果显示1支以上冠脉血管狭窄≥50%。该研究符合赫尔辛基宣言的标准,所有研究对象均为自愿参加本次研究,并签署知情同意书,本研究承诺对研究对象的个人信息严格保密。
1.2 纳入标准和排除标准纳入标准:选取病历资料齐全患者。排除标准:(1)肾功能不全;(2)瓣膜疾病和心力衰竭;(3)慢性炎症性疾病;(4)急性感染性疾病,例如严重的肺炎、胆囊炎、急性肺结核等;(5)自身免疫性疾病;(6)肿瘤;(7)急性脑出血或脑梗死。
1.3 血样采集及血样处理研究对象禁食过夜后,于清晨抽取静脉血样本进行生化指标检测和甲基化分析。使用市售试剂盒(TIANGEN Biotech,中国北京)从全血中提取基因组DNA,并将稀释的DNA稀释至10 ng /μL浓度进行基因分型。
1.4 目标序列确定选择位于GRINA基因的的近端启动子中的CpG岛进行甲基化分析。选取标准如下:(1)最小长度为200 bp;(2)GC含量为50%或更高;(3)观察/预期的二核苷酸CpG的比率为0.60或更高。最终选取GRINA基因两段序列,31个CpG位点进行检测,引物设计如下:GRINA_1上游序列为:TTGTTGGATTYGTGATTTTGTG,下游序列为:CCCAACRACCCCTAACTCC;GRINA_2上游序列为:CCCCAAATCCCRAAACTAAC,下游序列为:AGATAAGGAATAGTGGAATAGTTGGTTTG。
1.5 DNA甲基化水平检测使用亚硫酸氢盐扩增子测序(BSAS)进行定量甲基化分析。分析的原理是亚硫酸氢钠优先用于将未甲基化的胞嘧啶残基脱氨转化为胸腺嘧啶,而甲基胞嘧啶则保持不变。根据试剂盒说明书,使用EZ DNA MethylationTM-GOLD试剂盒(美国加利福尼亚州ZYMO RESEARCH)对1 μg基因组DNA进行亚硫酸氢盐转化。在目标CpG区域(HotStarTaq聚合酶试剂盒,TAKARA,日本东京)进行PCR扩增并构建文库,将产物在Illumina MiSeq台式测序仪(CA,美国)上进行测序。所有样本的测序平均覆盖率>600倍。测试的CpG位点以它们与转录起始位点(TSS)之间的相对距离(以bp为单位)命名。甲基化胞嘧啶与总测试胞嘧啶的百分比计算为每个CpG位点的甲基化水平。
2 结果
2.1 两组基线资料的比较共计71名研究对象参与了本次研究,平均年龄为(57.48±10.75)岁,其中男性14例(20.0%),糖尿病患者15例(21.1%)。与对照组相比,病例组在年龄、性别、吸烟、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、血糖、糖化血红蛋白和肌酐等指标水平上的差异无统计学意义,均衡可比(P>0.05),见表1。
2.2 两组各基因CpG甲基化位点分析共检测了GRINA基因31个CpG位点,在这些CpG位点中,病例组和对照组在位点36和位点209上差异具有统计学意义(P<0.05),见表2。
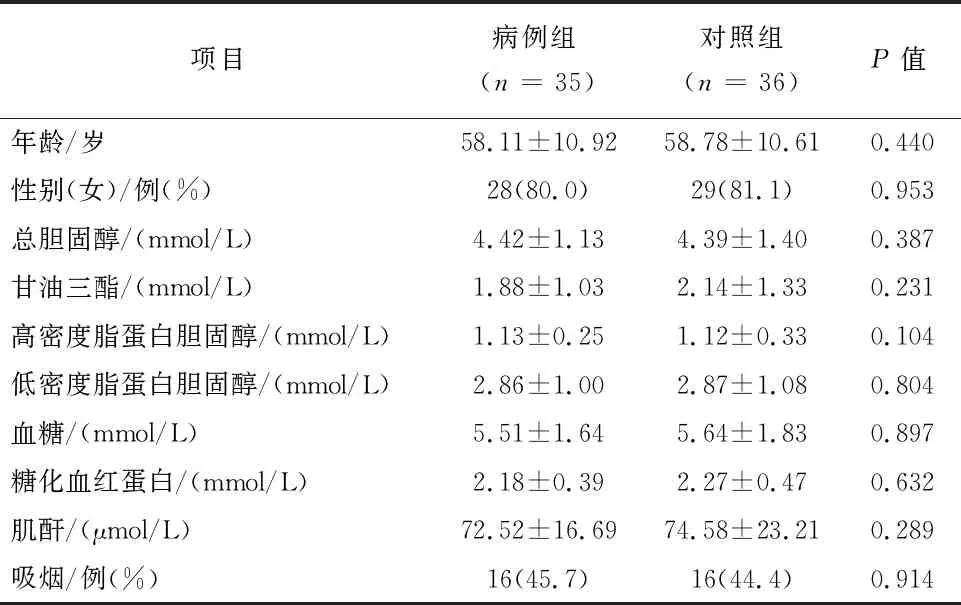
表1 两组基线资料的比较

表2 两组各基因CpG甲基化位点分析
2.3 两组CpG位点甲基化单倍型分析在GRINA的单倍型中, ttttttttttttttttttttttct和ttttttttttttttcttttttttt两种单倍型具有统计学差异(P<0.05),见表3。
2.4 两组GRINA基因DNA甲基化整体水平分析病例组的GRINA基因的整体甲基化表达水平为0.972(0.556-6.084),高于对照组的0.851(0.621-8.956),差异具有统计学意义(P=0.032 3)。

表3 两组CpG位点甲基化单倍型分析
3 讨论
在我国,随着社会经济的发展,生活方式的改变,尤其是人口老龄化及城镇化进程的加速,心脑血管疾病危险因素流行趋势呈明显上升态势,导致心脑血管病的发病人数持续增加。根据《中国心血管病报告2017》的报道,我国患有心血管疾病的患者数量高达2.9亿,其中患有冠心病的患者高达1 100万人[4-5]。虽然经皮冠状动脉介入治疗(PCI)使得患者的死亡率大大降低,但心血管疾病患者的生存质量依旧很低,加重了社会的负担。因此探索心血管疾病的预防与治疗手段是临床研究的重要任务。
为了更深入了解遗传因素对于冠心病的影响,更多的学者开始利用表观遗传学的研究方法进行更深入的研究。DNA甲基化是表观遗传学重要的一种修饰方式。DNA甲基化是一种转录前修饰,其特征在于通过与修饰的核小体蛋白结合,在特定的核苷酸上添加甲基以调节基因表达的稳定性并维持基因组完整性[6]。在体内,DNA甲基化主要发生在二核苷酸序列CpG岛的胞嘧啶残基上[7]。CpG岛在整个基因组中分布不均匀,其中在人体细胞中约80%的CpG岛被甲基化[8]。催化DNA甲基化的酶称为DNA甲基转移酶(DNMTs):DNMT1在细胞分裂期通过向胞嘧啶中添加甲基并生成5-甲基胞嘧啶(5-mC)来维持DNA甲基化状态,而DNMT3a和DNMT3b也是在DNA甲基化过程中不可缺少的酶[6, 9]。靠近转录起始位点的启动子中的CG甲基化通常会抑制基因表达[10]。启动子甲基化以两种方式抑制基因转录:一种是通过物理阻断转录因子与基因启动子的结合,其次是通过结合甲基-CpG结合域蛋白(例如组蛋白)引起染色质紧缩[11]。从生物学上讲,甲基化的CpG岛始终是基因抑制的标志,因为它们充当了甲基结合蛋白的停靠位点。它们可以抑制转录因子与特定基因启动子结合,募集转录抑制因子或阻断活化蛋白结合来影响基因的正常转录[12]。
最近的基因研究和EWAS研究发现很多基因的CpG位点与血脂水平密切相关。有研究发现,DNA甲基化与甘油三酯水平有关,如CPT1A基因的cg00574958,SREBF1的cg11024682,IGFBP5的cg00011856等。有些研究发现DHCR24基因的cg17901584和SQLE的cg00285394的甲基化与低密度脂蛋白胆固醇水平有关[10-12]; CPT1A和SOCS3基因与代谢综合征有关[13],ADAM33基因DNA甲基化水平与哮喘有关[14],但对于与冠心病相关的基因DNA甲基化却鲜有报道。因此,本研究拟通过表观遗传学相关理论,假设GRINA基因启动子区的DNA甲基化可能也在冠心病中发挥调控作用,然后通过比较病例组和对照组下相关基因启动子区DNA甲基化的差异,从而探讨DNA甲基化在冠心病中所起的作用。
本研究结果显示,病例组和对照组GRINA基因DNA甲基化整体水平存在差异,同时GRINA基因两个CpG位点的甲基化表达水平差异也有统计学意义。提示这些基因启动区的CpG位点的DNA甲基化可能在冠心病中发挥着某种作用。本次研究也发现了两组存在差异的CpG位点的DNA甲基化单倍型,提示这些单倍体型可能是这些基因固定的DNA甲基化改变修饰形式,可以对此进行深入研究,并为相关基因靶向治疗提供思路。
已有的研究表明,人类基因组有0.16%左右的SNP位点与其甲基化变化有关[15],而这种因DNA序列未发生改变所致的甲基化改变,可以通过遗传学研究发现。越来越多的研究也表明,有些DNA等位基因或其单体型可能与某些特定的表观遗传学变化有关。因此,在研究疾病的发生、发展过程时,应该进行多方面的考虑,并可以从表观遗传学角度入手,通过基因甲基化、蛋白组学等对其发病机制进行深入研究。
