NRAGE影响人食管癌细胞放射抗性的作用及其机制研究
2020-02-11周欢娣薛晓英韩雪涛田哲森李月红
杨 玉,周欢娣,2,薛晓英,张 歌,韩雪涛,田哲森,李月红
1.河北医科大学第二医院放疗科,河北 石家庄 050000;
2.河北医科大学第二医院中心实验室,河北 石家庄 050000;
3.河北医科大学第二医院病理科,河北 石家庄 050000
食管癌是常见消化道恶性肿瘤,并且是预后较差的消化道恶性肿瘤之一,其术后5年生存率仅为28.5%~57.0%,放疗是其主要治疗手段之一[1-3]。放射抗性作为肿瘤放疗失败的主要原因,同时也是食管癌放射生物学研究的焦点,对其分子机制的研究备受关注。放射抗性涉及凋亡基因的调控、DNA损伤修复能力[4]、乏氧[5-6]、细胞周期状态[4]及多种分子信号通路的改变[7]。
神经营养因子受体相互作用M AGE 类药物(neurotrophin receptor-interacting MAGE homolog,NRAGE)是黑色素瘤相关抗原家族的成员[8]。NRAGE基因最初被认为系抑癌基因在细胞存活、凋亡、细胞周期和分化中发挥重要调节功能[9]。但随着研究的深入,发现NRAGE在黑色素瘤、胃癌、结肠癌等癌组织中过表达,并存在与抑癌基因截然相反的作用[10-11]。
有研究发现,NRAGE在食管癌放射抗拒细胞系TE13R120中表达升高[12],进一步研究提示NRAGE亚细胞定位变化可能参与食管癌细胞放射抗性的形成[12]。本研究在此基础上建立NRAGE基因稳定转染的食管癌细胞系,观察其对细胞放射抗性、细胞周期和凋亡的影响,探讨其参与放射抗性的可能机制。
1 材料和方法
1.1 细胞系及主要试剂
人食管鳞状细胞癌细胞株Eca109为北京大学高献书教授实验室惠赠,质粒为河北医科大学第二医院放疗科实验室保存,脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司(货号:11668027),G418购自美国Sigma公司(货号:11811023),NRAGE(货号:22053-1-AP)和β-catenin(货号:51067-2-AP)多克隆抗体均购自美国Proteintech公司,引物设计由上海捷瑞生物工程有限公司完成,PrimeScriptTMⅡ反转录试剂盒(货号:RR047A)与SYBR PremixEx TaqTM(货号:RR820A)均购自宝日医生物技术(北京)有限公司,Annexin-V/PI凋亡检测试剂盒购自北京索莱宝科技有限公司(货号:CA1020),流式细胞仪购自美国BD公司(型号:FACSCalibur)。
1.2 方法
1.2.1 细胞培养
细胞置于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基中,在37 ℃、CO2体积分数为5%、饱和湿度的培养箱内培养。
1.2.2 稳定转染
①筛选浓度的确定:接种Eca109于6孔板上,5×103个/孔,培养24 h后,按100~1000 μg/mL浓度范围加入G418,继续培养。维持上述G418浓度,正常换液,观察细胞的生长和凋亡情况,两周后使全部细胞死亡的最低浓度即为最佳筛选浓度。② 转染及筛选:参照LipofectamineTM2000说明书,取对数生长期细胞,接种于6孔板上,当细胞长至80%~90%融合时,转染,无血清培养基培养4~6 h换完全培养基。实验分为转染重组质粒组(Eca109/NRAGE组)和对照组(Eca109组)。全培养液继续培养24 h后按1∶6传代,继续培养24 h后换G418的全培养基进行抗性筛选。当有大量细胞死亡时把抗生素浓度减半维持筛选,两周后,Eca109组细胞全部死亡,Eca109/NRAGE组细胞有克隆形成,挑取阳性克隆,扩大培养,以备实验用。③单克隆鉴定:细胞大量扩增后,提取总RNA和总蛋白做实时荧光定量聚合酶链反应(real-time fluorescence quantitive polymerase chain reaction,RTFQ-PCR)与蛋白质印迹法(Western blot)验证稳转效果。
1.2.3 细胞照射条件
辐照设备为电子直线加速器[医科达(上海)医疗器械有限公司],使用6 MV X射线进行照射,剂量率为300 MU/min,机架角为180度,SSD源皮距为100 cm,并在培养瓶下放置1.5 cm组织补偿膜,室温下照射。
1.2.4 RTFQ-PCR检测NRAGE和β-catenin mRNA表达
收集细胞,利用TRIzol试剂提取总RNA,参照反转录试剂盒说明书进行反转录,再按照SYBR Premix Ex TaqTM试剂盒的操作步骤,以GAPDH作为内参。扩增条件为95 ℃预变性5 min,94 ℃变性5 s,56 ℃退火15 s,72 ℃延伸10 s,共40个循环。采用相对定量法比较目的mRNA的表达差异,以2-(Ct目的基因-Ct GAPDH)作为目的基因mRNA相对表达量。
1.2.5 Western blot检测相关蛋白水平
根据试剂盒说明书提取细胞总蛋白,用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,转膜、封闭,加入一抗(NRAGE为1∶100,β-catenin为1∶1000,β-actin为1∶500),4 ℃摇床一抗封闭过夜。辣根过氧化物酶标记的山羊抗兔IgG二抗(1:5000)于37 ℃摇床温育2 h,TBST洗3次,5 min/次,然后洗膜、显影。β-actin为内参。
1.2.6 克隆形成实验测定放射敏感性
取指数生长期细胞,将细胞接种于6孔板上,每孔分别接种50、100、300、500、800、1000个细胞。每组设3个平行组,分别照射0、2、4、6、8和10 Gy。培养10~14 d见克隆形成时终止培养。甲醇固定15 min,结晶紫染液染色30 min,计数集落数,以≥50个细胞的集落作为一个克隆。存活分数(survival fraction,SF)=实验组集落形成率/对照组集落形成率;集落形成率=形成集落数/种植细胞数;以单击多靶模型S=1-(1-e-D/D0)N拟合细胞存活曲线并计算放射生物学参数D0、Dq、N和SF2(照射2 Gy后细胞SF)。
1.2.7 流式细胞术分析细胞周期和凋亡分布的变化
两组细胞分别接受10 Gy剂量的单次照射后继续培养12 h后检测细胞周期及凋亡,收集各组细胞2×106个,用PBS洗涤细胞沉淀后离心去上清,用70%冰乙醇4 ℃固定12 h,弃上清,PBS洗涤,加入PI染液后37 ℃温育后上机分析细胞周期。相同细胞制备方法加入500 μL结合缓冲液悬浮细胞;加入5 μL Annexin-V-FITC混匀,再加入5 μL碘化丙啶混匀,室温避光反应15 min后上机检测细胞凋亡。
1.2.8 细胞划痕实验检测细胞迁移能力
取对数生长期细胞,2×105个/孔接种于6孔板上,培养24 h时(T0)在培养板底部“1”字形划痕,显微镜下观察划痕并拍照记录;继续培养12、24 h,拍照。用Image J软件分析数据并计算细胞迁移率。迁移率=(T0时划痕宽度-各时间点划痕宽度)/T0时划痕宽度×100%。
1.2.9 Transwell侵袭实验检测细胞侵袭能力
收集2×104个对数生长期细胞加入Transwell小室上室,将600 μL含10%胎牛血清培养液加入小室下室,培养24 h,取出小室,用棉签擦去上室内的细胞和Matrigel基质胶。固定后冲洗,显微镜(×100)下观察,计数穿膜细胞数。
1.3 统计学处理
实验结果采用SPSS 21.0统计分析软件进行数据处理,结果以表示,采用t检验及方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 过表达NRAGE基因稳定转染细胞株的构建
RTFQ-PCR和Western blot结果证实Eca109/NRAGE组细胞的NRAGE表达量较其亲本细胞明显增加(P<0.05,图1A、B)。倒置显微镜下观察Eca109和Eca109/NRAGE细胞株,Eca109细胞为圆形或不规则多边形,细胞间边界不清,呈片状生长;而Eca109/NRAGE细胞株则细长呈梭形或纺锤形,细胞极性消失(图1C、D)。
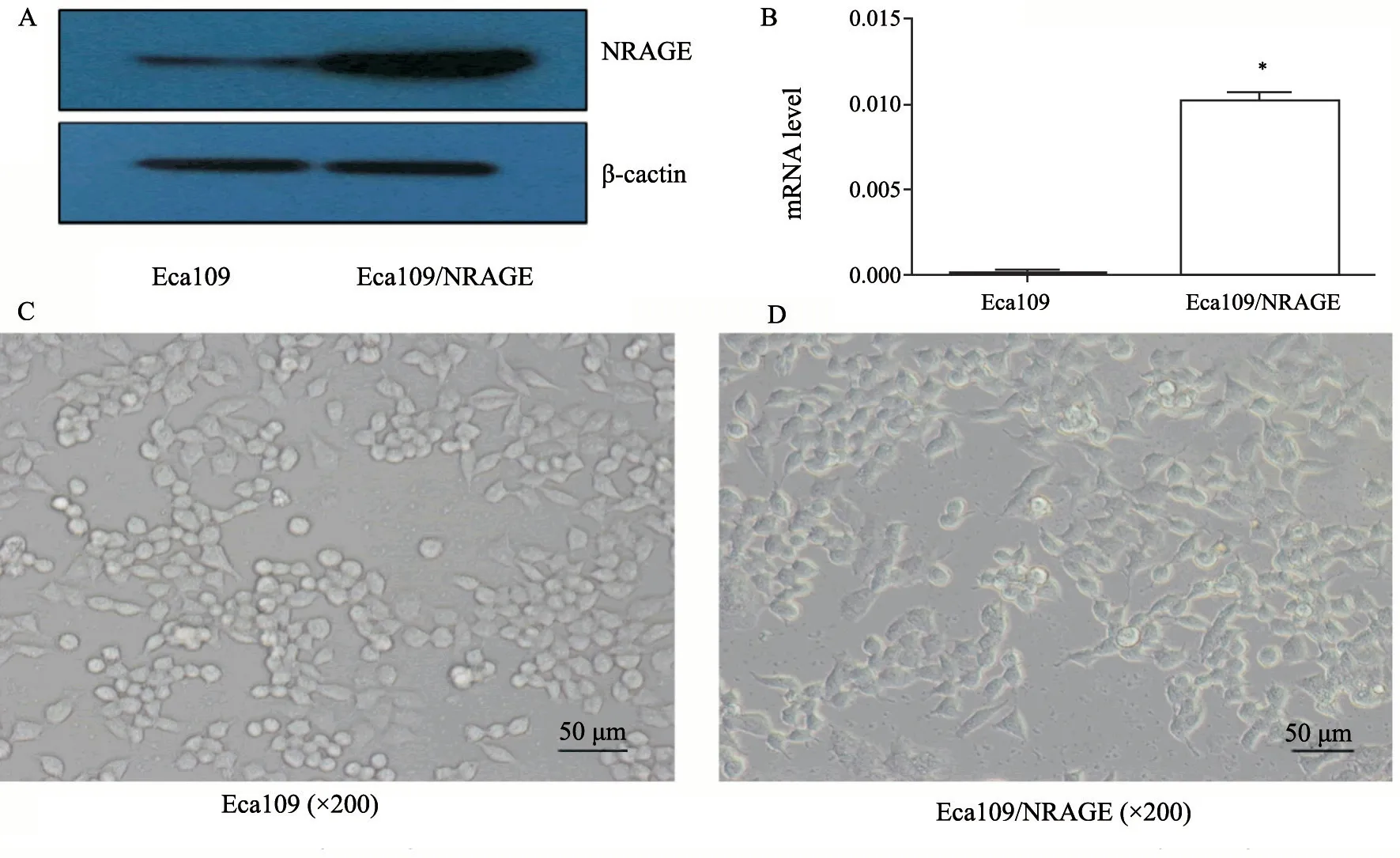
图1 过表达NRAGE基因稳定转染细胞株的构建Fig.1 Construction of stable transfected cell line with overexpression of NRAGE gene
2.2 NRAGE对食管癌细胞放射抗性的影响
Eca109/NRAGE细胞的D0、Dq、N、SF2值均增大,其中Eca109/NRAGE细胞的D0、Dq、SF2值显著高于Eca109细胞,差异有统计学意义(t分别为2.253、2.939、2.351,P<0.05,图2,表1)。

表1 单击多靶模型参数值Tab.1 The parameter values of survive curves fitted with the multi-target model
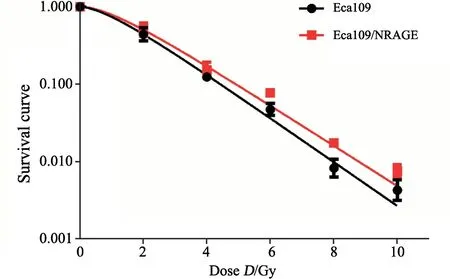
图2 Eca109和Eca109/NRAGE组细胞的放射生存曲线Fig.2 Radiation survival curves of Eca109 and Eca109/NRAGE cells
2.3 NRAGE对细胞周期及凋亡的影响
两组细胞在照射前,Eca109/NRAGE细胞中S期细胞比例显著高于Eca109组(t=2.756,P<0.05),而G2/M期细胞分布低于Eca109组(t=10.5,P<0.05)。10 Gy的X射线照射后两组细胞均出现G2/M 期阻滞,表明细胞在进行自身损伤修复,照射后Eca109相比于Eca109/NRAGE组G0/M期细胞比例显著增加(t=23.78,P<0.05)。两组细胞在照射前,Eca109细胞凋亡率为7.99%±0.71%,Eca109/NRAGE细胞凋亡率为4.16%±0.15%。两组细胞相比,Eca109/NRAGE细胞凋亡率显著降低(t=3.268,P<0.05)。10 Gy的X射线照射后两组细胞凋亡率均增加,Eca109细胞凋亡率为34.63%±2.54%,Eca109/NRAGE细胞凋亡率为24.29%±1.122%。两组细胞相比,Eca109细胞凋亡率增加更显著(t=8.829,P<0.05,图3)。
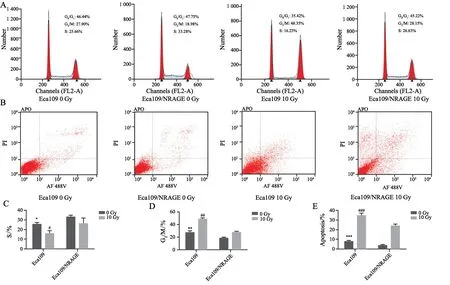
图3 NRAGE对细胞周期及凋亡的影响Fig.3 The influence of NRAGE on cell cycle and cell apoptosis
2.4 NRAGE对细胞迁移和侵袭的影响
采用划痕实验观察NRAGE基因及低剂量照射(5 Gy)对Eca109细胞迁移影响,发现0 Gy照射时Eca109/NRAGE细胞的划痕宽度有所变窄,其细胞迁移能力显著高于Eca109(t=7.729,P<0.05)。
接受5 Gy照射后Eca109、Eca109/NRAGE细胞的迁移能力均降低(t分别为8.017、3.466,P均<0.05),且Eca109/NRAGE细胞迁移率仍高于Eca109(t=12.28,P<0.05)。实验结果见图4,统计结果见表2。对于侵袭能力的检测,0 Gy照射时Eca109/NRAGE细胞侵袭能力显著高于Eca109(t=11.73,P<0.05)。接受5 Gy照射后Eca109、Eca109/NRAGE细胞的侵袭能力均降低(t分别为5.857、8.644,P<0.05),且Eca109/NRAGE培养24 h的细胞穿膜细胞数高于Eca109(t=8.944,P<0.05,图5,表3)。
2.5 Eca109和Eca109/NRAGE细胞中β-catenin表达情况
RTFQ-PCR 和Western blot结果结果显示,β-catenin在Eca109/NRAGE组细胞中的表达量显著高于Eca109组细胞(P<0.05,图6)。

图4 NRAGE对细胞迁移的影响Fig.4 The influence of NRAGE on cell migration
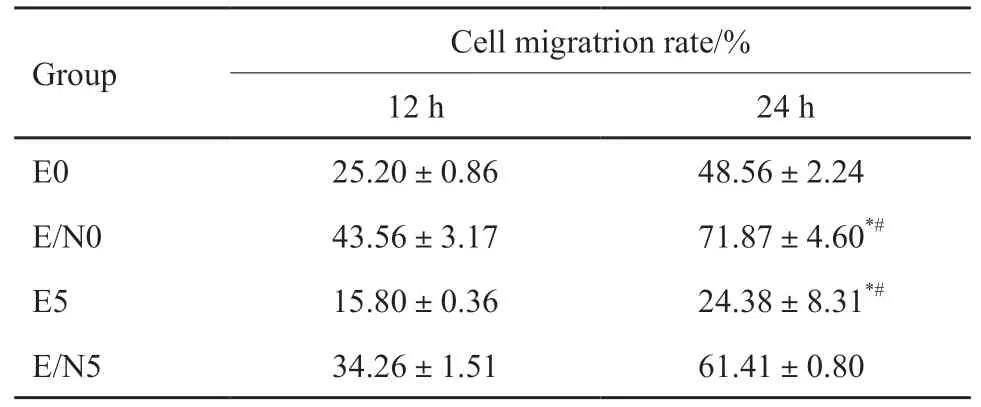
表2 NRAGE对细胞迁移的影响Tab.2 The influence of NRAGE on cell migration
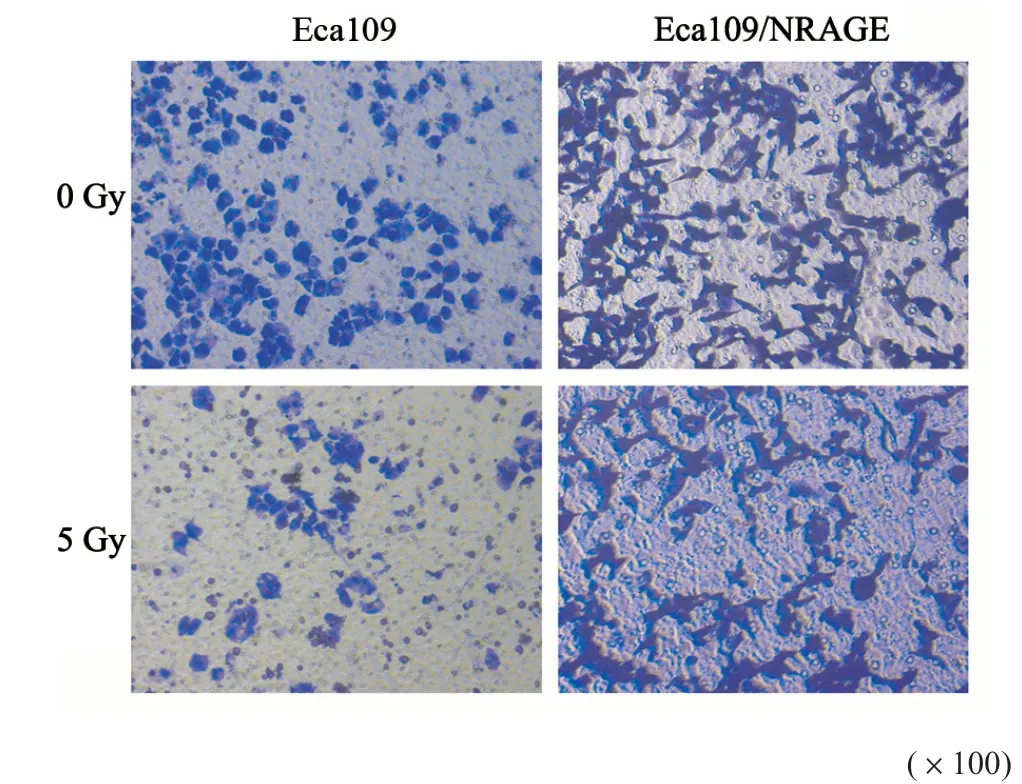
图5 NRAGE对细胞侵袭的影响Fig.5 The influence of NRAGE on cell invasion
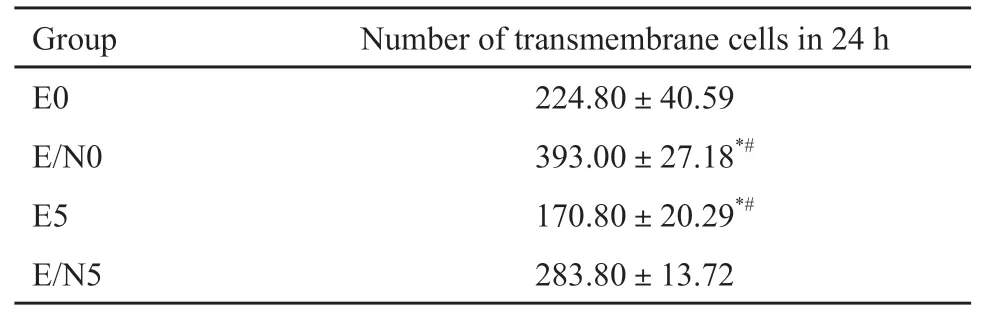
表3 NRAGE对细胞侵袭的影响Tab.3 The influence of NRAGE on cell invasion
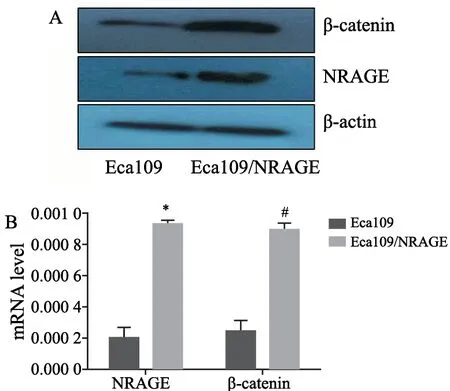
图6 Eca109和Eca109/NRAGE细胞中β-catenin表达Fig.6 The β-catenin expression in Eca109 and Eca109/NRAGE cells
3 讨论
食管癌是常见的上皮组织源性的恶性肿瘤,中国是世界上食管癌发病率和死亡率最高的国家,在中国十大恶性肿瘤死亡率中,食管癌死亡率占第四位[14]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,放疗和手术一样是食管癌主要的根治手段。虽然放射物理学技术不断提高,已经显著提高了食管癌放疗的精度,但食管癌患者5年生存率仍不足20%[15]。治疗失败的主要失败原因为局部复发,进一步研究发现主要与放疗期间肿瘤细胞获得放射抗性有关[16]。随着放射抗性研究的不断深入,从细胞生物学角度探索癌细胞放射抵抗的分子机制,改善肿瘤的放射敏感性,将为提高食管癌局部控制率,改善预后提供帮助,对于制定肿瘤治疗方案起到重要作用。
本课题组前期利用食管鳞癌细胞TE13,经X线反复照射得到了具有放射抗拒性且能够稳定遗传的细胞株TE13R120。通过基因芯片分析发现,在食管癌放射抗性细胞TE13R120中,NRAGE表达显著升高,且实验证实,NRAGE表达量在两种细胞中随照射后时间的延长和照射剂量的增加而升高[12],提示该基因可能参与放射抗性的形成。后续在探索可能的作用机制时发现,NRAGE亚细胞定位变化可能参与食管癌细胞放射抗性的形成[13,17-18]。
本实验通过基因转染的方法构建了稳定转染NRAGE基因的食管癌细胞Eca109/NRAGE,经克隆形成实验检测转染后的Eca109/NRAGE细胞具有明显的放射抗拒性,进一步证实NRAGE参与了介导食管癌放射抗性的形成。至此,NRAGE影响放射抗性的关系得到确定。
另外,我们检测了两组细胞在放射前后细胞周期和细胞凋亡的变化。结果显示,与Eca109细胞相比,Eca109/NRAGE细胞对射线抵抗性最强的S期细胞比例增加而对射线最敏感的G2/M期减少;X射线照射后,Eca109细胞G2/M期细胞分布的增加较过表达细胞更为显著,证实NRAGE高表达与食管癌细胞放射抗性密切相关。该结果也表明该基因可能通过影响细胞周期分布,进而参与细胞放射抗性形成。Yang等[9]在对食管癌细胞研究中发现,敲低NRAGE基因可引起细胞周期的改变,出现G2/M期阻滞现象,且S期细胞明显减少,与本研究结果一致。与Eca109组细胞相比,Eca109/NRAGE细胞凋亡率明显降低,X射线照射后两组细胞凋亡率均增加,但Eca109细胞凋亡率的增加更为显著(P<0.05),表明该基因抑制细胞凋亡,进而参与细胞放射抗性形成。Kumar等[11]研究发现,NRAGE在肺癌、乳腺癌等肿瘤中发挥抑制细胞凋亡的作用,本研究结果与上述报道一致。
细胞划痕实验和Transwell实验结果显示,NRAGE的过表达可以增强细胞的迁移和侵袭能力,Jiang[20]等对胃癌细胞的研究发现,敲低NRAGE基因表达可以抑制细胞的侵袭能力。
经典Wnt通路与肿瘤放射抗性形成密切相关,成为近年来的研究热点。Chu等[20]研究发现,在PANC-1细胞中敲低NRAGE基因可以使β-catenin与上皮标志物E-cadherin表达降低,进而抑制胰腺癌和恶性黑色素瘤细胞侵袭转移能力。因此本研究检测在食管癌细胞中NRAGE是否通过激活β-catenin发挥功能。本研究结果显示,β-catenin在Eca109/NRAGE组细胞的表达量较其亲本细胞明显增高。初步证实在Eca109/NRAGE组细胞中高表达的NRAGE可能通过参与Wnt/β-catenin信号通路而参与放射抗性的形成。
综上所述,本研究成功建立了稳定表达NRAGE的食管癌细胞系,并初步观察外源性NRAGE对细胞体外放射抗性的影响,并对其放射抵抗机制进行初步探索,希望为今后利用NRAGE基因治疗食管癌的研究提供细胞模型及实验依据,为提高放疗敏感性寻找新的靶点。
