脂联素通过AMPK/mTOR/4EBP1通路对子宫内膜癌细胞迁移及侵袭的影响
2020-02-11隆曜先王毛毛蔡志福张洁清
隆曜先,王毛毛,蔡志福,张洁清,李 力
广西医科大学附属肿瘤医院妇科,广西 南宁 530021
脂联素(adiponectin,APN)是一种内源性生物活性多肽或蛋白质,由脂肪细胞分泌,并大量存在于血液循环中[1-2]。有研究发现,APN对胰岛素有增敏作用[3-4],并与子宫内膜癌细胞的发生、发展呈负相关[5-6]。然而,APN影响子宫内膜癌的机制尚未明确。本研究通过探讨APN对HEC-1B细胞腺苷酸活化蛋白激酶(AMPactivated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/磷酸化真核启动因子4E结合蛋白1(4E binding protein 1,4EBP1)信号通路的影响,检测B细胞淋巴瘤-2(B-cell lymphoma 2,Bcl-2)与基质金属蛋白酶9(matrix metallopeptidase 9,MMP-9)mRNA及蛋白的表达,以及APN对HEC-1B细胞侵袭能力的影响,为子宫内膜癌的诊治提供新思路。
1 材料和方法
1.1 主要试剂及细胞株
人子宫内膜癌细胞株HEC-1B(雌激素受体弱阳性)购自北京大学。重组人APN购自捷克Biovendor公司;反转录检测试剂盒购自美国Fermentas公司;实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)技术检测试剂盒购自日本TaKaRa公司;复合物C(AMPK抑制剂)购自德国Calbiochem公司;兔抗人AMPK和磷酸化AMPK(phosphorylate-AMPK,p-AMPK)单克隆抗体、兔抗人mTOR和磷酸化mTOR(phosphorylate-mTOR,p-mTOR)多克隆抗体、兔抗人4EBP1和磷酸化4EBP1(phosphorylate-4EBP1,p-4EBP1)单克隆抗体、兔抗人磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Cell Signaling公司。
1.2 细胞培养及分组
将HEC-1B细胞加入含10%胎牛血清的DMEM完全培养基中并置于37℃、CO2体积分数为5%的培养箱中培育及传代,取对数生长期细胞进行后续实验。相关文献[7-8]及本实验前期研究[9]发现,20 μg/mL APN作用30 min是最佳浓度与时间,因此后续实验皆以该数据进行实验。实验分为4组:
①对照组:仅加入无血清DMEM培养基;② APN组:20 μg/mL APN作用于细胞30 min;③抑制剂组:10 μmol/L复合物C作用于细胞30 min;④ APN+抑制剂组:10 μmol/L复合物C预处理细胞30 min后,加入20 μg/mL APN作用30 min。
1.3 RTFQ-PCR检测细胞Bcl-2、MMP-9 mRNA的表达
用TRIzol试剂提取各组细胞总RNA,反转录合成cDNA,进行RTFQ-PCR检测。根据引物设计原则设计引物序列。Bcl-2上游引物为:5’-TTGGATCAGGGAGTTGGAAG-3’,下游引物为:5’-TGTCCCTACCAACCAGAA GG-3’,扩增长度片段为295 bp;MMP-9上游引物为:5’-ACGCACGACGTCTTCCAGTA-3’,下游引物为:5’-CCACCTGGTTCAACTCACTC C-3’,扩增长度片段为94 bp;内参GAPDH上游引物为:5’-GAAGGTGAAGGTCGGAG TC-3’,下游引物为:5’-GAAGATGGTGATG GGATTTC-3’,扩增长度片段为246 bp。PCR反应体系:DNA荧光染料SYB-R Green 10 μL,上、下游引物各0.8 μL,反转录产物2 μL,ddH2O 6.4 μL,总体积20 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火延伸30 s,循环40次。实验重复3次。
1.4 蛋白质印迹法(Western blot)检测蛋白水平
用含有苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)的蛋白裂解液于冰上裂解收集各组细胞蛋白,并用二喹啉甲酸(bicinchoninic acid,BCA)法测定每个蛋白样品的蛋白浓度。采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离100 μg蛋白,将电泳产物转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。5%牛血清白蛋白(bovine serum albumin,BSA)封闭PVDF膜1 h,分别加入一抗AMPK、p-AMPK、mTOR、p-mTOR、4EBP1、p-4EBP1、Bcl-2、MMP-9(浓度均为1∶1000),4 ℃摇床温育过夜。第2天取出PVDF膜置于含有辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔二抗的离心管中,室温温育1.5 h。含0.05%吐温20的洗膜缓冲液(Tris Buffered Saline Tween,TBST)洗膜3次,每次10 min,ECL化学发光扫膜并分析数据。使用Image-Lab软件分析灰度值数据,以GAPDH作为内参照,AMPK蛋白活化水平以p-AMPK/AMPK比值表示,mTOR活化水平以pmTOR/mTOR比值表示,4EBP1活化水平以p-4EBP1/4EBP1比值表示。实验重复3次。
1.5 细胞体外穿膜实验检测细胞迁移能力
无血清培养基重悬各组细胞使细胞密度为105/mL,100 μL细胞悬液接种于Transwell小室上室每孔中;下室每孔加入600 μL 20%胎牛血清培养基,在37 ℃、CO2体积分数为5%的培养箱中培养24 h。将小室放入4%多聚甲醛中,使小室滤膜底面充分浸泡在其中,固定30 min。吉姆萨染色后在200倍显微镜下观察,随机取5个视野拍照。计算5个视野迁移细胞数的平均值。实验重复3次。
1.6 划痕实验检测细胞侵袭能力
将子宫内膜癌细胞接种于6孔板中,待细胞达到80%~90%融合时,吸掉培养基并用PBS冲洗细胞3次,用10 μL移液器吸嘴沿着培养板中央划一横线,加入无血清DMEM培养基,于恒温箱内继续培养过夜,分别在0、24 h时于倒置显微下观察细胞运动情况并拍照记录。计算划痕面积并计算迁移率,公式:细胞迁移率(%)=[(划痕时面积-24 h后面积)/划痕时面积]×100%。
1.7 统计学处理
采用SPSS 20.0软件进行统计学处理。所有实验数据均以表示,多组资料比较用单因素方差分析,多组资料的组间比较采用最小显著性差异法(least significant difference,LSD)分析。两组资料比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 APN及AMPK抑制剂作用后各组细胞中Bcl-2、MMP-9 mRNA表达及蛋白水平
RTFQ-PCR检测结果显示,APN组中,HEC-1B细胞Bcl-2和MMP-9 mRNA的表达分别为0.64±0.08和0.68±0.02,与对照组(1.00±0.00)相比均明显降低,差异均有统计学意义(P=0.002,P=0.001);APN+抑制剂组Bcl-2和MMP-9 mRNA的表达分别为0.98±0.11和0.96±0.08,与APN组相比较,均明显升高,差异均有统计学意义(P=0.02,P=0.03,图1A)。
APN组中,HEC-1B细胞Bcl-2和MMP-9蛋白水平分别与对照组、抑制剂组、APN+抑制剂组比较,差异均有统计学意义(P=0.00,图1B)。
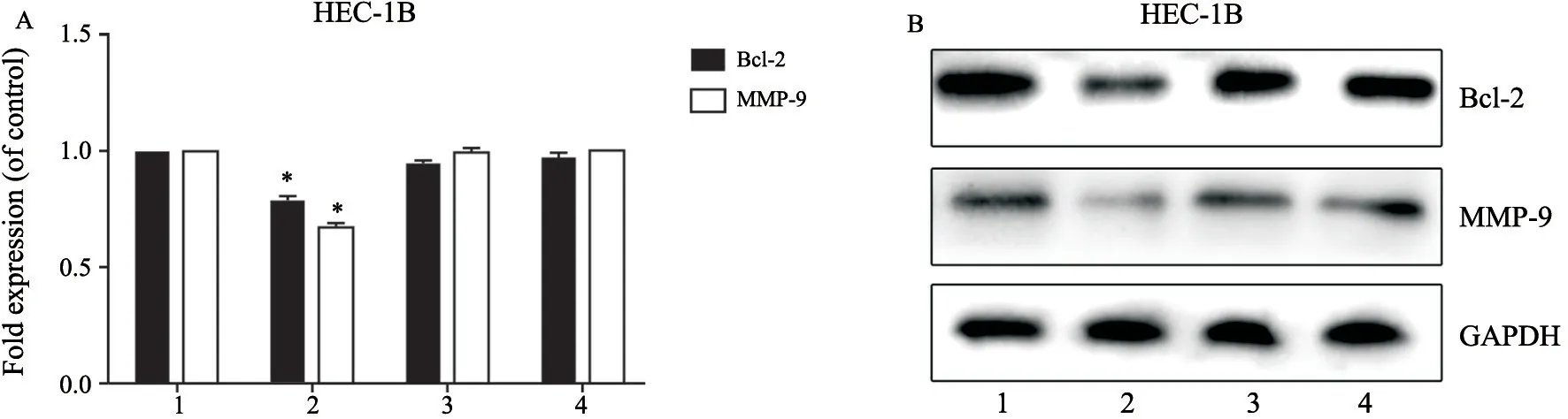
图1 APN及AMPK抑制剂作用后HEC-1B细胞中Bcl-2、MMP-9 mRNA及蛋白的表达Fig.1 Expression levels of Bcl-2 and MMP-9 mRNA and proteins in HEC-1B cells after treatment with APN and AMPK inhibitors
2.2 APN及AMPK抑制剂作用于细胞后AMPK、mTOR和4EBP1的活化情况
Western blot检测结果显示,20 μg/mL APN作用HEC-1B细胞30 min后可明显诱导细胞AMPK磷酸化,但抑制mTOR、4EBP1蛋白活化水平(P=0.00),复合物C可明显抑制APN的这种诱导和抑制作用(P=0.05,表1,图2)。
2.3 APN对细胞迁移能力的影响
体外穿膜实验结果显示,APN组穿膜细胞数为(78.72±10.74)个,APN+抑制剂组为(131.45±9.11)个,对照组为(131.91±12.29)个,抑制剂组为(131.56±3.47)个,APN组与对照组比较,差异有统计学意义(P=0.00),APN+抑制剂组与对照组相比,差异无统计学意义(P=0.12,图3)。
2.4 APN对细胞侵袭能力的影响
细胞划痕实验结果显示,24 h后APN组划痕宽度变化不大,其迁移率为(19.27±1.14)%,较其余3组差异有统计学意义(P=0.00)。对照组(66.51±0.60)%、抑制剂组(70.05±0.10)%、APN+抑制剂组(69.18±0.92)%的划痕宽度在24 h后明显缩窄,3组组间迁移率差异无统计学意义(F=2.787,P=0.39,图4)。
表1 APN及其抑制剂作用后HEC-1B细胞中AMPK、mTOR和4EBP1蛋白活化水平的比较Tab.1 Comparison of activation levels of AMPK,mTOR and 4EBP1 proteins of HEC-1B cells after treatment with APN and its inhibitors()
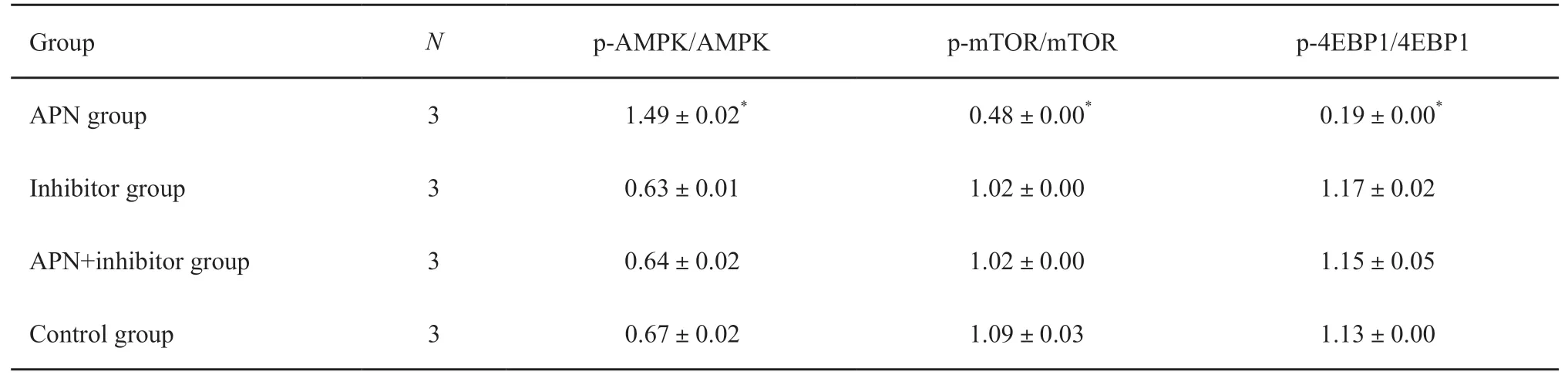
表1 APN及其抑制剂作用后HEC-1B细胞中AMPK、mTOR和4EBP1蛋白活化水平的比较Tab.1 Comparison of activation levels of AMPK,mTOR and 4EBP1 proteins of HEC-1B cells after treatment with APN and its inhibitors()
*:P<0.05,compared with another three groups
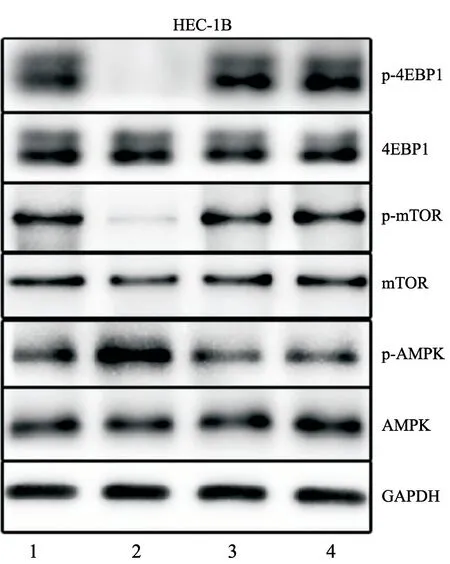
图2 APN及AMPK抑制剂作用后AMPK、mTOR和4EBP1 Western blot电泳图Fig.2 Electrophoretogram of Western blot of AMPK,mTOR and 4EBP1 after treatment with APN and AMPK inhibitors
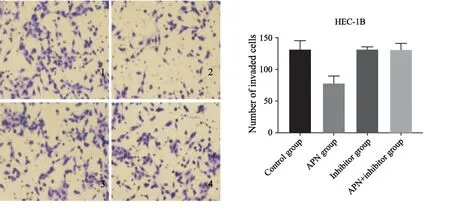
图3 体外穿膜实验检测4组HEC-1B细胞的迁移能力Fig.3 HEC-1B cell migration in four groups detected by transwell cell assay
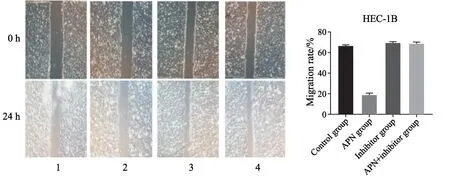
图4 细胞划痕实验检测HEC-1B细胞的侵袭能力Fig.4 Cell scratch test to detect the invasive ability of HEC-1B cells
3 讨论
APN是一种在脂肪组织中特异性表达的激素,其主要是通过与细胞表面的APN受体结合在体内发挥作用[10]。近年来,APN被认为是一种强有力的抑制肿瘤细胞生长的抗癌因子[11]。有研究显示,APN与多种恶性肿瘤关系密切,与其发病率呈反比,包括结直肠癌、胃癌、乳腺癌、前列腺癌、白血病、卵巢癌及子宫内膜癌。子宫内膜癌是常见的妇科恶性肿瘤之一,其患病率在中国女性生殖系统恶性肿瘤中已跃居第二位,仅次于宫颈癌。对子宫内膜癌的发病因素及其治疗的研究一直是国内外研究的热点。Yamauchi等[10]研究发现,在高级别子宫内膜癌组织中,APN受体相应的减少,表明APN与子宫内膜癌的发生、发展有关。也有学者[12-13]提出,APN、瘦素等细胞因子可能通过AMPK/mTOR信号通路抑制组织蛋白合成和细胞生长。因此,认为APN可能对子宫内膜癌的发生、发展有抑制作用。
本研究以20 μg/mL APN作用子宫内膜癌HEC-1B细胞30 min后,AMPK蛋白磷酸化水平明显增强,mTOR、4EBP1蛋白磷酸化水平明显降低,而仅以10 μmol/L复合物C作用子宫内膜癌细胞30 min或复合物C预处理细胞30 min后,再加入20 μg/mL APN作用30 min后,AMPK、mTOR和4EBP1蛋白的表达水平则均无明显变化,提示一定浓度APN作用子宫内膜癌细胞一定时间后,可激活AMPK信号通路,激活的AMPK可抑制其下游蛋白mTOR、4EBP1的活化。
本研究发现,APN能抑制HEC-1B细胞的迁移、侵袭,而复合物C可阻断APN的这种抑制作用;在APN处理组中细胞的穿膜数与迁移率明显低于对照组,而复合物C预处理与处理组中细胞的穿膜数与迁移率较对照组则无明显差别。因此,上述结果提示APN在一定浓度、时间下可激活AMPK通路,并抑制HEC-1B细胞迁移、侵袭;表明激活AMPK通路是APN抑制子宫内膜癌发生、发展的重要机制之一,这为延迟或终止子宫内膜癌的进展提供了新方向。
恶性肿瘤的一大重要特征是生长不受限制,这不仅是由肿瘤细胞增殖和分化失控导致的,也与细胞的凋亡及肿瘤细胞的侵袭性有关。Bcl-2是一种较稳定的蛋白,可使多种因素导致的凋亡受到延迟或阻止;MMP-9可以促进分泌明胶酶B,破坏细胞基底膜的完整性,进而发挥促恶性肿瘤细胞生长与远处转移的作用。本研究发现,APN可抑制HEC-1B细胞Bcl-2、MMP-9 mRNA与蛋白的表达,而复合物C亦可阻断APN这种作用,提示APN可通过激活AMPK,下调Bcl-2、MMP-9的表达,从而抑制HEC-1B细胞的侵袭,促进肿瘤细胞凋亡。
综上所述,APN可通过激活AMPK来下调Bcl-2、MMP-9的表达;并可通过刺激AMPK磷酸化,抑制mTOR、4EBP1磷酸化,降低AMPK/mTOR/4EBP1信号转导通路中各通道蛋白的活性,提示在一定时间和浓度作用下,APN可经AMPK/mTOR/4EBP1信号通路发挥作用,这为人们认识脂联素抗子宫内膜癌的机制提供了新的信息。
