靶向IRF2的miR-1290对非小细胞肺癌细胞增殖、侵袭的调控作用及其机制研究
2020-02-11张仲妍
董 磊,张仲妍
1.武汉市红十字会医院肿瘤科,湖北 武汉 430000;
2.重庆大学附属肿瘤医院中医肿瘤科,重庆 400030
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌类型,约占所有肺癌的80%,恶性程度高,易发生转移和扩散,5年生存率很低[1]。目前,NSCLC患者主要采用手术联合放化疗,以期延长患者的生存时间,提高生活质量[2]。研究NSCLC细胞发生增殖和转移的机制,对于临床治疗具有重要意义。miRNA是一组具有调控作用的非编码小RNA,可以调控细胞的多种生物学过程[3]。miR-1290是近年来发现的一种与肿瘤有关的miRNA,在多种恶性肿瘤中均存在异常高表达[4-5]。临床研究显示,miR-1290可以调节干扰素调节因子-2(interferon regulatory factor-2,IRF2)的表达,调节NSCLC细胞的恶性生物学行为[6],但其作用具体机制目前尚不清楚。因此,本研究分析miR-1290靶向IRF2调节NSCLC细胞生物学行为的作用机制,旨在为NSCLC的分子靶向治疗提供一定的参考依据。
1 材料和方法
1.1 材料与仪器
全自动酶标仪购自美国Thermo Scientific公司;7500实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)系统购自美国Applied Biosystems公司;A549细胞均购自上海酶研生物科技有限公司;空质粒pGL3购自上海信裕生物科技有限公司;包含IRF23’-UTR序列的荧光素酶报告基因质粒(3’-UTR IRF2-WT)和含有IRF23’-UTR突变序列的荧光素酶报告基因质粒(3’-UTR IRF2-MUT)均由赛默飞世尔科技(中国)有限公司构建并鉴定;PCR引物由上海生工生物工程有限公司合成;荧光素酶检测试剂盒购自南京赛泓瑞生物科技有限公司;RPMI-1640培养基、胎牛血清购自赛默飞世尔科技(中国)有限公司;LipofectamineTM2000转染试剂购自上海恒斐生物科技有限公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购自武汉艾美捷科技有限公司;Transwell小室购自上海研卉生物科技有限公司;RNA提取试剂盒、反转录试剂盒、荧光定量试剂均购自北京索莱宝科技有限公司;β-actin、血管内皮生长因子(vascular endothelial growth factor,VEGF)、E-钙黏着蛋白(E-cadherin)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2和Ki-67抗体均购自美国Santa Cruz公司。
1.2 细胞培养与转染
将A549细胞接种于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、CO2体积分数为5%的培养箱中培养。将其分为NC组、miR-1290 mimic组和miR-1290 inhibitor组。转染前24 h接种细胞,将空白质粒转染到NC组细胞,miR-1290 mimic转染到miR-1290组细胞,miR-1290 inhibitor转染到miR-1290 inhibitor组细胞,按照转染试剂操作步骤进行转染。采用RTFQ-PCR和蛋白质印迹法(Western blot)检测各组细胞miR-1290和IRF2的表达。
1.3 miR-1290和IRF2的靶向关系验证
采用荧光素酶活性实验进一步验证miR-1290和IRF2的靶向关系,根据miRNA靶点预测软件预测,选择可以与miR-1290的结合的IRF2 mRNA的3’-UTR序列,体外合成含该位点的DNA片段(WT)和含该位点突变体(MUT)的DNA片段,克隆到双荧光素酶启动子载体pGL3。将该质粒转染到miR-1290组和NC组细胞,培养48 h后,采用荧光素酶检测试剂盒测定荧光素酶活性。
1.4 细胞培养与转染
取对数生长期A549细胞,将其分为NC组、miR-1290组、IRF2组和miR-1290+IRF2组。转染前24 h接种细胞,将空白质粒转染到NC组细胞,miR-1290 mimic转染到miR-1290组和miR-1290+IRF2组细胞;将IRF2构建到pLV-DNA载体过表达后转染到IRF2组和miR-1290+IRF2组细胞,按照转染试剂操作步骤进行转染。
1.5 转染后miR-1290和IRF2的表达水平
采用RTFQ-PCR测定各组细胞中miR-1290和IRF2的表达水平,TRIzol法提取细胞总RNA,经反转录合成cDNA,进行RTFQ-PCR,miR-1290上游引物:5’-GGCTCTGAGTGGTTGAGC-3’,下游:5’-CAGTGCGTGTCGTGGAGT-3’;IRF2上游引物:5’-TGAACTGCATACTACGCTCAAG A-3’,下游引物:5’-CGGATTCGTCACAATG TGTTC-3’。反应引物、体系和条件参照参考文献[7],以GAPDH作为内参。采用Western blot检测IRF2的表达,使用细胞裂解液提取总蛋白,将提取的总蛋白样品经过聚丙烯酰胺凝胶电泳转印至聚偏二氟乙烯膜,加兔抗人IRF2多克隆抗体(1∶1000)和β-actin蛋白单抗(1∶300),4 ℃下温育过夜,最后加二抗37 ℃下温育2 h,电化学发光法显色。采用凝胶成像分析软件分析蛋白条带灰度值。
1.6 CCK-8检测各组细胞的增殖活性
取各组对数生长期的A549细胞,将单个细胞悬液接种于96孔板中,每孔体积200 μL,含103个细胞,于37 ℃、CO2体积分数为5%的培养箱中培养,分别于0、24、48、72、96 h进行CCK-8检测,加入10 μL CCK-8试剂,采用酶标仪检测波长为450 nm处各孔的吸光度(D)值。
1.7 Transwell实验检测各组细胞的侵袭力
取100μL稀释好的基质胶均匀覆盖于Transwell小室底部。取各组对数生长期的A549细胞,用0.2%的胰蛋白酶进行消化后,调整细胞密度为2×105个/mL。取100 μL稀释好的细胞悬液加于上室,于37 ℃、CO2体积分数为5%的条件下培养48 h后,取出Transwell小室,采用甲醇固定,结晶紫进行染色,显微镜下观察膜下室面表面的细胞,并计数5个视野,取平均值。
1.8 划痕实验检测各组细胞的迁移力
取各组对数生长期的A549细胞接种于96孔板中,于37 ℃、CO2体积分数为5%的条件下培养,待细胞长满单层后,弃去培养基,采用灭菌的移液器吸嘴在皿底垂直划一直线,采用PBS洗涤3次,于37 ℃、CO2体积分数为5%的条件下常规培养。显微镜下观察划痕处细胞的生长情况,测量划痕宽度,计算细胞迁移率。
1.9 Western blot检测VEGF、E-cadherin、MMP-2蛋白水平及Ki-67增殖指数
取各组对数生长期的A549细胞,采用细胞裂解液提取总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量,取50 ng蛋白进行聚丙烯酰胺凝胶电泳,电转膜至聚偏二氟乙烯膜,室温封闭2 h,采用洗膜缓冲液(TRISbuffered saline Tween,TBST)洗膜并加一抗,4 ℃温育过夜,TBST洗膜加二抗,室温下温育2 h。再用电化学发光显示,选用β-actin作为内参,采用凝胶图象处理系统分析对比条带强弱。
1.10 统计学处理
采用SPSS 17.0软件对所得数据进行分析,计量资料均以表示,对计量资料首先进行正态性检验,各组均满足正态性且两组间方差齐,采用单因素方差分析比较两组间差异性,若组间比较有差异,采用SNK-q检验比较两组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 miR-1290与IRF2的靶向关系
将miR-1290 mimic和miR-1290 inhibitor分别转染到miR-1290细胞后,采用RTFQ-PCR和Western blot检测各组细胞miR-1290和IRF2的表达,结果显示:与NC组相比,miR-1290 mimic组的miR-1290 mRNA水平明显增加[(8.13±0.05)vs(1.00±0.00),P<0.05],IRF2蛋白和mRNA水平明显下降[(0.17±0.02)vs(0.28±0.02);(0.32±0.02)vs(1.00±0.00),P<0.05],miR-1290 inhibitor组的miR-1290 mRNA水平明显下降[(0.17±0.02)vs(1.00±0.00),P<0.05],IRF2蛋白和mRNA水平明显增加[(0.65±0.05)vs(0.28±0.02);(2.87±0.08)vs(1.00±0.00),P<0.05,图1,表1]。
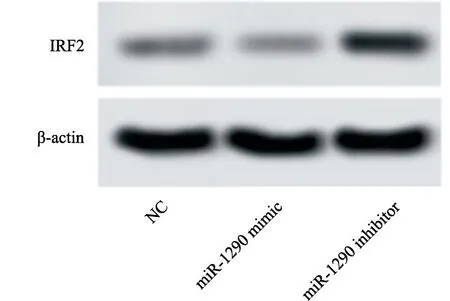
图1 miR-1290与IRF2的靶向关系Fig.1 Targeted relationship between miR-1290 and IRF2
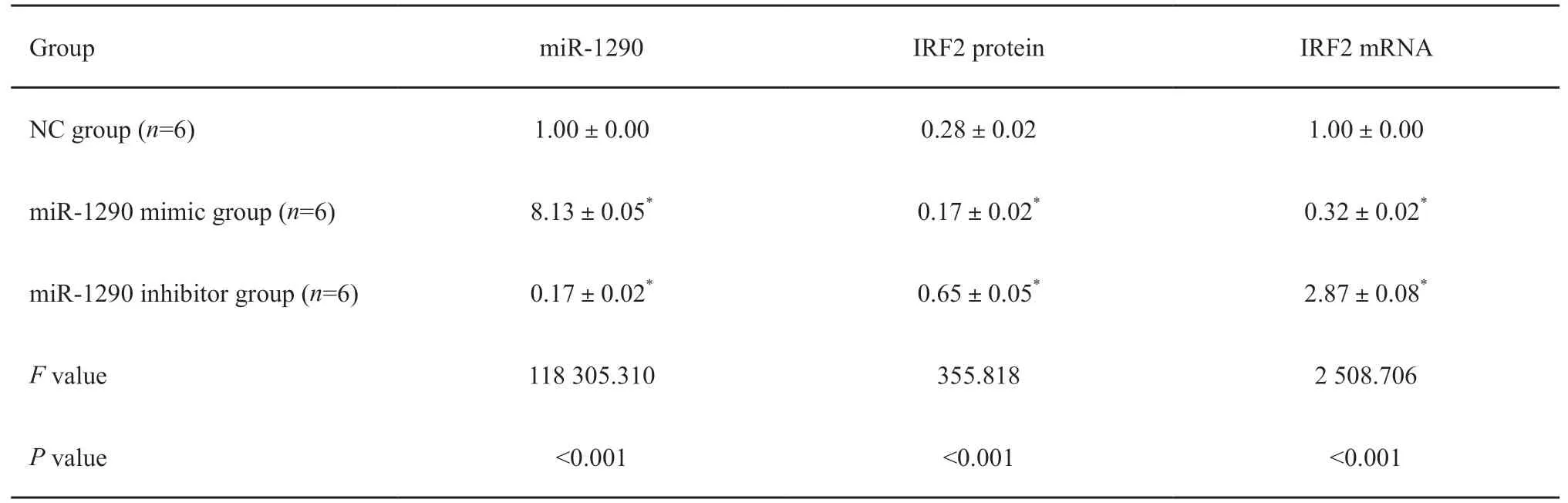
表1 miR-1290与IRF2的靶向关系Tab.1 Targeted relationship between miR-1290 and IRF2
2.2 荧光素酶活性实验验证miR-1290与IRF2的靶向关系
体外合成含miR-1290结合IRF2 mRNA 3’-UTR序列位点的DNA片段(WT)和含该位点突变体(MUT)的DNA片段,克隆到双荧光素酶启动子载体pGL3,分别转染到miR-1290组和NC组细胞,采用荧光素酶检测试剂盒测定荧光素酶活性,结果显示,与转染野生型荧光素酶质粒组相比,共转染野生型荧光素酶质粒和miR-1290 mimic组细胞的荧光素酶活性显著降低[(0.38±0.04)vs(1.00±0.04),P<0.05],miR-1290可以靶向负调控IRF2(图2)。
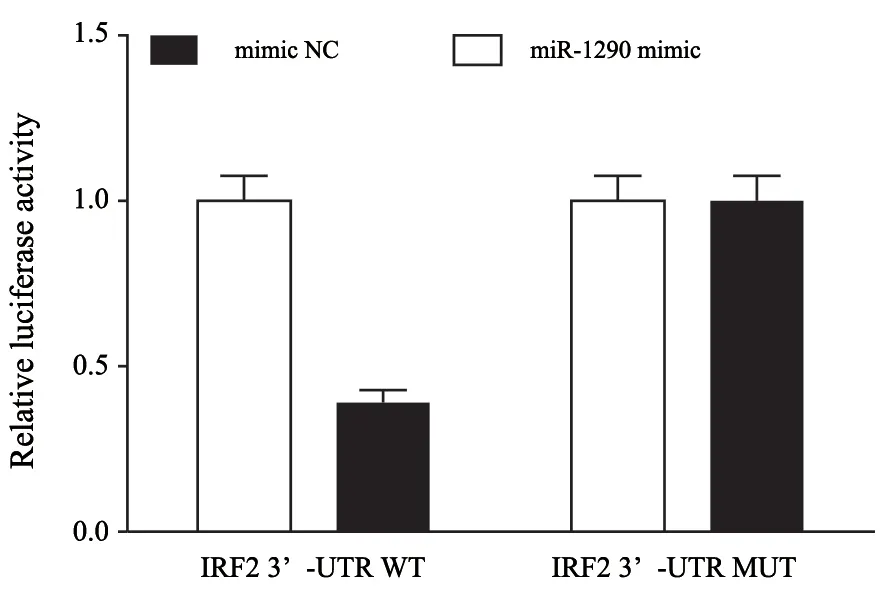
图2 荧光素酶实验检测各组细胞的荧光素酶活性Fig.2 Luciferase activity of cells in each group was detected by luciferase experiment
2.3 RTFQ-PCR和Western blot检测各组A549细胞转染后miR-1290和IRF2的表达水平
将空白质粒转染到NC组细胞,miR-1290 mimic转染到miR-1290组和miR-1290+IRF2组细胞;将IRF2构建到pLV-DNA载体过表达后转染到IRF2组和miR-1290+IRF2组细胞后,采用RTFQPCR和Western blot检测各组细胞miR-1290和IRF2的表达,结果显示:与NC组相比,miR-1290组miR-1290 mRNA水平明显增加[(8.11±0.06)vs(1.00±0.00),P<0.05],IRF2蛋白和mRNA水平明显下降[(0.15±0.02)vs(0.27±0.02);(0.33±0.03)vs(1.00±0.00),P<0.05],IRF2组IRF2蛋白和mRNA水平明显增加[(1.23±0.05)vs(0.27±0.02);(7.65±0.05)vs(1.00±0.00),P<0.05];与IRF2组相比,miR-1290+IRF2组miR-1290 mRNA水平明显增加[(8.09±0.06)vs(1.02±0.03),P<0.05],IRF2蛋白和mRNA水平明显下降[(0.24±0.05)vs(1.23±0.05);(0.93±0.06)vs(7.65±0.05),P<0.05,图3,表2]。
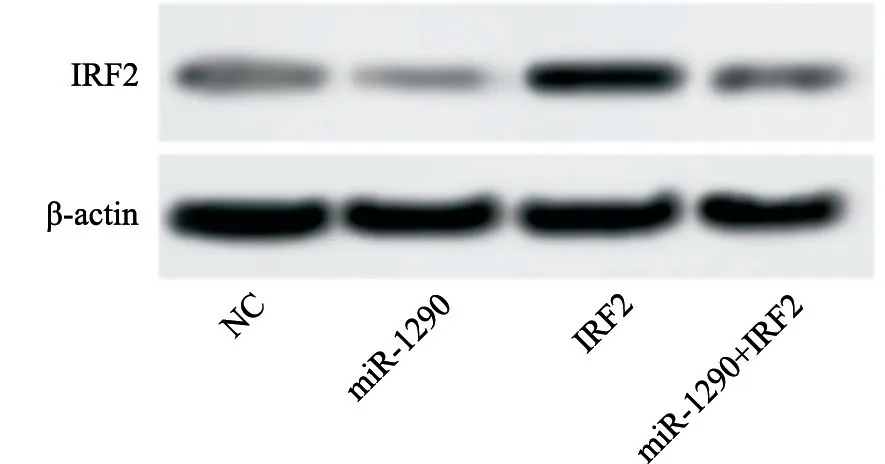
图3 转染后A549细胞IRF2蛋白的表达Fig.3 Expression of IRF2 protein in transfected A549 cells

表2 各组A549细胞的转染后miR-1290和IRF2的水平Tab.2 miR-1290 and IRF2 levels of A549 cells in each group after transfection
2.4 CCK-8检测各组A549细胞的增殖情况
采用CCK-8检测各组对数生长期A549细胞的增殖情况,结果显示,与NC组相比,miR-1290组细胞在培养24、48、72和96 h时数量明显增加(P<0.05),IRF2组细胞在培养24、48、72和96 h时数量明显下降(P<0.05),miR-1290+IRF2组细胞在培养24、48、72和96 h时数量均无明显变化(P>0.05);与IRF2组相比,miR-1290+IRF2组细胞在培养24、48、72和96 h时数量明显增加(P<0.05);与miR-1290组相比,miR-1290+IRF2组细胞在培养24、48、72和96 h时数量差异均无统计学意义(P>0.05,表3)。
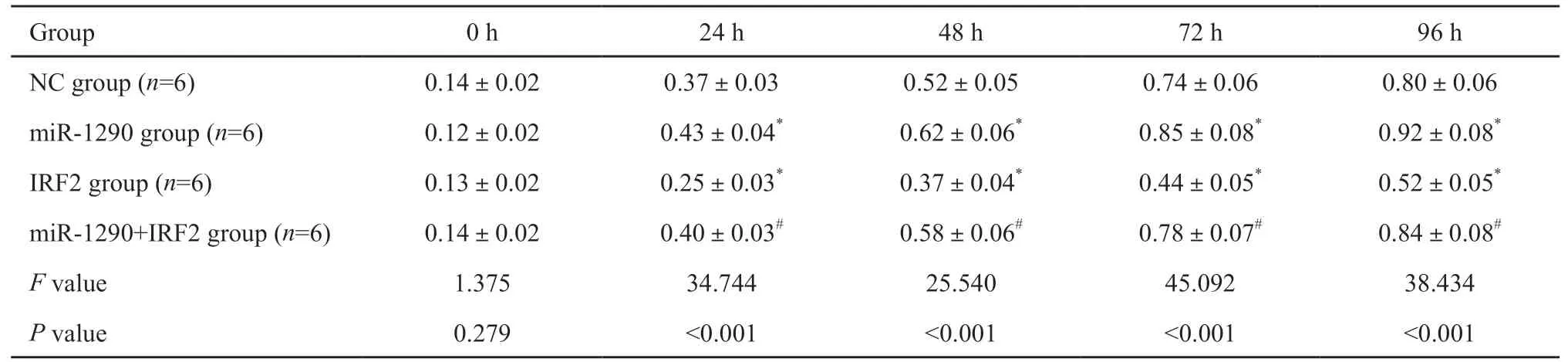
表3 各组A549细胞的增殖情况Tab.3 Proliferation of A549 cells in each group
2.5 Transwell和划痕实验检测各组A549细胞的侵袭和迁移能力
采用Transwell实验检测各组对数生长期A549细胞的侵袭力,划痕实验检测各组对数生长期A549细胞的迁移力,结果显示,与NC组相比,miR-1290组细胞侵袭细胞数和细胞迁移率明显增加[(183.45±22.37)vs(127.26±17.95);(65.43±8.61)vs(44.37±6.58),P<0.05],IRF2组细胞侵袭细胞数和细胞迁移率明显下降[(73.35±11.36)vs(127.26±17.95);(28.25±5.24)vs(44.37±6.58),P<0.05],miR-1290+IRF2组细胞侵袭细胞数和细胞迁移率无明显差异(P>0.05);与IRF2组相比,miR-1290+IRF2组细胞侵袭细胞数和细胞迁移率明显增加[(131.48±18.51)vs(73.35±11.36);(47.40±7.23)vs(28.25±5.24),P<0.05];与miR-1290组相比,miR-1290+IRF2组细胞侵袭细胞数和细胞迁移率明显下降[(131.48±18.51)vs(183.45±22.37);(47.40±7.23)vs(65.43±8.61),P<0.05,图4,表4]。
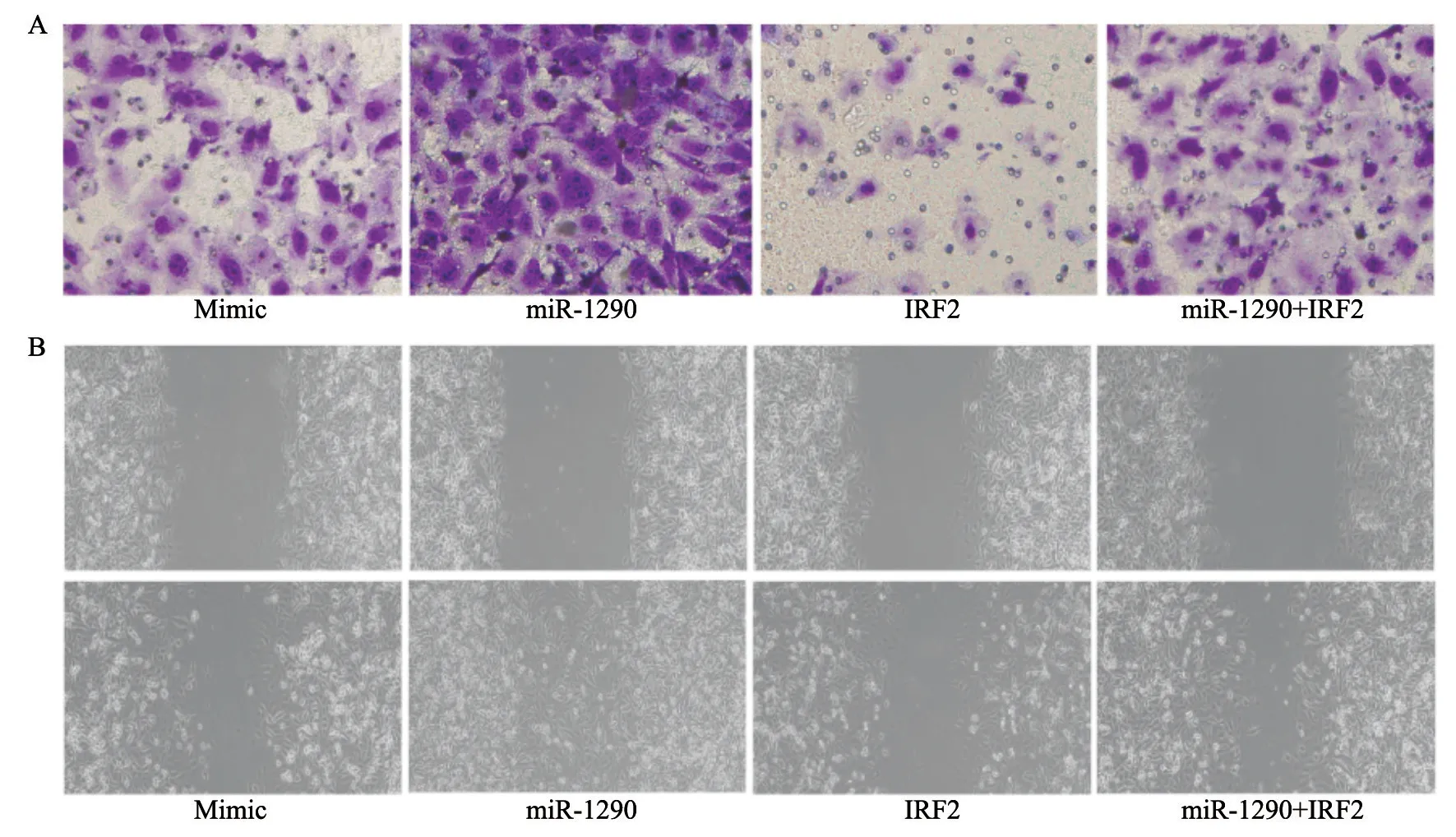
图4 各组A549细胞的侵袭和迁移力Fig.4 Invasion and migration of A549 cells in each group

表4 各组A549细胞的侵袭和迁移力Tab.4 Invasion and migration of A549 cells in each group
2.6 Western blot检测各组A549细胞VEGF、E-cadherin、MMP-2蛋白水平及Ki-67增殖指数
采用Wester n blot检测各组对数生长期A549细胞V EGF、E-cad her in、MMP-2蛋白水平及Ki-67增殖指数,结果显示,与NC组相比,miR-1290组细胞VEGF、MMP-2和Ki-67明显增加[(0.75±0.07)vs(0.47±0.04);(0.67±0.06)vs(0.38±0.03);(0.72±0.06)vs(0.40±0.04),P<0.05],E-cadherin水平明显下降[(0.21±0.03)vs(0.32±0.03),P<0.05],IRF2组细胞VEGF、MMP-2和Ki-67明显下降[(0.26±0.03)vs(0.47±0.04);(0.23±0.03)vs(0.38±0.03);(0.25±0.03)vs(0.40±0.04),P<0.05],E-cadherin水平明显增加[(0.61±0.05)vs(0.32±0.03),P<0.05],miR-1290+IRF2组细胞VEGF、MMP-2、Ki-67和E-cadherin无明显差异(P>0.05)。与IRF2组相比,miR-1290+IRF2组细胞VEGF、MMP-2和Ki-67明显增加[(0.51±0.05)vs(0.26±0.03);(0.41±0.04)vs(0.23±0.03);(0.44±0.04)vs(0.25±0.03),P<0.05],E-cadherin水平明显下降[(0.30±0.03)vs(0.61±0.05),P<0.05];与miR-1290组相比,miR-1290+IRF2组细胞VEGF、MMP-2和Ki-67明显下降[(0.51±0.05)vs(0.75±0.07);(0.41±0.04)vs(0.67±0.06);(0.44±0.04)vs(0.72±0.06),P<0.05],E-cadherin水平明显增加[(0.30±0.03)vs(0.21±0.03),P<0.05,图5,表5]。
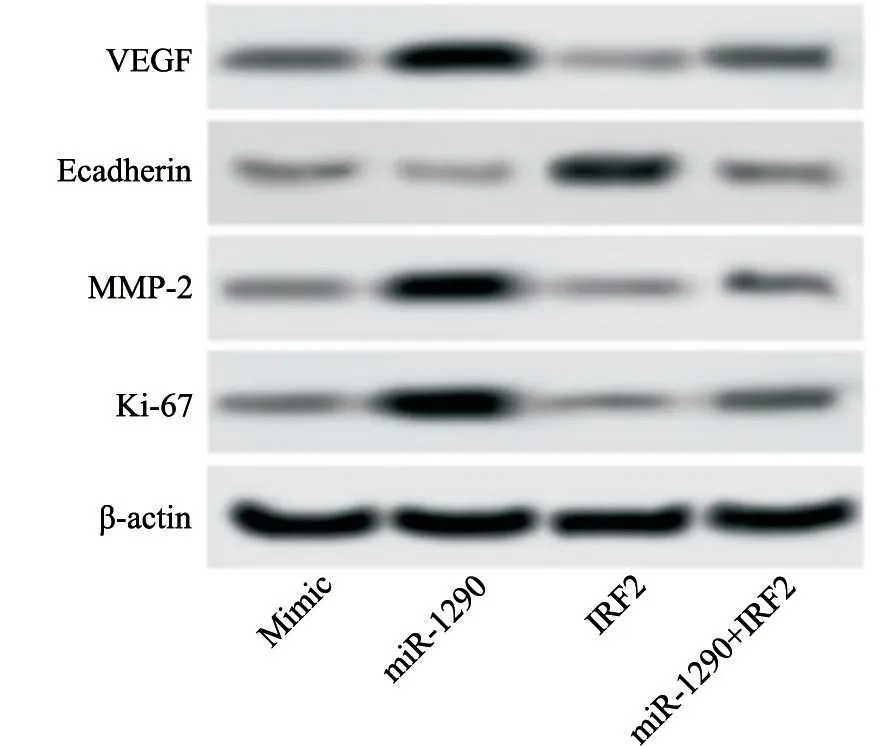
图5 各组A549细胞VEGF、E-cadherin、MMP-2、Ki-67的水平Fig.5 Levels of VEGF,E-cadherin,MMP-2 and Ki-67 of A549 cells in each group
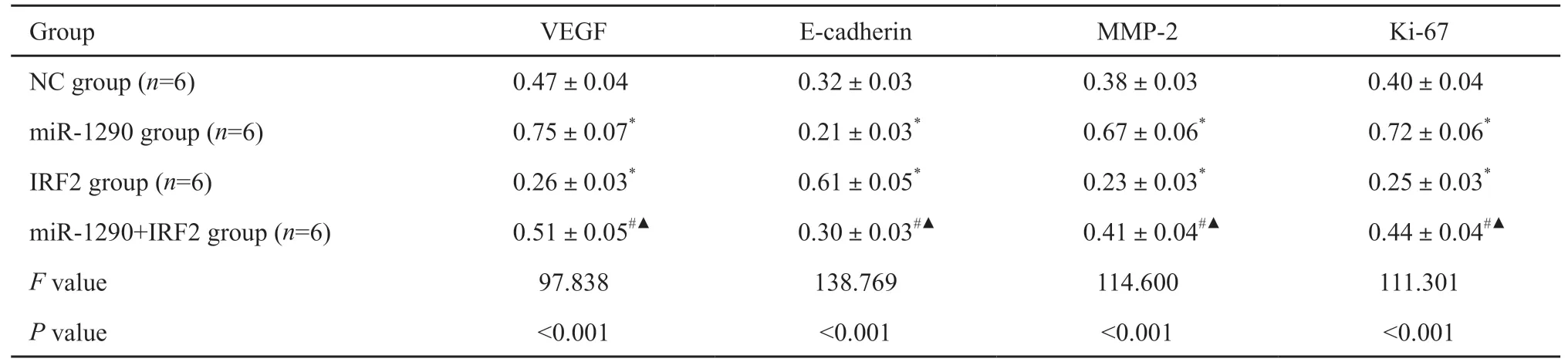
表5 各组A549细胞VEGF、E-cadherin、MMP-2、Ki-67的水平Tab.5 Levels of VEGF,E-cadherin,MMP-2 and Ki-67 of A549 cells in each group
3 讨论
miR-1290是一种新发现的miRNA,在肺癌、胃癌、结直肠癌、前列腺癌等多种恶性肿瘤中均存在异常表达[8]。Mo等[9]的研究显示,miR-1290在NSCLC患者血清中水平升高,且miR-1290高表达是影响NSCLC患者预后生存的独立因素,提示miR-1290与NSCLC的恶性发展密切相关。Kim等[10]的研究显示,miR-1290在A549细胞中表达明显上调,差异表达的miR-1290可能通过下调Bcl-2的表达,抑制NSCLC细胞的凋亡。因此,本研究以NSCLC细胞A549为研究对象,分析miR-1290作用于NSCLC细胞的具体机制。本研究发现,转染miR-1290mimic后,A549细胞中miR-1290的表达显著上调,IRF2的表达显著下调,转染miR-1290 inhibitor后,miR-1290的表达显著下调,IRF2的表达显著上调,证实转染成功,提示miR-1290可以负调控IRF2。本研究采用荧光素酶实验进一步验证发现,miR-1290可以靶向负调控IRF2的表达。IRF2是IRF家族的一员,可以结合干扰素基因启动子,在免疫反应和促进细胞增殖方面发挥重要作用[11]。临床研究显示[12],IRF2参与胃癌的发生、发展,可以抑制胃癌细胞的增殖、侵袭和迁移,与本研究结果基本相符,提示miR-1290可能通过靶向负调控IRF2的表达,促进NSCLC细胞的恶性生物学行为,有望作为NSCLC分子靶向治疗的新靶点。
本研究结果显示,IRF2过表达可以显著下调Ki-67的表达,抑制A549细胞的增殖活性,miR-1290过表达可以靶向抑制IRF2的表达,使Ki-67增殖指数升高,促进A549细胞的增殖活性。Yan等[13]的研究显示,miR-1290可以靶向调节LHX6的表达促进胶质瘤细胞的增殖、侵袭和迁移,提示miR-1290可以靶向负调控IRF2的表达,促进A549细胞的增殖。本研究结果显示,IRF2过表达可以显著抑制A549细胞的侵袭和迁移能力,miR-1290过表达可以靶向抑制IRF2的表达,促进A549细胞的侵袭和迁移。Liang等[14]的研究表明,IRF2可以促进肺癌细胞的凋亡,抑制其增殖和迁移,与本研究的结果基本相符,提示miR-1290可能通过靶向负调控IRF2的表达,抑制A549细胞的增殖和迁移。陈蓉等[15]的研究显示,miR-1290可能通过与IRF2结合,促进A549细胞的增殖和侵袭,与本研究结果基本相符,提示miR-1290可能通过靶向抑制ADAM9的表达,抑制A549细胞的增殖、侵袭和迁移。
在本研究中,IRF2过表达可以下调A549细胞的VEGF和MMP-2,上调E-cadherin水平,miR-1290过表达可以靶向抑制ADAM9的表达,上调VEGF和MMP-2,下调E-cadherin水平。VEGF是一种高度特异性的促血管生成因子,可以促进肿瘤血管的新生,在多种肿瘤的发生、发展中具有重要作用,研究显示[16],VEGF高表达可以调控NSCLC细胞的恶性生物学行为,加快NSCLC的恶性发展,提示miR-1290可能通过靶向负调控IRF2的表达,上调VEGF的表达,促进A549细胞的增殖、侵袭和迁移。MMP-2是MMP家族的一员,可以降解和重塑细胞外基质,参与调控多种肿瘤细胞的侵袭和迁移[17]。E-cadherin是一种钙依赖性的跨膜蛋白,可以调节细胞间的黏附作用,一旦其表达下调或缺失,可导致细胞间黏附作用下降,使癌细胞易发生脱落,促进其侵袭和转移[18]。Butkiewicz等[19]的研究显示,MMP-2、E-cadherin和VEGF可以作用于NSCLC细胞,促进其侵袭和迁移。Yi等[20]的研究显示,miR-18a可以靶向IRF2调节胃癌细胞的恶性生物学行为,提示miR-1290可能通过靶向抑制IRF2的表达,调节MMP-2、E-cadherin和VEGF蛋白水平,促进A549细胞的恶性生物学行为。
综上所述,miR-1290可能通过靶向负调控IRF2的表达,上调VEGF、MMP-2,下调E-cadherin水平,使Ki-67增殖指数升高,促进A549细胞的增殖、侵袭和迁移,有望作为临床治疗的新靶点。
