ABC294640抑制卵巢癌侵袭及转移的实验研究
2020-02-10宋柯琦戴岚田琦狄文
宋柯琦,戴岚,田琦,狄文
卵巢癌发病率呈现上升趋势,目前在发达国家卵巢癌发病率高达9.1/10万,在发展中国家也达到5.0/10万[1]。2017年美国约有22 440例卵巢癌新发病例而死亡病例数为14 080例[2]。根据国内统计数据,我国每年约有52 100例患者被新确诊为卵巢癌,约22 500例患者死于卵巢癌[3]。卵巢癌侵袭性高,易对化疗耐药,因此迫切需要寻找合理有效的治疗靶点和治疗手段以抑制卵巢癌的转移,这也是提高卵巢癌患者生存率、延长生存期的关键。鞘氨醇激酶(sphingosine kinase,SphK)作为鞘磷脂代谢途径中的关键限速酶,作为肿瘤治疗新靶点已被广泛研究。磷脂作为重要的信号分子,参与调节许多关键的细胞功能。SphK失活导致S1P前体的积累,抑制特定原癌基因活性,导致细胞凋亡和生长停滞。通过针对SphK1、SphK2作为靶点的抑制剂来调节Cer/S1P转换为肿瘤的治疗提供了一个新思路。Safingol作为靶向SphK1、SphK2以及蛋白激酶C的非特异性抑制剂,已经进入临床研究阶段,但其有一定的肝脏毒性[4]。2010年美国食品和药品监督管理局(FDA)已批准唯一一种鞘脂类代谢通路中的药物是Fingolimod(FTY720),该药是一种S1P受体调节剂,在多发性硬化患者中能阻止淋巴细胞的再循环,降低复发率。同时,Fingolimod也能抑制SphK1活性,并在多项临床前研究中被证明具有抑制肿瘤的作用,但其对免疫系统的抑制作用却对肿瘤的治疗过程产生了不利影响[5]。因此仍需探索新的肿瘤治疗的有效药物。ABC294640最初由美国Apogee Biotechnology公司研发,全称为3-(4-氯苯基)金刚烷-1-羧酸(吡啶-4-基甲基)酰胺,化学式为C23H25C1N2O,是一种靶向SphK2的小分子抑制剂。本研究致力于探索ABC294640对上皮性卵巢癌细胞侵袭转移能力的调控及其可能机制。
1 材料与方法
1.1 药品和试剂 ABC294640购自美国Selleck公司,DMEM高糖培养基、胎牛血清购自美国Gibco公司。一抗c-Myc单克隆兔抗人抗体、一抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆鼠抗人抗体采购自美国Abcam公司,二抗羊抗兔抗体、二抗羊抗鼠抗体购自美国LICOR公司。细胞组织蛋白裂解液、蛋白浓度测定试剂盒、蛋白免疫印迹(Western blotting)所用一抗稀释液采购于江苏碧云天生物技术公司。聚偏二氟乙烯膜(PVDF,0.45 μmol)、电化学发光(ECL)显影试剂盒购自美国Millipore公司。Transwell小室及24孔培养板购自美国Corning公司。Matrigel基质胶采购于美国BD公司。ABC294640用二甲基亚砜(DMSO)配制成100 mmol/L储存(实验时DMSO终浓度小于0.2%)。
1.2 细胞株及细胞培养 人源性卵巢癌细胞株SKOV3和HO8910由中国科学院上海生命科学研究院细胞资源中心购买取得,保存于上海交通大学医学院附属仁济医院上海市妇科肿瘤重点实验室。细胞培养在含10%胎牛血清、1%青霉素和1%链霉素的DMEM高糖培养基中,在37℃,5%的CO2条件下的细胞培养箱中培养。至细胞达到70%~80%融合度时用胰蛋白酶消化传代。
1.3 动物及饲养 6~8周,体质量16~18 g的SPF级BALB/c雌性裸鼠购买于上海斯莱克实验动物有限公司,饲养在仁济医院SPF级动物实验室,室内温度22℃,12 h光照周期,自由饮食饮水,动物饲养及管理参照上海交通大学医学院附属仁济医院动物房管理条例。
1.4 Transwell细胞迁移实验 ABC294640 50 μmol作用于SKOV3和HO8910细胞2 h后,消化细胞磷酸盐缓冲液(PBS)洗涤后用无血清DMED培养基重悬至2.5×105/mL。取100 μL加入在24孔Transwell小室上室,下层培养孔加入600 μL含10%胎牛血清的DMEM培养基。37℃、5%CO2孵育箱孵育24 h。从孵育箱中取出24孔板,将Transwell小室在PBS中轻柔洗涤2遍,小室浸入95%乙醇中固定5 min。PBS再次洗涤后,用棉签轻擦,拭去膜上未穿过细胞。细胞固定风干,置于0.1%结晶紫染色15 min,PBS洗去多余结晶紫。将已固定、染色、清洗后的Transwell小室放置于倒置显微镜下观察并拍照。每张膜随机选取5个高倍镜视野(×400),计数穿过小室底膜细胞数目,取平均值,以穿过基底膜的细胞数表示各组细胞的迁移能力。每次实验每组设置3个复孔,实验重复3次。
1.5 Transwell细胞侵袭实验 将Matrigel胶与无血清的培养基以1∶3稀释均匀混合,取50 μL均匀平铺于Transwell小室上室底膜,37℃温箱静置30 min。清洗上室后,加入50 μL含血清的培养基,37℃孵育箱中静置30 min。ABC294640 50 μmol作用SKOV3和HO8910细胞2 h后,消化细胞PBS洗涤后用无血清DMED培养基重悬至2.5×105/mL。取100 μL加入24孔Transwell小室上室,下层培养孔加入600 μL含10%胎牛血清的DMEM培养基。37℃、5%CO2孵育箱孵育24 h。培养24 h后取出Transwell小室上室,擦掉小室内表面未穿过膜的细胞,固定后结晶紫染色。将已固定、染色、清洗后的Transwell小室放置于倒置显微镜下观察并拍照。每张膜随机选取5个高倍镜视野(×400),计数穿过小室底膜细胞数目,取平均值,以穿过基底膜的细胞数表示各组细胞的侵袭能力。每次实验每组设置3个复孔,实验重复3次。
1.6 Western blotting法检测 收集不同处理细胞,然后用RIPA裂解液裂解细胞收集蛋白,BCA法测定蛋白浓度,加5×上样缓冲液混匀后100℃,10 min变性。将等量蛋白上样后进行SDS-PAGE电泳后进行转膜。将蛋白转移至PVDF膜后,用含5%BSA的TBST室温封闭1 h,用TBST充分洗涤后,加特异一抗,4℃孵育。过夜用TBST充分洗涤后加对应二抗,室温孵育1 h,充分洗涤后,滴上ECL发光液充分显影。将GAPDH蛋白作为内参。
1.7 腹腔转移瘤模型建立及实验干预 胰酶消化对数生长期SKOV3细胞,离心后PBS洗涤2次,计数重悬细胞,低温放置。随机将裸鼠分为2组;每只裸鼠腹腔内注射2.5×106个细胞/200 μL。腹腔注射肿瘤细胞1周后,予以每周2次腹腔注射药物(ABC294640 50 mg/kg)或者相同浓度DMSO配置PBS溶液。给药后第28天以颈椎脱臼法处死小鼠,解剖小鼠后,剔除所有腹腔内的转移肿瘤。计数肿瘤数目,留取每只小鼠转移瘤中最大者,以石蜡包埋进行免疫组织化学染色。
1.8 免疫组织化学法检测裸鼠腹腔肿瘤组织中c-Myc的表达 裸鼠腹腔转移瘤组织经甲醛固定、石蜡包埋、切片后常规脱蜡水化,按照二步法试剂盒所示的操作步骤进行,切片经脱水、透明、封片、镜检。在低倍镜下随机选取相同大小的视野拍照,分析肿瘤组织中c-Myc表达情况。
1.9 统计学方法 采用SPSS 24.0统计软件进行分析,定量数据以均数±标准差(±s)表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ABC294640对卵巢癌细胞侵袭、迁移能力的影响
2.1.1 Transwell侵袭实验 在SKOV3细胞中,ABC294640药物组和对照组穿过Transwell小室的细胞数分别为(22.33±5.13)个和(41.67±7.02)个,差异有统计学意义(n=3,t=16.086,P<0.01)。在HO8910细胞中,ABC294640药物组和对照组穿过Transwell小室的细胞数分别为(22.67±14.64)个和(63.33±14.64)个,差异有统计学意义(n=3,t=7.330,P<0.05)。ABC294640作用于卵巢癌细胞后,细胞的侵袭能力显著下降。见图1(见后插二)。
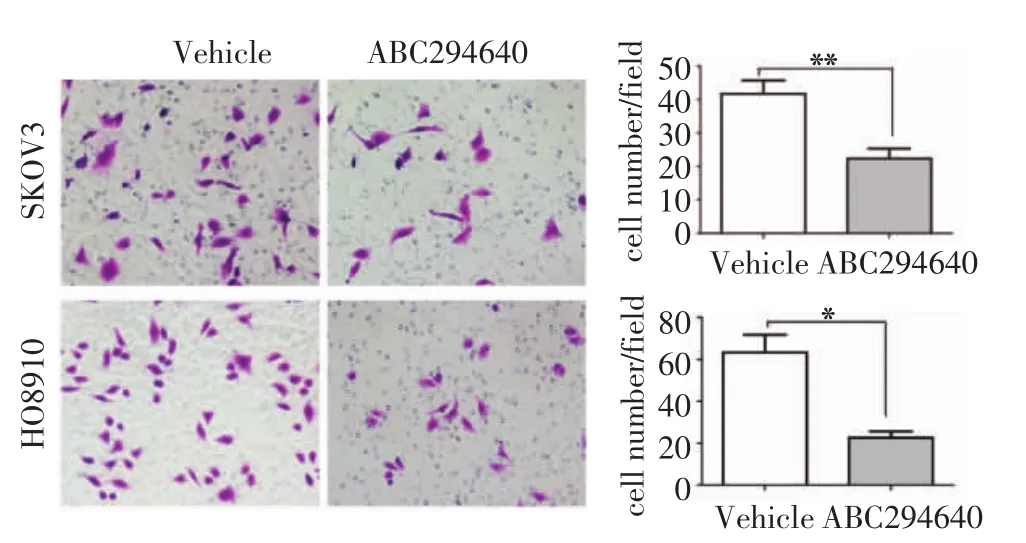
图1 Transwell小室检测ABC294640对卵巢癌细胞侵袭的作用
2.1.2 Transwell迁移实验 在SKOV3细胞中,ABC294640药物组、对照组穿过Transwell小室的细胞数分别为(42.67±6.43)个和(101.33±12.58)个,差异有统计学意义 (n=3,t=13.538,P<0.001)。在HO8910细胞中,ABC294640药物组和对照组穿过Transwell小室的细胞数分别为(55.67±12.22)个和(103.67±10.51)个,差异有统计学意义(n=3,t=27.713,P<0.01)。ABC294640作用于卵巢癌细胞后,细胞的迁移能力显著下降。见图2(见后插二)。

图2 Transwell小室检测ABC294640对卵巢癌细胞侵袭的作用
2.2 ABC294640对体内卵巢癌转移的影响 裸鼠随机分为实验组(ABC294640)及对照组(Vehicle组),每组6只,分别腹腔成瘤,1周后开始腹腔内注射用药(用药组予以ABC294640 50 mg/kg腹腔注射,对照组予以注射溶剂浓度DMSO溶液)。2组成瘤率为100%。成瘤35 d后,观测小鼠行动迟缓,反应不灵敏,消瘦,部分小鼠腹部膨隆,但未见死亡。解剖小鼠,见小鼠腹腔内散在大小不等的转移瘤,肠系膜、横膈下、肝脏、盆腹腔等均可见转移瘤。解剖小鼠后,2组腹腔转移瘤对比情况见图3A。实验组裸鼠腹腔转移瘤数目低于对照组,差异有统计学意义(4.00±1.41 vs.7.33±1.87,n=6,t=3.492,P<0.01)。见图3(见后插二)。

图3 对照组与ABC294640组裸鼠腹腔移植瘤情况
2.3 ABC294640作用对c-Myc表达的影响 Western blotting结果表明在体外ABC294640作用后卵巢癌细胞中c-Myc表达显著下降(SKOV3:n=3,t=35.940,P<0.01;H08910:n=3,t=21.072,P<0.01) 见图 4A(见后插二)。免疫组织化学法检测裸鼠腹腔肿瘤组织中c-Myc蛋白表达情况后发现,与对照组相比ABC294640药物作用后肿瘤组织中c-Myc表达率显著下降[(7.76±0.72)%vs.(16.65±2.00)%,P<0.01],见图 4B(见后插二)。

图4 ABC294640作用对c-Myc表达水平的调控
3 讨论
近年随着各项治疗技术不断发展,卵巢癌的5年生存率并无明显改善,其中卵巢癌转移是导致患者治疗效果不佳和高死亡率的主要原因之一。卵巢癌在发现时多属晚期,根治性切除机会少,术后极易发生局部浸润和远处转移,导致卵巢癌患者生存时间短,死亡率高居妇科恶性肿瘤首位。卵巢癌转移起源于一系列基因和表观遗传变化,这些变化能在分子水平上激活原癌基因并使抑癌基因失活,此过程涉及多级分子机制调控,是一个复杂的、多因素调控的动态过程。探索卵巢癌侵袭、转移能力的分子调控机制,寻找肿瘤转移的新靶点和治疗的新方法已成为卵巢癌基础研究与临床研究的热点。
SphK2在多种肿瘤中被证实处于过表达状态,并且在甲状腺癌、结肠癌和膀胱癌中对肿瘤侵袭、转移能力起促进作用[6-9]。在乳腺癌、肺癌和淋巴瘤等的研究中,研究已证实针对SphK的特异性抑制剂ABC294640能通过抑制磷酸化细胞外调节蛋白激酶(pERK)、磷酸化蛋白激酶 B(pAKT)、核因子 κB(NF-κB)等通路抑制S1P生成,增加细胞内神经酰胺积累,促进肿瘤细胞自噬和凋亡,最终抑制多种肿瘤细胞增殖和抑制肿瘤细胞迁移。本课题组也发现ABC294640能显著抑制卵巢癌增殖[10],但对于ABC294640对卵巢癌的转移所起的作用却鲜有报道。本研究从体内及体外实验的角度探索了ABC294640对卵巢癌细胞转移能力的影响,发现在体外Transwell实验中ABC294640作用后,SKOV3和HO8910细胞侵袭和迁移细胞数都显著下降;在体内试验中,裸鼠腹腔注射ABC294649后转移瘤数目减小。提示了ABC294640作用后能显著抑制卵巢癌的转移能力。
在肿瘤转移过程中涉及众多基因的表达异常,其中转录因子c-Myc异常表达能调节细胞增殖和分化状态,并且增强肿瘤细胞侵袭转移能力。在恶性肿瘤中,c-Myc对许多肿瘤细胞的恶性生物学行为:包括细胞恶性增殖、转移、上皮-间质转化和肿瘤血管生成等均有促进作用[11]。国内外研究发现c-Myc在卵巢癌细胞中处于过表达状态,并且c-Myc高表达能促进卵巢癌细胞无限增殖,同时对肿瘤早期转移、化疗耐药等特点具有促进作用[12-14]。有研究发现下调c-Myc能明显抑制肿瘤细胞的增殖和侵袭能力[15-16]。另有研究表明调控鞘磷脂代谢轴能够通过改变c-Myc的表达水平而调节细胞迁移运动能力[17]。在此基础上,本研究为了揭示ABC294640抑制卵巢癌细胞侵袭能力的原因,进一步检测了药物作用后细胞中c-Myc的蛋白水平变化,体内和体外实验结果均显示ABC294640作用后,卵巢癌中c-Myc蛋白表达水平显著降低,提示ABC294640可能通过调控c-Myc蛋白表达而影响卵巢癌的侵袭、转移能力。由于目前尚没有直接针对c-Myc作为靶标的药物,消除c-Myc的促癌作用中最可行的方法是靶向抑制上游调节因子以降低c-Myc的表达和活性,因此在卵巢癌中ABC294640能够抑制肿瘤中c-Myc的表达,对于寻找卵巢癌潜在新的治疗途径具有重要的意义。可见,ABC294640能下调c-Myc的表达,进而抑制卵巢癌细胞的侵袭和迁移能力。但是对于ABC294640在卵巢癌中对生物学行为调控的具体分子机制和调控方法还需要进一步研究。完善ABC294640在卵巢癌中的分子作用机制研究能为今后探索卵巢癌新的治疗方法奠定基础。
ABC294640针对肿瘤的研究已进入临床试验阶段。第一个ABC294640在晚期实体瘤患者中的Ⅰ期临床试验已经完成[18]。Ⅰ期临床研究证明了ABC294640在不同类型肿瘤中的治疗潜力,包括肺癌、前列腺癌、结直肠癌、卵巢癌和肝癌、多发性骨髓瘤、淋巴瘤和白血病等。目前还有多项ABC294640的临床试验正在进行中,包括肝细胞癌(NCT02939807)、复发/难治性弥漫性大B细胞淋巴瘤(NCT02229981)和难治性/复发性多发性骨髓瘤(NCT02757326)等。
综上,本研究从体内、体外两方面证明ABC294640靶向SphK2可有效抑制上皮性卵巢癌细胞侵袭和迁移,为靶向SphK2的药物ABC294640成为卵巢癌治疗新途径提供了可靠的理论依据。
