前列腺穿刺结果的多参数预测列线图模型建立:上海单中心1 585例经会阴前列腺穿刺回顾
2020-02-10胡梦博杨天吴亦硕张立旻姜昊文
胡梦博 杨天 吴亦硕 张立旻 姜昊文 丁 强
(复旦大学附属华山医院泌尿外科 上海 200040)
前列腺癌是欧美国家男性患者最常见的实体肿瘤之一[1],近年来在我国的发病率呈快速上升趋势[2]。我国发病率的升高,与人口老龄化、饮食结构西化、前列腺特异抗原(prostate specific antigen,PSA)筛查的普及和前列腺穿刺的推广密切相关。同时,前列腺穿刺亦会诊断大量前列腺良性疾病(如前列腺炎症、前列腺增生)和对生存期影响较小的低危前列腺癌,并不可避免地带来各种并发症[3]。因此,如何提高前列腺癌尤其是高级别前列腺癌(highgrade prostate cancer,HGPCa)的穿刺阳性率,同时避免不必要的穿刺,成为当前的研究热点[4]。
当前临床实践中,前列腺穿刺决策主要基于PSA升高、游离PSA(freeprostate specific antigen,fPSA)或PSA密度(prostate specific antigen density,PSAD)异常、直肠指检(digital rectal examination,DRE)或影像学存在异常发现。对于前列腺穿刺结果的预测,目前学界已提出多种预测模型和工具(列线图、风险计算器),国际上常用的包括前列腺癌预防试验(Prostate Cancer Prevention Trial,PCPT)风险计算器[5]和欧洲前列腺癌筛查随机分配研究(European Randomized Study of Screening for Prostate Cancer,ERSPC)风险计算器[6]。然而,以上两种风险计算器均基于欧美前列腺筛查人群(PSA相对较低),在种族、临床特征基线等方面与我国穿刺人群相差较大,并不完全适用于我国的穿刺预测[7]。同时,我国目前亦有学者[8-9]提出基于中国人群的前列腺穿刺预测列线图,但HGPCa的预测模型仍鲜有报道。本研究纳入复旦大学附属华山医院单中心前列腺穿刺人群,旨在探索穿刺结果的预测因素,并建立前列腺癌与HGPCa的多参数预测列线图模型,以期有助于医患沟通,并科学制定个体化的穿刺策略。
资料和方法
研究人群本次研究获得复旦大学附属华山医院伦理委员会批准,纳入患者均于穿刺前签署书面知情同意。连续选取2010—2017年于我院行前列腺穿刺患者共计1 585人,每位患者均接受超声引导下经会阴穿刺(10针)。前列腺穿刺指征为:PSA>10 ng/mL;或PSA介于4~10 ng/mL,且fPSA/tPSA<0.16或PSAD>0.15;或DRE、经直肠前列腺超声(transrectal ultrasound,TRUS)及其他影像学检查发现前列腺占位。将病例资料初筛后,排除关键研究数据缺失者89例、排除PSA>100 ng/mL者165例,最终纳入统计1 331例。采用随机数字表法选取1 065例(80%)患者进入建模组,266例(20%)患者进入验证组。
临床特征与病理评估穿刺前常规收集以下临床数据:年龄、体重指数(body mass index,BMI)、PSA、前列腺体积(prostate volume,PV)、游离PSA比例(%fPSA)、DRE及TRUS结果。确认所有PSA检查均先于DRE及TRUS检查,若检查次序倒置则作为关键数据缺失予以排除。PV由超声报告直接提供或经计算得到,计算公式为:PV(cm3)=0.52×前列腺三径乘积(cm3)。PSAD为PSA与PV的比值。所有穿刺标本即刻装入10%甲醛瓶内固定,由我院病理科评估,采用Gleason评分系统对前列腺癌进行病理评级。其中,HGPCa定义为Gleason≥4+3,低级别前列腺癌(low-grade prostate cancer,LGPCa)定义为Gleason≤3+4。
统计分析与列线图构建根据穿刺病理结果,将研究人群分为非肿瘤组与前列腺癌组,将前列腺癌组进一步分为LGPCa亚组和HGPCa亚组。在非肿瘤组与前列腺癌组、LGPCa与HGPCa组中,对年龄、BMI、PSA、PV、DRE、TRUS等临床特征进行分组比较,对连续变量采用曼-惠特尼秩和检验,对分类变量采用χ2检验。对各参数分别进行单因素Logistic回归,具有显著预测价值者进一步纳入多因素Logistic回归,分析不同参数对穿刺结果(前列腺癌与HGPCa)的预测价值,并据此建立多参数预测模型。
利用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析PSA、PSAD和多参数预测模型对穿刺结果的预测效力,并比较ROC曲线下面积(area under the receiver operating characteristic curve,AUC)的差异。基于多参数预测模型分别建立中国人群前列腺癌与HGPCa的穿刺预测列线图。数据处理与统计采用SPSS 20和R version 3.3.1(http://www.r-project.org/)。所有检验以P<0.05为差异具有统计学意义。
结 果
临床特征与病理结果共计1 331例患者接受超声引导下经会阴前列腺穿刺,病理确诊为前列腺癌共计519人(39.0%),其中LGPCa患者249人(18.7%),HGPCa患者270人(20.3%)。在非肿瘤组与前列腺癌组比较中,年龄、PSA、PV、DRE、TRUS均存在显著差异(P<0.001),而BMI未见明显差异(表1)。在LGPCa组与HGPCa组的比较中,PSA、PV、DRE、TRUS存在显著差异。相较于非肿瘤组,前列腺癌组患者年龄较大(中位数74岁),PSA较高(中位数24.0 ng/mL),PV较小(中位数38.0 mL),DRE(53.2%)与TRUS(70.3%)阳性率较高。在前列腺癌亚组分析中,HGPCa组在PSA(中位数32.1 ng/mL)、DRE阳性率(66.3%)与TRUS阳性率(79.6%)方面均显著高于LGPCa组。
预测模型的建立与验证随机选取1 065(80%)例患者进入建模组,对各临床参数与穿刺结果为前列腺癌或HGPCa者进行单因素回归分析,将具有显著性差异者进一步纳入多参数预测模型(表2)。其中,前列腺癌多参数预测模型纳入5项临床参数,包括年龄(OR=1.056,P<0.001)、PSA(OR=1.063,P<0.001)、PV(OR=0.960,P<0.001)、DRE(OR=5.991,P<0.001)和TRUS(OR=1.717,P=0.002)。在HGPCa的预测中,单因素回归中具有显著预测价值的年龄因素(OR=1.034,P<0.001),在多参数预测模型中因显著性消失(OR=1.015,P=0.124)被舍去。最终HGPCa多参数预测模型纳入4项临床参数,包括PSA(OR=1.032,P<0.001)、PV(OR=0.983,P<0.001)、DRE(OR=4.803,P<0.001)和TRUS(OR=1.987,P=0.001)。
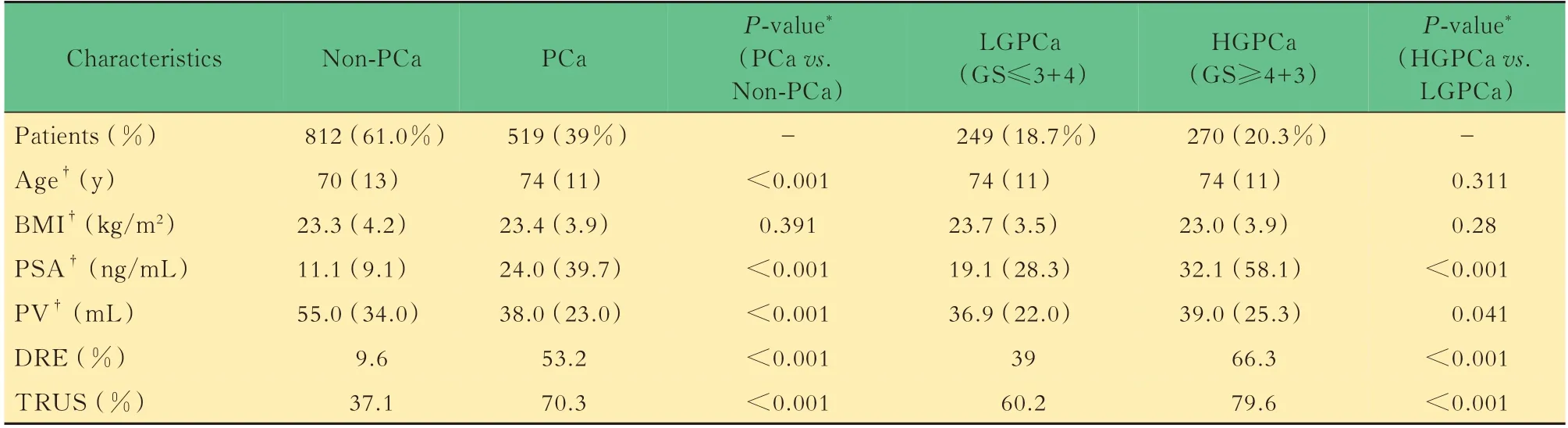
表1 前列腺穿刺人群的基线临床特征Tab 1 Baseline clinical characteristics of prostate biopsy population
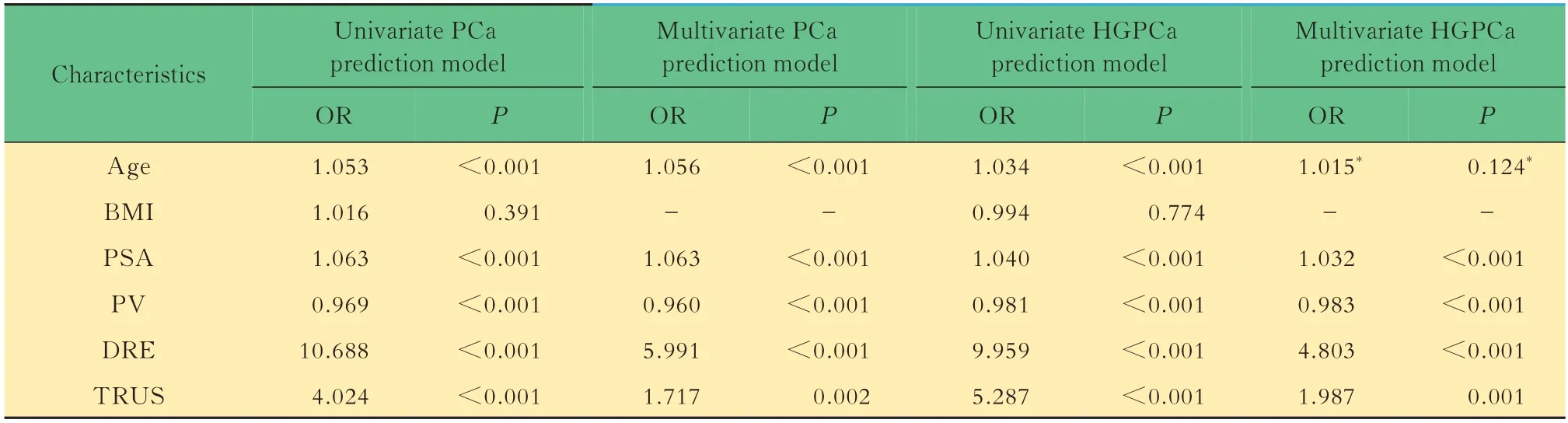
表2 前列腺癌与高级别前列腺癌预测的单参数与多参数回归分析Tab 2 Univariate and multivariate analyses of predictors associated with PCa and HGPCa
采用ROC曲线分析将多参数模型的预测效力与常用临床参数PSA、PSAD进行比较(表3,图1)。结果显示,多参数模型对前列腺癌的预测效力AUC达到0.895(95%CI:0.878~0.913),显著高于PSAD(0.848,95%CI:0.826~0.869)和 PSA(0.775,95%CI:0.749~0.801)。对HGPCa的预测效力方面,多参数模型(0.872,95%CI:0.849~0.894)亦显著高于PSAD(0.807,95%CI:0.778~0.836)和PSA(0.775,95%CI:0.743~0.808)。在验证组中,前列腺癌的多参数预测模型的AUC达到0.846,HGPCa的多参数预测模型的AUC达到0.819,与建模组相似,均具有较高的预测价值。

表3 比较多参数预测模型、PSAD或PSA对前列腺癌与高级别前列腺癌的预测效力Tab 3 Comparison of multivariate prediction model,PSAD and PSA in predicting PCa and HGPCa
列线图构建与应用示例根据表2所示多因素Logistic回归模型,分别绘制针对前列腺癌(图2)与HGPCa(图3)的预测列线图。列线图直观易用,图左侧罗列各项临床特征,对标顶部计分栏目计算每项临床特征所对应的积分,各项积分相加后得总分,再次对标底部总分栏目所对应的预测风险值,即为前列腺癌及HGPCa的穿刺阳性预测值。此处对其使用进行示例:70岁患者,穿刺前PSA为20 ng/mL,PV 30 mL,DRE阴性,TRUS阳性。进行前列腺癌预测时,年龄对应积分为17.5,PSA对应积分为12,PV对应积分为88.5,DRE对应积分为0,TRUS对应积分为5,总计123分,对应穿刺结果为前列腺癌的预测值约为50%。进行HGPCa预测时,PSA对应积分为15,PV对应积分为88.5,DRE对应积分为0,TRUS对应积分为16.5,总计120分,对应穿刺结果为HGPCa的预测值约为18%。
讨 论
前列腺癌筛查的理想目标是尽早发现影响生存的高危疾病,同时尽可能避免不必要的穿刺。采用多参数预测模型可以更有效地预测穿刺结果,有助于医患沟通以及临床决策,从而提高穿刺获益。因此预测模型的建立在前列腺癌的诊治中具有重要价值。常见的预测模型包括分类树模型、列线图模型以及人工神经网络模型等。其中列线图模型因其信息损失少、简明易用的特点成为临床常用的多参数预测模型,其使用几何图形来表达数学回归模型,将预测指标间的交互或叠加作用直观呈现,可对每位患者进行个体化的风险计算。
近年来,PCPT风险计算器、ERSPC风险计算器等预测工具已在欧美各国广泛使用[4]。有学者基于瑞士穿刺人群建立了ProstateCheck风险计算器,具有更高的AUC[10]。然而由于建模人群的临床基线特征差异甚远,以上模型在我国人群中并未显示出很高的预测效力,限制了其在我国的广泛使用[7]。
本研究中,我们根据穿刺结果将研究人群分为非肿瘤组与前列腺癌组,并将前列腺癌组进一步分为LGPCa亚组与HGPCa亚组,将组间差异显著并具有独立预测作用的临床参数纳入多参数回归模型,并建立列线图。前列腺癌预测列线图纳入年龄、PSA、PV、DRE和TRUS等5项参数;HGPCa预测模型纳入PSA、PV、DRE和TRUS等4项临床参数。通过ROC曲线分析,前列腺癌和HGPCa多参数预测模型的AUC分别达到0.895和0.872,均显著高于临床常用的PSA与PSAD,在内部验证中同样具有较高的预测效力。本研究提出的列线图,具有参数易得、操作简便的特点,方便临床推广。
近来,越来越多的临床研究表明,磁共振-超声融合穿刺可以有效提高初次和再次穿刺阳性率,减少无效穿刺针数,降低穿刺后并发症发生率,是颇具前景的发展方向[11]。同时,基于p2PSA计算得到的前列腺健康指数(prostate health index,PHI)对于前列腺癌的预测价值得到广泛关注,有学者提出PHI是前列腺癌和HGPCa的独立预测因子,将PHI加入预测模型可以显著提高预测效力[12]。然而,由于我国医疗水平的不均衡,短期内尚无法全面推广诸如融合穿刺、p2PSA检测等新方法和新策略。此外,有学者提出将TRUS-5评分系统[13]、前列腺影像报告和数据系统第二版(prostate imaging reporting and data system version 2,PI-RADS v2)[14]纳入穿刺预测列线图,均具有较高的预测效力。以上方法将超声和磁共振的结果进行评级,较以往方法能够从检查结果中提取更多信息,但亦存在检查者主观评分不一致的风险。有研究在意大利穿刺人群中同时验证了PCPT、ERSPC、Chun、Kawakami和Karakiewicz 5种列线图预测模型,结果显示5种模型的预测效力均不理想[15]。我们认为,在背景不同的人群中需要谨慎使用列线图预测模型,同时应鼓励将种族、新型血清标志物、超声评分系统、多参数磁共振等作为独立参数纳入预测模型,并鼓励开展多中心研究交叉验证,进一步推动前列腺穿刺列线图的发展与迭代。
本研究尚存在不足,包括:(1)回顾性纳入主动就诊于我院门诊并接受穿刺的人群,存在选择偏倚;(2)部分临床信息未做记录,无法与现有PCPT、ERSPC等模型进行比较;(3)预测模型缺乏外部验证,有待进一步开展多中心研究。
综上,本研究基于我院前列腺穿刺人群,探讨了前列腺穿刺结果的相关预测因素,建立了前列腺癌与HGPCa穿刺预测列线图,具有较高预测效力,同时在现阶段的临床背景下具有实用易推广的特点。该列线图的应用将有助于医患直观高效沟通,并为科学制定个体化穿刺策略提供依据。
