HS-SPME与GC-MS联用分析食品中二甲基硒和二甲基二硒*
2020-02-09李兴宁张世博余以刚
龚 亮,李兴宁,张世博,熊 珺,余以刚
(1 华南理工大学食品科学与工程学院,广东 广州 510640;2 广东省东莞市质量监督检测中心, 广东 东莞 523808;3 华南理工大学化学与化工学院,广东 广州 510640)
完整的样品分析分为四步,即样品的采集、前处理、分析测定和数据处理及报告结果。统计数据表明,各步骤占全部分析时间的比列分比为6%、61%、6%和27%。由此看出,各步骤所需的时间相差很大,样品前处理所需的时间最长,约占整个分析时间的三分之二[1]。此外,样品的前处理是衔接样品采集和样品的分析测定,即有效的提取、净化和浓缩样品中待测成分并与后序的检测方法如光谱、色谱、电化学等相匹配的操作过程。可见,样品前处理是分析过程中最重要的一环,也是分析中最耗时、最复杂的一步,其质量对整个分析检测的速度和检测结果的准确性、精密度和可靠性影响极大。
近年来发展的新型样品前处理技术如固相微萃取(Solid phase microextraction,SPME)[2]、搅拌棒吸附萃取(Stir bar sorptive extraction,SBSE)[3]、毛细管微萃取(Capillary microextration,CME)[4]、超临界流体萃取(Supercritical fluid extraction,SFE)[5]、微波辅助萃取(Microwave assisted extraction,MAE)[6]和液相微萃取(Liquid phase microextraction,LPME)[7]等,大多朝着富集倍数大、绿色环保、简单易用、灵敏度高的方向发展,并通过与分析仪器的联用实现高效自动化分析。SPME萃取原理基于待测物质在样品及萃取涂层中平衡分配的萃取过程。SPME有两种萃取模式,其一是将萃取纤维头直接浸没在样品溶液中,即直接SPME;另一种是将萃取纤维头悬挂于样品溶液上空,萃取上方气相中的挥发性物质,称为顶空SPME(HS-SPME)。
气相色谱-质谱联用仪(Gas Chromatography-Mass Spectrometry,GC-MS)具有操作简单、分离度和选择性好、灵敏度高和分析速度快以及适用性强等优点,在痕量组分分析中得到广泛应用。本论文的研究目的是,以GC-MS为后续分离检测手段,系统研究挥发性有机硒在HS-SPME中的萃取行为,进而建立HS-SPME与GC-MS联用测定食品中挥发性硒化合物(二甲基硒(DMSe)和二甲基二硒(DMDSe))的新方法,并应用于实际样品的测定。
1 实 验
1.1 仪器装置及工作条件
Agilent 7890A型气相色谱仪-5975 C质谱联用仪(GC-MS);DB-5ms石英毛细管柱(30 m×0.25 mm×0.25 μm);SY1200超声仪,上海声源超声波仪器设备有限公司;85-2A型磁力加热搅拌器,江苏荣华仪器制造有限公司;A11型研磨仪,意大利IKA公司;手动固相微萃取进样器、复合50/30 DVB/CAR/PDMS固相微萃取头,美国Supelco公司;顶空样品瓶(20 mL)。
升温程序:初温35 ℃保持4 min,以15 ℃/min升至125 ℃保持5 min,以20 ℃/min升至240 ℃保持3 min;进样口温度为250 ℃;传输线温度280 ℃;进样分流比2:1的方式分流进样;使用高纯氦作为载气,在恒流模式下柱流量为1.1 mL/min;电离模式:能量为70 eV的电子轰击源;离子源温度为200 ℃。
扫描方式:采用全扫描和选择离子同时采集的扫描模式,二甲基硒的特征离子为m/z 80、91、95和110。选择不同的离子通道,以m/z 95作为DMSe定量离子,以m/z 80、90和110作为DMSe定性鉴别离子;二甲基二硒的特征离子为m/z 93、109、160、175和190。选择不同的离子通道,以m/z 190作为DMDSe定量离子,以m/z 93、109、160和175作为DMDSe定性鉴别离子。
1.2 试剂和标准溶液配制
DMSe和DMDSe标准品(东京化成工业株式会社,纯度大于98.0%)。用甲醇溶解稀释配制成10 mg/mL标准储备液,避光冷藏待用。实际工作溶液由标准储备液稀释,现配现用。甲醇、氯化钠以及其他试剂均为分析纯,实验室用水为超纯水(18.2 MΩ·cm,美国Millipore超纯水机制得)。
1.3 实验操作
DVB/CAR/PDMS固体微萃取头的老化:先将萃取头浸没在丙酮中,30 min后取出,然后将其放置在250 ℃下老化30 min,待用。
萃取步骤:将预处理好的样品溶液在室温25 ℃下恒温30 min,然后取15 mL于顶空瓶中,瓶中预先放入1.5 cm长的搅拌磁子,用特氟龙/硅胶隔垫密封后铝盖压紧封口,将顶空瓶放置于磁力搅拌器上。然后将预先老化好的固相微装置刺穿瓶盖内密封的隔垫,用夹子固定固相微萃取手柄,将纤维头推出,使其置于工作溶液液面中心处上方约1.0 cm处,开启搅拌器,在室温下萃取15 min后,取出萃取头后马上插入GC-MS的进样口,在250 ℃下解析5 min。SPME萃取手柄及微萃取头如图1所示。
1.4 样品的采集及前处理
饮用水、果汁、洋葱和大蒜购买于当地大型超市(东莞,中国)。液体样直接取15 mL置于顶空瓶中,按2.3步骤进行萃取和分析;洋葱和大蒜称取经研磨仪粉碎后的样品3.0 g加超纯水定容至15 mL,于超声仪中超声10 min后立刻按2.3步骤进行萃取和进样分析。
2 结果与讨论
2.1 顶空萃取条件的优化
在固相微萃取中,萃取时间、搅拌速率、样品体积、萃取温度和体系中的离子强度等因素都可能对目标分析物的萃取效率产生影响。因此,通过对以上各因素进行考察以确定最佳的萃取条件。
2.1.1 萃取时间
实验中考察了萃取时间在2~30 min范围内对DMSe和DMDSe萃取效率的影响,结果见图2。
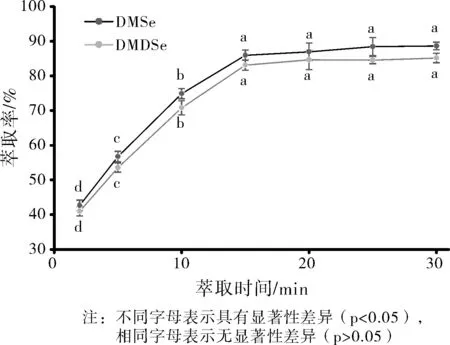
图2 萃取时间对分析物萃取效率的影响
由图2萃取率随时间的变化趋势可知,在2~15 min内,DMSe和DMDSe的萃取效率随萃取时间的增加而迅速增大;当继续延长萃取时间至30 min,DMSe和DMDSe的萃取效率缓慢提高;15 min、20 min、25 min、30 min四个萃取时间之间无显著性差异(p>0.05),并与其它时间2 min、5 min、10 min均有显著性差异。综上分析,在非平衡态微萃取中,萃取时间是影响分析物萃取效率的重要因素。因此,兼顾分析效率,选择15 min 作为HS-SPME的萃取时间。
2.1.2 搅拌速率
实验中考察了搅拌速率(200~1200 rpm)对DMSe和DMDSe萃取效率的影响,结果见图3。

图3 搅拌速率对分析物萃取效率的影响
由图3萃取率随时间的变化趋势可知,DMSe和DMDSe萃取效率随搅拌速度的增大先显著提高后趋于平缓。除搅拌速率为1000 rpm与1200 rpm之间无显著性差异外(p>0.05),其他各转速之间萃取率差异显著(p<0.05)。在对挥发性物质的顶空微萃取中,搅拌速率的增加,有利于加速其挥发,从而缩短达到萃取平衡的时间,提高萃取效率和分析速度。结合磁力搅拌器的性能,为获得更稳定的萃取效果,实验选用1200 rpm作为萃取DMSe和DMDSe搅拌速率。
2.1.3 样品体积
在样品瓶总体积为20 mL的条件下,实验考察了样品体积分别为3、6、9、12、15 mL时对DMSe和DMDSe萃取效率的影响,结果见图4。
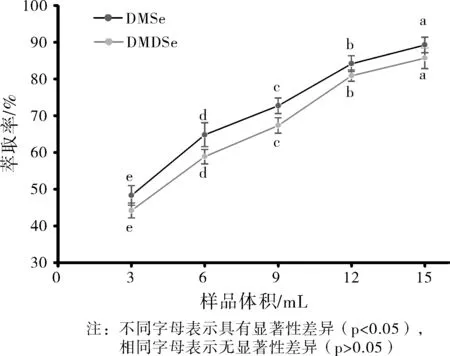
图4 样品体积对分析物萃取效率的影响
结果表明,DMSe和DMDSe的萃取效率随样品体积的增加而显著升高,样品各体积之间的萃取效果均具有显著性差异(p<0.05)。采用顶空进样时,进样瓶总体积固定,水相体积占比越大,空气相占比越小,液/气相比升高,挥发性的待测分析物在顶空气相浓度增大,从而更易于被萃取。因此,后续实验中选择样品溶液体积为15 mL。
2.1.4 萃取温度
实验中考察了萃取温度(25~50 ℃)对分析物萃取效率的影响,结果见图5。
结果表明,萃取温度的改变对DMSe和DMDSe的萃取效率无明显的变化,萃取温度在25~50 ℃之间无具有显著性差异(p>0.05)。通常萃取温度也是影响分析物萃取效率的重要因素之一,在HS-SPME的动态萃取中,萃取温度既影响待测物在萃取纤维上的吸附速度,同时对其在萃取纤维上的解吸速度也有影响;但是,温度升高时,具有挥发性的待测组分的气水分配系数也会降低。因此根据试验结果,选择在25 ℃室温下对DMSe和DMDSe进行HP-SPME。
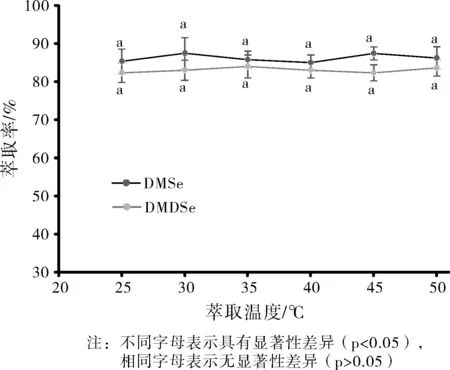
图5 萃取温度对分析物萃取效率的影响
2.1.5 离子强度
除上述因素外,待测物的萃取效率还受溶液离子强度的影响。实验考察了氯化钠含量分别为0、5%、10%、15%、20%时对DMSe和DMDSe萃取效率得影响,结果见图6。
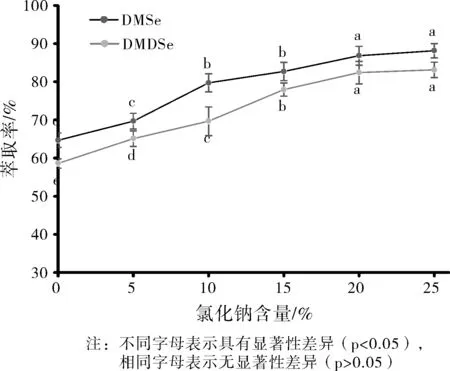
图6 离子强度对分析物萃取效率的影响
由图6萃取率随离子强度的变化趋势可知,DMSe和DMDSe的萃取效率随样品中氯化钠含量的增大先显著上升后趋于平缓,氯化钠含量在0~20%之间对萃取效率有显著性影响(p<0.05),氯化钠含量为20%与25%之间已无显著性差异(p>0.05)。在水溶液中,随着离子强度的增加,目标分析物DMSe和DMDSe在水中的溶解度降低,因此升高气水分配系数,从而有利于增加在空气相的浓度。综上分析,为获得良好的萃取效率,选择样品溶液含20%氯化钠的离子强度下进行HS-SPME。
2.2 分析性能
通过上述实验的优化,最佳HS-SPME萃取条件为:移取15 mL的样品溶液于20 mL顶空瓶中,加入3.0 g的氯化钠和搅拌磁子,密封样品瓶,在室温下恒温放置0.5 h。然后将含有DVB/CAR/PDMS萃取纤维的萃取手柄刺穿样品瓶瓶盖,推出纤维头,并使其悬挂在样品溶液中心上方1 cm处,并将样品瓶放置于磁力搅拌器上。开启搅拌器,1200 rpm的搅拌速率搅拌样品溶液,萃取15 min后,取出萃取头后立即插入GC-MS的进样口,在进样口温度250 ℃下解析5 min。在此萃取条件下,以三倍的信噪比为方法的检出限,本方法的分析性能如表1所示。可见,本方法对DMSe和DMDSe的检出限分别为0.0570 μg/kg和0.0132 μg/kg,相对标准偏差(RSDs,n=7)为8.5%和7.1%。

表1 方法的分析性能
注:DMSe和DMDSe的浓度:0.80 μg/kg,0.20 μg/kg
2.3 实际样品分析
将所建立的HS-SPME-GC-MS方法应用于饮用水、果汁、大蒜、洋葱等食品中的挥发性有机硒的测定。从表2可以看出,蒸馏水、矿泉水、橙汁和葡萄汁中均未检出DMSe和DMDSe,洋葱中检出DMSe,其含量为2.08 μg/kg,大蒜中检出了DMSe和DMDSe,其含量分别为4.87 μg/kg和0.25 μg/kg,对样品进行加标回收,其加标回收率为88.6%~102.5%,相对标准偏差(RSDs,n=3)为7.1%~9.4%。
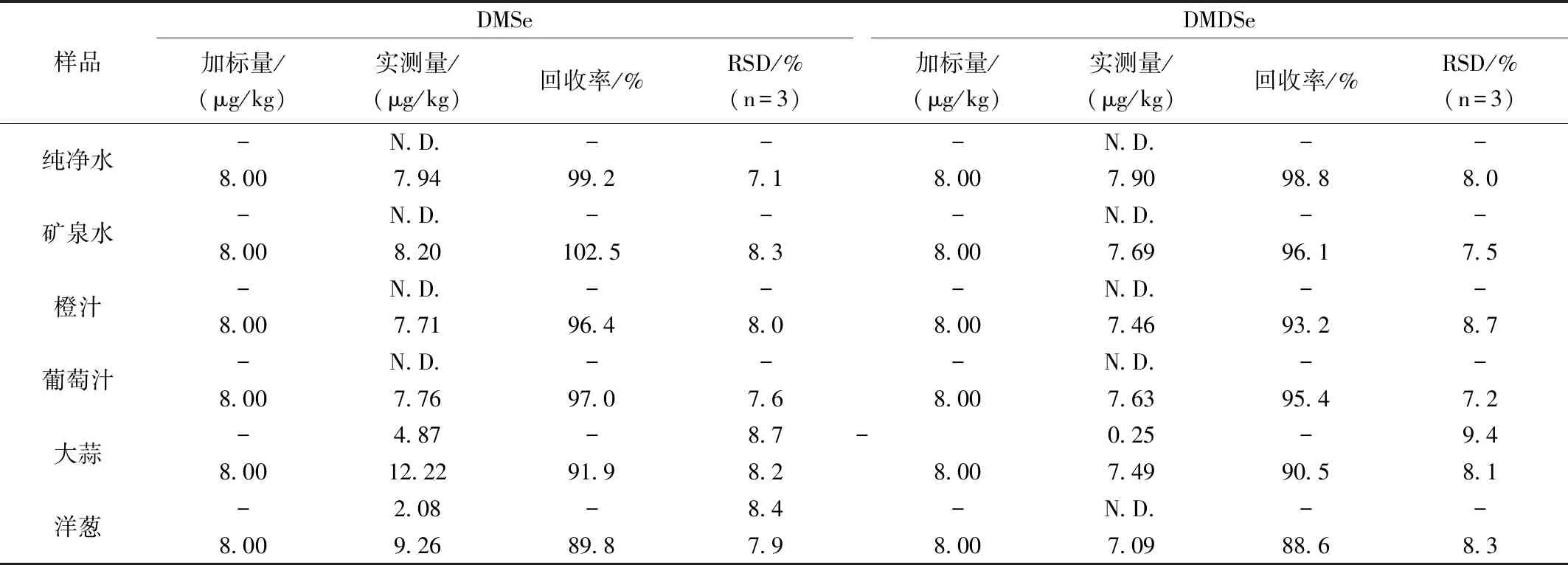
表2 样品分析
注:N.D.表示未检出。
3 结 论
(1)以二乙烯苯-碳分子-聚二甲基硅氧烷为固相微萃取的吸附涂层,通过优化萃取时间、萃取温度、搅拌速度、离子强度等萃取因素,建立了顶空固相微萃取与气相色谱-质谱联用测定食品中挥发性有机硒(DMSe和DMDSe)的新方法。该方法对DMSe和DMDSe的检出限分别为0.0570 μg/kg和0.0132 μg/kg,相对标准偏差(RSDs,n=7)为8.5%和7.1%。
(2)将本方法应用于饮用水、果汁、大蒜和洋葱等食品中的DMSe和DMDSe的分析并进行加标回收,其中洋葱中检出DMSe为2.08 μg/kg,大蒜中检出了DMSe和DMDSe分别为4.87 μg/kg和0.25 μg/kg,加标回收率在88.6%~102.5%,相对标准偏差(RSDs,n=3)7.1%~9.4%,适用于食品中挥发性有机硒的测定。
