非酒精性脂肪性肝炎大鼠模型的建立及其胰腺、肾脏的组织学病理变化
2020-02-09宋清莲谭玉娥刘京京袁贝贝贺礼琴戴光荣
宋清莲,谭玉娥,刘京京,袁贝贝,李 敏,贺礼琴,戴光荣
延安大学附属医院 消化内科,陕西 延安 716000
非酒精性脂肪肝病(NAFLD)是一种与肥胖、2型糖尿病密切相关的代谢性肝损伤疾病[1]。近年来,NAFLD发病率逐年上升,它不仅累积肝脏本身损害,而且还涉及肝外脏器损害[2],其带来的经济负担逐年上升[3]。美国一项最新大规模前瞻性研究[4]表明,确诊为NAFLD的肥胖患者与90%的恶性肿瘤相关,其中与肝癌最为密切,胰腺癌次之。因此早期发现疾病危险因素并干预对患者肝外并发症的发生至关重要。目前国内外有关非酒精性脂肪性肝炎(NASH)肝外相关脏器病理改变报道较少,本文通过成功构建NASH大鼠模型,观察胰腺和肾脏病理组织学变化情况。
1 材料与方法
1.1 实验动物 4~5周龄SD雄性大鼠20只,SPF级,体质量80~120 g,购买于西安交通大学医学部实验动物中心,许可证编号:SCXK(陕)2018-001。在西安交通大学医学院实验动物中心分笼饲养,自由饮食饮水,置于室温 18~22 ℃、湿度 45%~65%的受控条件下,光照和黑暗各 12 h 模拟昼夜交替的清洁动物房内。 本研究方案经由西安交通大学动物实验伦理委员会审批(批号:XJTULAC2019.993),符合实验室动物管理与使用准则。
1.2 动物分组及建模 所有SD大鼠适应性饲养1周后,将20只SD大鼠中的6只首先按完全随机配对分配到观察组(B组),然后将剩下的14只按体质量配对成7个区组,最后将每个区组中的1只大鼠按随机数字表分配到实验组(C组),其余7只为对照组(A组)。B组和C组给予高脂饮食,A组给予普通饮食。B组于实验第4、8、12周各处死2只,提取肝组织用4%中性甲醛溶液固定、常规脱水、石蜡包埋、切片并染色,显微镜下观察肝脏病理切片是否达到NASH,第12周末NASH建模成功(提示C组建模成功)。
1.3 饲料与配方 高脂饮食配方:81.8%普通饲料+2.5%胆固醇+0.5%胆酸钠+10%猪油+5%蛋黄+0.2%丙基硫氧嘧啶;普通饲料和高脂饲料均购买于上海将来实业股份有限公司生产,批号:JL20180925312E。将普通饲料和高脂饲料混合均匀后压制成条,59 ℃烘干。
1.4 主要材料与试剂 鼠抗大鼠Desmin抗体(Servicebio)、大鼠ALT Elisa试剂盒、AST Elisa试剂盒、GGT Elisa试剂盒、甘油三酯(TG)Elisa试剂盒、总胆固醇(TC)Elisa试剂盒、低密度脂蛋白(LDL)Elisa试剂盒(上海将来实业股份有限公司),葡萄糖(GLU)Elisa试剂盒(上海将来实业股份有限公司),胰岛素(INS)Elisa试剂盒(上海将来实业股份有限公司),成像系统(日本尼康)。
1.5 样本收集与处理 实验第4、8、12周末各随机抽取B组2只大鼠禁食不禁水12 h后处死,抽取约5~8 ml下腔静脉血,以3000 r/min离心5 min,离心出血清储存在-80 ℃冰箱,测血清 ALT、AST、GGT、TG、LDL、TC、GLU、INS水平;迅速完整分离出肝脏,肉眼观察肝脏大体形态及颜色,取肝脏组织固定,常规脱水,石蜡包埋,HE染色;第12周末B组大鼠建模成功,禁食12 h后处死A组和C组全部大鼠,血样处理同B组第4、8周末;取肝脏、胰腺、肾脏组织固定,常规脱水,石蜡包埋,制作病理切片,HE染色观察肝细胞、腺泡细胞以及胰岛变化情况,PAS染色和免疫组织化学desmin蛋白染色观察肾小球和足细胞变化情况。由经验丰富的2名病理医师通过光学显微镜进行双盲性观察。每张肝组织HE切片随机进行5个视野观察,并对肝组织脂肪变、炎症程度、气球样变评分。其中,肝组织的脂肪变诊断参考《非酒精性脂肪性肝病中西医结合诊疗共识意见(2017年)》[5]进行NAFLD活动度积分(NAS)和肝纤维化分期。
1.6 检测指标和方法 血液在室温下自然凝固10~20 min并离心约20 min(2000~3000 r/min)。收集上清液,按ALT、AST、GGT、LDL、TG、TC、GLU、INS Elisa 试剂盒说明进行操作,计算胰岛素抵抗指数HOMA-IR,HOMA-IR=GLU×INS/22.5。
1.7 Desmin蛋白表达测定 采用免疫组化平均光密度值半定量分析方法测定desmin蛋白在肾脏表达水平:每组内每张切片随机挑选3个400倍视野进行拍照。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD)以及组织的像素面积(AREA)。并求出平均光密度值(average optical, AO值),AO=IOD/AREA,AO值越大表明阳性表达水平越高。
1.8 统计学方法 采用SPSS22.0统计软件进行数据分析。计量资料以±s表示,2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠血清生化指标变化 C组大鼠血清ALT、GGT、TG、TC、LDL、GLU、INS、HOMA-IR水平及肝脏病理评分均高于A组,差异均有统计学意义(P值均<0.05)(表1)。
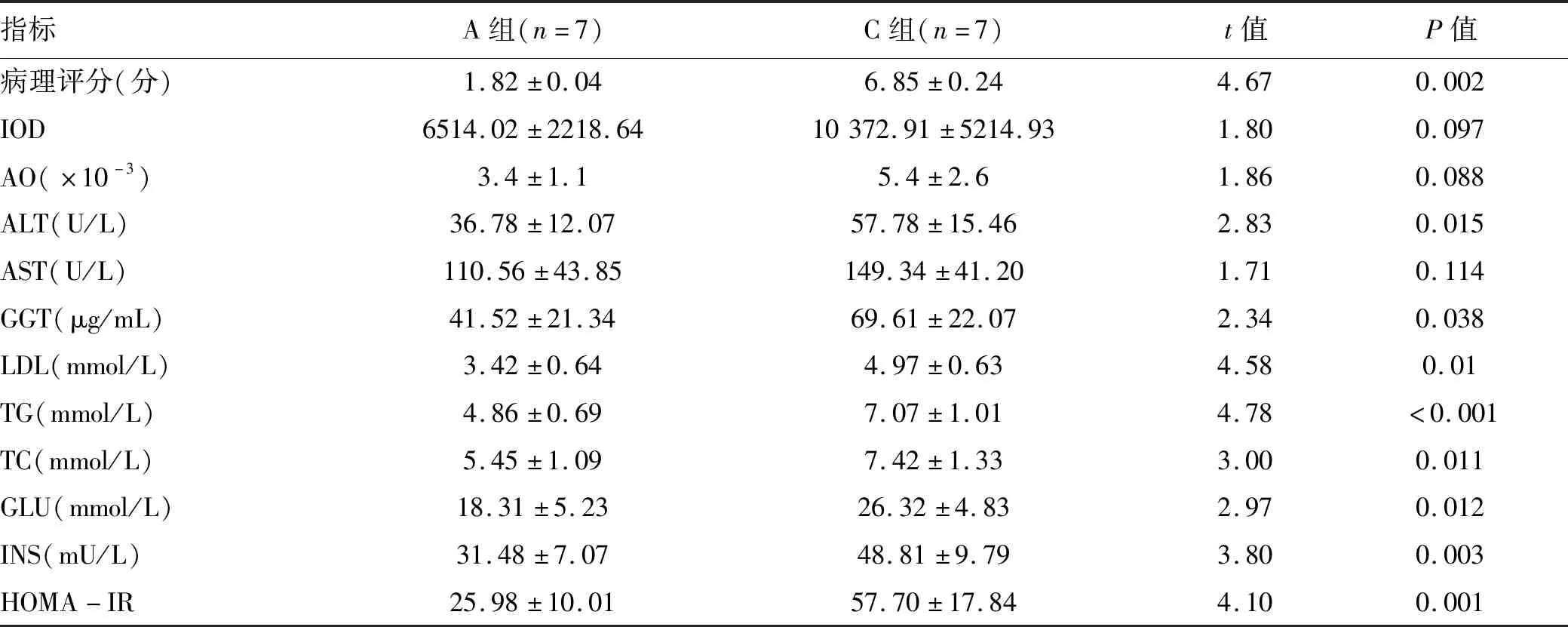
表1 A组与C组各项指标的比较
2.2 NAFLD大鼠脏器病理改变
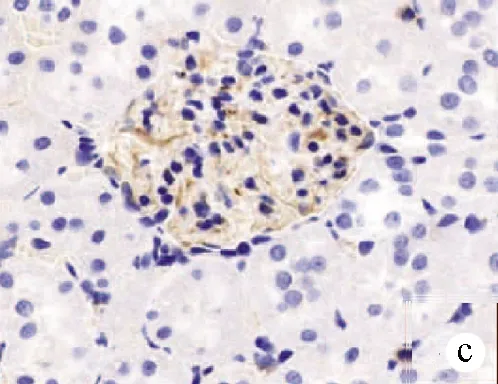
2.2.1 肝脏组织病理学变化 A组第12周末:肝小叶结构完整清晰,肝细胞沿中央静脉呈放射状整齐排列,肝细胞形态规则,细胞之间界限清楚,肝细胞核居中,胞浆内未见脂肪空泡,汇管区无炎症细胞浸润(图1a);B组第4周末:肝小叶结构仍可见,部分肝细胞胞浆内出现较小的脂肪空泡,汇管区无明显炎症细胞浸润(图1b);B组第8周末:肝小叶结构部分消失,大部分肝细胞胞浆内出现大小不等的脂肪空泡,细胞之间界限模糊不清,肝窦变窄,汇管区逐渐出现炎症细胞浸润(图1c);C组第12周末:几乎全小叶内出现肝细胞脂肪变性,胞浆内可见较大脂肪空泡,汇管区可见大量炎症细胞(图1d)。
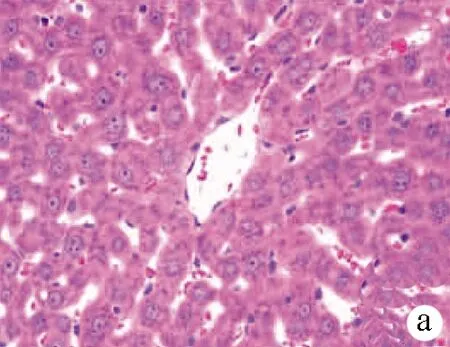
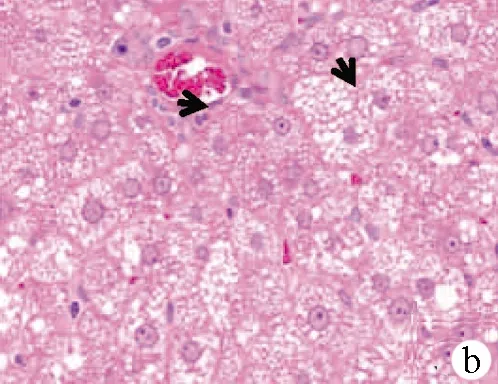


注:a,A组第12周末;b,B组第4周末,箭头所示:肝细胞轻度脂肪变,胞浆内可见小的脂肪空泡,汇管区无明显炎症细胞浸润;c,B组第8周末,箭头所示:肝细胞中度脂肪变,胞浆可见大小不等的脂肪空泡,细胞界限不清,汇管区可见炎症细胞浸润;d,C组第12周末,箭头所示:肝细胞严重脂肪变,肝细胞胞浆内可见大泡性脂肪空泡,汇管区可见大量炎症细胞浸润。
图1肝组织病理图片(HE染色,×400)
2.2.2 肾脏组织病理学变化 A组第12周末:肾小球毛细血管基底膜完整清晰,无增厚,肾小球毛细血管袢呈分叶状,系膜区无增生,肾小球囊腔清晰,肾小管上皮细胞排列整齐,管腔清晰可见(图2a);C组第12周末:PAS染色阳性物质明显增多,肾小球体积增大,肾小球囊腔变窄;肾小球毛细血管基底膜增厚,系膜区增生明显;肾小管上皮细胞肿胀,管腔狭窄(图2b)。
正常情况下,desmin仅在系膜细胞少量表达,在足细胞不表达,当肾小球受到各种损伤因素刺激时,desmin发生表型转化并大量表达。 图像分析结果显示,肾小球足细胞Desmin蛋白表达增强(图2c、d)。
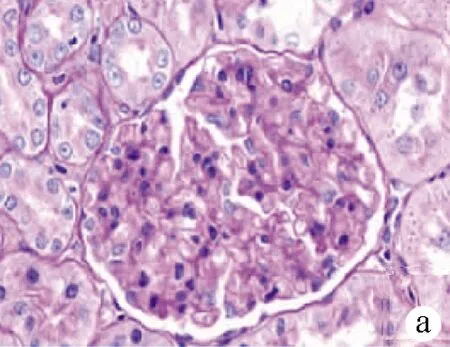

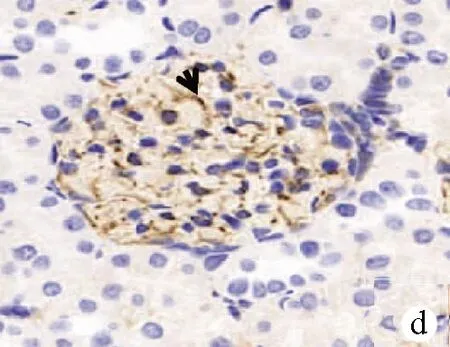
注:a,A组第12周末(PAS,×400);b,C组第12周末(PAS,×400),箭头所示:PAS染色阳性物质明显增多;肾小球毛细血管基底膜增厚,系膜区增生明显;肾小球体积增大,球囊变小;肾小管上皮细胞肿胀,管腔狭窄;c,A组第12周末(Desmin蛋白,×400);d,C组第12周末(Desmin蛋白,×400),箭头所示:肾小球可见Desmin蛋白(棕黄色阳性物质)表达增多。
图2肾脏组织病理图片
2.2.3 胰腺组织病理学变化 A组第12周末:胰腺腺泡及胰岛结构完整,腺泡细胞及胰岛细胞排列整齐,未见炎症细胞浸润。C组第12周末:胰腺腺泡细胞开始出现凋亡,萎缩,胰岛细胞未见异常(图3a、b)。


注:a,A组第12周末;b,C组第12周末,箭头所示:腺泡细胞开始出现凋亡,萎缩,胰岛细胞未见异常。
图3胰腺组织病理图片(HE染色,×400)
3 讨论
NAFLD的特征在于脂肪在肝细胞中以含有TG的脂滴形式积累。以TG这种形式积聚被认为是发挥脂毒性之前对机体的一种保护方式。当TG的大量积聚超过肝脏代谢能力时会引发肝脏一系列氧化应激和炎症反应。NAFLD时肝脏脂质代谢产物增多(如二酰甘油、棕榈酸酯、神经酰胺等)损伤肝细胞,并激活炎症细胞通路(如内质网应激、氧化应激等),使炎症级联反应放大,导致NAFLD向NASH转化进而促进疾病发展[6]。可见,氧化应激和炎症反应是脂毒性的重要结果。对转氨酶的分析,转氨酶异常提示肝脏的炎症反应及损伤程度。由于ALT主要存在肝细胞胞浆内,当肝脏发生炎症、坏死等损害使肝细胞膜通透性改变时,ALT从细胞内溢出到血液中。本研究发现C组ALT明显高于对照组(P<0.05),说明C组大鼠肝细胞受到了严重损害,考虑与NAFLD时血浆游离脂肪酸增加,脂肪酸β氧化也相应增加,其代谢产物的增多以及炎症介质的释放,触发丝裂原活化蛋白激酶通路和核转录因子NF-κB通路活化[7],启动细胞传导通路,出现氧化应激反应,导致肝细胞功能受损甚至坏死,而坏死的细胞进一步使炎症细胞侵入肝实质,进而导致NASH发生有关。因此,氧化应激是NASH的主要驱动力之一。正常情况下,当肝细胞受损时,ALT首先释放入血,当肝细胞严重损伤,危及线粒体时,AST也释放入血。当AST增高超过ALT时,提示病变的慢性化和进展性[8]。本研究发现C组AST高于A组,但无统计学差异,但同时发现AST水平明显高于ALT,提示疾病可能向肝硬化方向进展。GGT 是在肾脏、胰腺、肝脏、脾脏等组织中发现的微粒体酶,肾内含量最多,其次是胰腺和肝脏[9]。生理条件下,血清中GGT是谷氨酰循环中的关键酶,主要来源于肝脏内的肝内胆管上皮和肝细胞胞浆[10],参与谷胱甘肽的代谢。本研究发现C组大鼠的血清GGT水平明显升高(P<0.05),表明肝细胞受到了严重损害,考虑与血浆游离脂肪酸增多,使活性氧产生增多,从而促使肝细胞膜通透性改变,致使肝细胞受损有关。对血脂的分析,本研究发现C组SD大鼠与A组大鼠相比,C组TG、LDL、TC均明显高于A组(P值均<0.05),提示脂质代谢紊乱,考虑原因为过度高脂饮食摄入使肝脏内脂质过多积聚,脂肪组织的再分解或合成的游离脂肪酸增多,肝脏脂类代谢能力进一步减弱,导致肝脏发生炎症坏死甚至纤维化;另外,由于高血糖可以促进新生脂肪的生成以及胰岛素通过激活转录因子固醇调节元件结合蛋白1c调控新生脂肪生成[11],提示作为NAFLD主要发病机制之一的胰岛素抵抗,也可能参与了脂质代谢紊乱。
最新一项队列研究[12]表明,NAFLD能促进晚期慢性肾脏病的进展。本研究发现高脂饮食所致的NASH模型影响大鼠肾脏组织学改变。本研究发现C组大鼠与A组大鼠相比,PAS染色显示肾小球体积增大,肾小球毛细血管基底膜增厚,系膜区增生明显,肾小管上皮细胞肿胀,管腔狭窄;可能与致动脉粥样硬化性血脂异常导致肾脏内皮细胞功能障碍和肾脏血管损伤有关,至于是否与足细胞胰岛素抵抗以及氧化应激有关今后仍需进一步的研究证实。其次,低密度脂蛋白氧化产生的氧化低密度脂蛋白有细胞毒性作用[13],会刺激系膜细胞增生,损伤肾脏内皮细胞,增大细胞通透性,增加细胞基质的分泌,渐而出现肾小球硬化,最终成为慢性肾脏病发生发展基础。C组大鼠与A组大鼠相比,免疫组化Desmin蛋白表达增加,但无统计学差异。由于正常肾脏几乎不表达Desmin蛋白,只有少数系膜基质表达;当肾小球足细胞受损时,Desmin蛋白表达明显增加。因此,Desmin蛋白为足细胞损伤的标志蛋白之一[14]。既往研究[15]表明,肾脏足细胞是胰岛素的敏感细胞,胰岛素抵抗会导致肾脏结构及功能障碍。一方面,胰岛素对肾小管有保钠作用,高胰岛素血症时,通过激活肾素-血管紧张素-醛固酮系统、交感神经系统促进肾脏血流动力学改变继而导致肾脏损害[16]。另一方面,足细胞通过胰岛素信号传导通路维持肾脏功能,Saleem等[17]研究发现,敲除小鼠足细胞胰岛素特异性受体会导致蛋白尿和肾小球硬化。所以,猜测胰岛素抵抗可能参与本研究足细胞损伤过程。由于国内外相关文献报道较少,仍需大量体外实验及动物实验证据支持。肾脏的组织学活检对明确二者之间关系提供一定帮助,可进一步阐述其具体发病机制,进而为临床医生提供新思路。
“脂肪胰” 以胰腺脂肪浸润或脂肪变为主要表现,近年来逐渐成为学者们关注的热点。最新研究[18]表明,利用3-T磁共振成像,质子密度脂肪分数可以较好的评价胰腺脂肪含量,并且是一种极具应用前景的可以预测胰腺脂肪含量与胰腺癌之间关系的影像学检查。与NAFLD相比,脂肪胰的病理生理机制尚不明确。相关研究[19-20]表明,NAFLD和非酒精性脂肪胰与肥胖密切相关,且常常并存。Wang等[21]通过一项大规模横断面研究,首次发现调整肥胖、相关心血管危险因素等后,NAFLD仍与脂肪胰独立相关。也有研究[22]发现,脂毒性可能直接介导胰腺腺泡细胞及胰岛细胞病变,致使胰腺内外分泌障碍。本研究发现高脂饮食所致的NASH模型可导致大鼠胰腺腺泡细胞凋亡、萎缩,甚至坏死,尚未见明显脂肪浸润,胰岛细胞未见明显病变。本研究发现C组SD大鼠与A组大鼠相比,C组GLU、INS、HOMA-IR均明显高于A组(P值均<0.05),再次证实胰岛素抵抗参与NAFLD发病机制。由于组织学表现胰岛细胞未见明显病变,可见胰岛素抵抗参与发病并不是胰腺直接作用。本研究尚未发现胰腺脂肪浸润,可能由于脂肪胰建模时间比NASH更长。对于脂肪胰与胰岛细胞功能之间关系目前尚无定论[23-24],是否与胰岛素抵抗有关今后仍需大量研究进一步证实。
综上所述,NAFLD可导致肝外脏器如肾脏、胰腺病变,为此不仅要重视肝脏本身病变,也要重视肝外脏器损伤,这对于预防NAFLD潜在的并发症至关重要。
