辅助性T淋巴细胞17/调节性T淋巴细胞比值失衡在免疫性肝损伤大鼠模型中的变化特点
2020-02-08毛小荣
薛 苗,毛小荣,陈 红
兰州大学第一医院 a.风湿免疫科; b.感染科,兰州 730000
自身免疫性肝炎(AIH)是由自身免疫介导的主要破坏肝脏实质的炎症性肝损伤,是一种影响全世界各种族和年龄段人群的严重肝病[1]。其临床表现多样,早期诊断极为困难。建立简单易行、稳定可靠的AIH模型,为进一步阐明AIH病因及引起肝细胞损伤的机制提供良好的实验基础[2]。
介导一系列炎症反应的辅助性T淋巴细胞(Th)17和介导免疫耐受的调节性T淋巴细胞(Treg)是与Th1、Th2细胞完全不同的CD4+T淋巴细胞系,其具有独立的分化和调节机制[3-4]。两者在功能和分化过程中相互拮抗,正常情况下保持平衡,有利于机体免疫稳定状态的维持,若两者失衡就会产生一系列免疫病理反应[5]。研究[6-8]表明,Th17/Treg及其失衡是免疫性肝损伤过程中的重要影响因素,也很有可能成为免疫治疗相关疾病辅助治疗的新靶点。
1 材料与方法
1.1 实验动物 6~8周龄健康清洁级雌性Wistar大鼠,体质量(200±20) g,购于兰州大学医学院动物实验中心,饲养于兰州大学实验动物中心,室温保持在(22±2)℃,相对湿度54%左右,自由进食、饮水。适应性饲养1周后,根据随机数字表法分组。本研究方案经由兰州大学第一医院实验动物伦理委员会审批(批号:LDYYLL2019-226),符合实验室动物管理与使用准则。
1.2 主要仪器、药品和试剂 AU5831型全自动生化分析仪(贝克曼库尔特,美国),Leica CM1900 石蜡切片机、摊片、烘片机(德国 Leica 公司),Olympus光学显微镜(日本),FACSAria流式细胞仪(美国 BD公司);刀豆蛋白A(ConA)白色冻干粉( sigma公司,美国C2010),α-galcer(AXXORA公司,美国M0123-M005);免疫组化试剂盒(福州迈新kit0013),流式相关抗体及破膜剂(ebioscience公司,美国)。
1.3 建模和收集标本 将30只雌性Wistar 大鼠随机分为3组,每组10只,标记为健康对照(HC)组、急性模型 (AC) 组和慢性模型(CC) 组。ConA溶于无菌生理盐水,现配现用,CC组按照12.5 mg/kg剂量尾静脉注射6周,1次/周,HC组和AC组尾静脉注射等量的生理盐水。第7周AC组按照40 μg/kg剂量单次尾静脉注射α-galcer盐水溶液,10 h后建模成功,处死。每组大鼠建模成功后,用水合氯醛麻醉,腹主动脉处取血,收集于促凝管中血液静置后离心取血清-20 ℃冰箱保存备用,收集于抗凝管中的全血及时检测 Th17、Treg 细胞频率;取血后取下脾脏,除去包膜,用预先冷却的生理盐水冲洗干净,剪成碎块、充分研磨,脾脏细胞悬液上流式细胞仪检测脾脏中Th17、Treg 细胞频率;取肝脏组织用中性福尔马林固定。
1.4 肝脏生化指标检测 α-Galcer注射10 h 后,腹主动脉取血3~5 ml,室温静置30 min,3500 r/min,离心10 min,血清放入EP管中,-20 ℃备用。血清ALT和AST等生化指标使用兰州大学第一医院全自动生化分析仪检测。
1.5 肝脏病理组织学检查 将大鼠麻醉处死后,取出肝脏,用预冷生理盐水冲洗3遍,用滤纸拭干。将肝组织切块置于10%福尔马林溶液中常温固定48 h以上,经过一系列水洗、乙醇系列梯度脱水、透明、浸蜡、包埋后,切成厚度为4 μm的切片。将切片置于60 ℃烤箱中1 h,经过脱蜡、酒梯度脱水、苏木精-伊红染色、酒精梯度脱水、透明后,用中性树胶进行封片。在光学显微镜下观察各实验组肝组织的病理学改变。
1.6 Th17细胞(CD4+IL-17+)的流式细胞术检测 在编号的试管中加入相应大鼠0.5 ml 抗凝全血和 0.5 ml 脾细胞悬液,每管中各加入适量用1640细胞培养基稀释后 PMA/Ionomycin/ BFA/Monensin Mixture混匀后放置于培养箱中(37 ℃,7%CO2)进行细胞刺激,4 h后将细胞悬液从培养箱中转移至5 ml EP管中,2500 r/min离心5 min,弃上清,PBS溶液冲洗2次。然后加入5 μl FITC-抗CD4,室温避光孵育15 min,离心,弃上清;加100 μl MEDIUMA,室温孵育15 min,加入3 ml的PBS溶液,1000 r/min离心5 min,弃上清,涡旋振荡,使残留的液体重悬细胞沉淀,AC组和CC组加入100 μl MEDIUMB和20 μl PE-抗IL-17,对照组加入100 μl MEDIUMB和 10 μl PE-IgG1作为同型对照,室温下避光反应 30 min,PBS溶液洗涤2次,1000 r/min离心 5 min,弃上清,用0.3 ml PBS将细胞沉淀重悬,于30 min内上机检测 Th17 细胞的比率。
1.7 Treg细胞 (CD4+CD25+Foxp3+)的流式细胞术检测 在编号的试管中加入相应大鼠0.5 ml抗凝全血和0.5 ml脾细胞悬液,每管加入5 μl FITC抗大鼠CD4单克隆抗体和5 μl APC-抗大鼠CD25单克隆抗体,室温避光孵育 20 min,每管加入适量稀释后RBC Lysis Buffer并混匀,室温避光反应10 min,观察溶液透亮后1000 r/min离心5min,弃上清。加入3 ml PBS溶液洗2次,1000 r/min离心5 min,弃上清,加入1 ml新鲜制备的eBioscience Fixation/Permeabilization应用液,混合均匀后室温避光孵育30 min,1000 r/min离心5 min弃上清,加2 ml Permeabilization Buffer洗涤后按照上一步骤离心,弃上清,AC、CC两组分别加入 5 μl PE-Foxp3 抗体,HC组加入 5 μl PE-IgG2b单克隆抗体作为同型对照,室温避光孵育30 min。用 3 ml Permeabilization Buffer洗 1次,同上一步骤离心,弃上清,用 0.3 ml PBS 将细胞沉淀重悬,于30 min内上机检测 Treg细胞的比率。
1.8 免疫组化法观察相关蛋白表达水平 将肝组织石蜡切片置于60 ℃烤箱 1 h后依次经二甲苯脱蜡、系列浓度乙醇水化,PBS 洗 3次后置于柠檬酸钠缓冲液中煮沸3 min进行抗原修复,3%双氧水和山羊血清各封闭20 min,一抗孵育,4 ℃过夜。次日复温20 min后PBS洗3次,二抗(生物素标记的羊抗兔IgG)孵育20 min,PBS洗3次。 三抗 (辣根酶标记的链酶亲和素)孵育,37 ℃ 20 min,PBS洗3次。DAB显色,镜下观察结果。苏木精复染5 min,自来水冲洗片刻,1%的盐酸酒精(75%)溶液分化30 s,自来水冲洗5 min反蓝。依次经过70%、 80%、90%、 95%、无水乙醇各5 min,二甲苯5 min,3次进行脱水。最后用中性树胶封片。以上操作完成后显微镜下观察Foxp3、RORγt蛋白表达水平。
1.9 统计学方法 采用 SPSS22.0统计学软件进行数据处理。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 AC组、HC组大鼠活泼好动,反应灵敏,饮食良好;CC组大鼠造模2 d开始出现精神萎靡,活动少,摄食摄水减少,反应迟钝。各组大鼠均无死亡。
2.2 肝脏生化指标检测 与 HC 组相比,AC、CC组的血清ALT、AST、TBil水平均明显升高(P值均<0.05),血清Alb水平明显降低(P值均<0.05);与AC组相比,CC 组ALT、 TBil水平明显升高(P值均<0.05)(表1)。
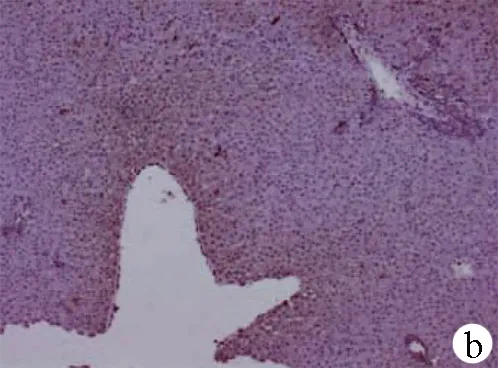
2.2 肝脏病理切片镜下观察 HC组显示肝细胞排列整齐,肝小叶结构完整,表现为基本正常的肝脏组织,AC组肝脏组织镜下表现为肝小叶坏死为主,炎性细胞浸润,轻度肝窦扩张,大片状坏死。CC组镜下可见汇管区炎症反应为主,肝细胞水肿,大量淋巴细胞浸润,胆管反应,界面性肝炎(图 1)。

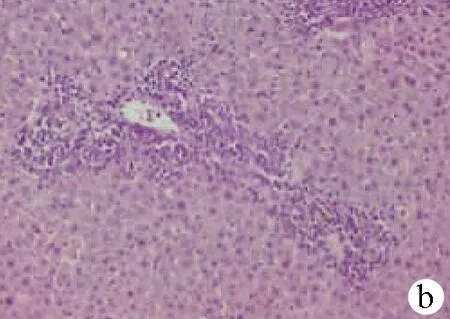
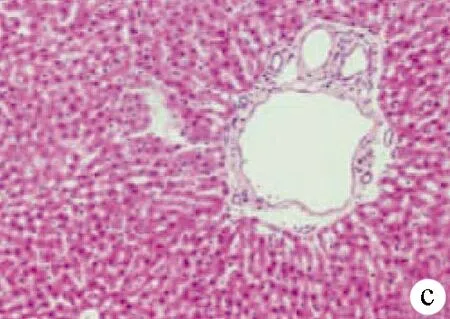
注:a,AC组;b,CC组;c,HC组。
图1各组大鼠肝脏组织镜下表现(HE染色,×200)
2.3 大鼠肝脏组织中相关蛋白的表达 ROR-γt和Foxp3在3组大鼠肝脏中均有表达。细胞质、核质、细胞膜、核膜弥散分布,染色强度各不相同。在显微镜下定量分析免疫组织化学结果累积光密度(IOD)和阳性面积,与 HC组相比,AC组 Foxp3表达水平明显降低,而RORγt蛋白表达水平显著升高(P值均<0.05);CC组Foxp3表达水平明显升高(P<0.05)。与AC组相比,CC组Foxp3蛋白表达水平较高,而RORγt水平明显降低(P值均<0.05)(图2,表2)。
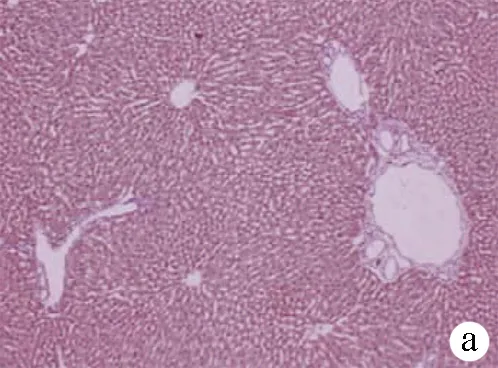




注:a,RORγt 在HC组的表达;b,RORγt 在AC组中的表达;c,RORγt 在CC组的表达;d,Foxp3在HC组的表达;e,Foxp3在AC组的表达;f,Foxp3在CC组的表达。
图2大鼠肝脏中Foxp3和RORγt蛋白的表达(免疫组化,×400)

表2 3组大鼠肝脏中Foxp3和RORγt蛋白的表达比较
注:与HC组相比,1)P<0.05,与AC组相比,2)P<0.05。

表1 3组大鼠血清生化学指标比较
注: 与HC组相比,1)P<0.05; 与AC组相比,2)P<0.05。
2.4 外周血中 Th17 、Treg 细胞频率的改变 AC 组、CC 组检测结果与HC组相比,Th17 细胞百分率、Treg细胞百分率明显高于HC组(P值均<0.05),AC组Th17/Treg 比值明显升高(P<0.05),而CC组Th17/Treg比值与HC组相比明显降低(P<0.05);与AC组相比,CC组Th17细胞百分率降低,Treg 细胞百分率升高,Th17/Treg 比值降低(P值均<0.05)(表3)。

表3 3组大鼠全血中 Th17、Treg细胞频率的比较
注: 与HC组相比,1)P< 0.05;与AC组相比,2)P<0.05。
3 讨论
α-Galcer可诱导以自然杀伤T淋巴细胞特异性活化为基础的急性肝损伤[9-10]。ConA诱导的肝炎是一种典型的T淋巴细胞介导的肝炎模型[11-12]。本研究在上述两种建模过程中AC组和CC组血清AST、ALT与HC组相比迅速升高,表明α-Galcer、ConA作用后大鼠肝脏明显受损;且与AC组相比,CC组ALT、TBil升高更明显,这在肝脏病理表现中也得到了验证。肝脏组织病理镜下观察发现AC组出现以肝细胞变性等急性病理变化,CC组出现了肝细胞坏死和大量炎性细胞浸润等慢性病理改变。综上,两种方法均可成功建立免疫性肝损伤大鼠模型。
对Th17发育重要的STAT3已被证明抑制Foxp3的表达,而Foxp3能够结合Th17细胞的重要转录因子RORγt并抑制其转录活性,从而抑制初始T淋巴细胞向Th17细胞方向分化发育[13-14]。实验中免疫组化的结果显示与HC组相比AC组的Foxp3表达水平明显偏低,RORγt蛋白表达水平明显上升,CC组Foxp3表达水平明显升高;这也从分子角度验证了AIH中确实存在Th17/Treg失衡;与AC组相比,CC组的Foxp3蛋白表达水平偏高,而RORγt水平明显偏低,CC组表现为Treg占优势的免疫抑制的慢性炎症为主,Foxp3抑制RORγt转录活性,使初始T淋巴细胞向Treg细胞偏斜,转录因子的失衡可能是Th17/Treg失衡的原因。
流式细胞术结果分析显示,AC组、CC组检测结果与 HC 组相比,外周血中和脾脏悬液中Th17、Treg 细胞百分率明显升高,且 AC 组 Th17/Treg 比率升高,而 CC 组 Th17/Treg 比率降低;与AC组相比,CC组Th17 细胞百分率降低,Treg 细胞百分率升高,Th17/Treg 比率降低,这个结果也与病理表现相符合,AC 组 Th17/Treg 比率明显升高是以Th17在疾病中的促炎作用为著,在病理中表现为细胞水肿的急性病程;CC 组 Th17/Treg 比率降低表现为Treg发挥免疫抑制作用为主的慢性病程,病理表现为肝脏水肿减轻出现坏死和纤维组织增生。
本研究利用α-galcer和ConA两种不同药物建立急、慢性AIH大鼠模型并证实AIH中确实存在Th17/Treg及其失衡,且在炎症反应、组织损伤中发挥了重要作用,是肝脏免疫病理反应的重要影响因素。希望可能成为免疫治疗相关疾病辅助治疗的靶标。
