阿奇霉素-苦木注射液联用对炎症细胞因子释放影响的体外研究
2020-02-08郭文娜许晓蒙孙发鑫
张 杰,李 乔,郭文娜,许晓蒙,孙发鑫,许 卉
(烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
炎症是指接受刺激后机体产生的一系列反应,其诱导产生多种炎症细胞因子并激发机体进行防御反应[1].当巨噬细胞受到细菌脂多糖(LPS)持续刺激,能够分泌大量炎症细胞因子[2],如肿瘤坏死因子-α(TNF-α),一氧化氮(NO),白细胞介素8(IL-8),白细胞介素6(IL-6)等一系列活性物质,通过调节这些致炎因子表达,是实现抑制炎症反应的重要途径[3-6].
大环内酯类抗生素,广谱抗菌药阿奇霉素(AZM)[7],能有效治疗常见敏感菌所致的呼吸道疾病、皮肤及软组织感染等疾病,对革兰氏阴性菌、革兰氏阳性菌、支原体等致病菌均有较强抗菌活性[8],查阅相关文献,大量数据证明阿奇霉素具免疫调节和抗炎作用,可以降低TNF-α、IL-6、NF-κB、IL-8和MMP-2活性[9].
不同药物联合可发挥协同或叠加作用,发挥各自优势,显著提高疗效,降低副作用[10].临床研究表明,阿奇霉素广泛联用多种清热解毒类中药制剂,在治疗感染性疾病方面具有良好的临床疗效[11].苦木注射液(KM)为小众中药注射液,方剂是由苦木干燥枝或茎经加工制成的橙黄色的澄明液体注射液,有清热、解毒、消炎的功效,主要用于感冒、上呼吸道感染、急性扁桃体炎、肠炎、细菌性痢疾等[12].进行临床用药调查,目前尚未见苦木注射液与化学抗生素类药物联用的临床报道.
本研究以LPS刺激 RAW264.7细胞构建体外炎症模型,TNF-α和NO作为炎性检测指标,探究了阿奇霉素联合苦木注射液体外抗炎作用,为拓宽苦木注射液的临床应用提供科学依据.
1 材料与方法
1.1 仪器与试剂
酶标仪(DNM-9602 MICROPLATE READER),CKX31型倒置显微镜(菲律宾奥林巴士公司),恒温CO2培养箱(美国Thermo公司),程序冻存盒,超净台.
苦木注射液(江西青峰药业有限公司),批号:2016072303,规格:2 mL;阿奇霉素注射液(山东罗欣药业集团股份有限公司),批号:518013152,规格:0.25 g;RPMI1640培养基、青霉素、链霉素、胎牛血清(Gibco公司);小鼠TNF-α ELISA试剂盒(晶美生物有限公司);LPS、MTT(Sigma公司).其他常用试剂均为国产分析纯.
1.2 实验方法
1.2.1 样品制备 阿奇霉素注射液及苦木注射液均以生理盐水稀释制备(终浓度10~300 μg/mL),4 ℃冷藏备用.
1.2.2 细胞培养 正常小鼠单核巨噬细胞RAW246.7细胞(中科院上海细胞库(ATCC)),用含10%胎牛血清、1%青链霉素的RPMI培养液于37 ℃、5% CO2细胞培养箱中常规培养.约1~2 d传代1次.
1.2.3 MTT检测 取RAW264.7细胞悬液200 μL,每孔接种密度为1×104个/孔,于5% CO2、37 ℃细胞培养箱培养1 h,分别加入LPS(终浓度1 μg/mL)及不同浓度阿奇霉素(终浓度10~300 μg/mL)与苦木注射液(终浓度10~300 μg/mL),各组均平行设置3个孔,同时设LPS组、空白对照组、单药组、联合用药组,培养24 h后于每孔均分别加入20 μL MTT(终浓度500 μg/mL),培养4 h弃去上清加入DMSO150 μL,振摇至蓝紫色甲瓒结晶完全溶解,以630 nm为参比波长,用酶标仪测定570 nm处的吸光度A570,进行3次重复实验.细胞生长抑制率公式如下:
细胞生长抑制率(%)=(1-实验组平均A570/空白对照组平均A570)×100%.
1.2.4 NO浓度测定 取RAW246.7细胞悬液200 μL,每孔接种密度为5×105个/孔,各组均平行设置3个孔.培养1 h后分别加入LPS(终浓度1 μg/mL)及不同浓度的阿奇霉素(25、50、100 μg/mL)与苦木注射液(12.5、25、50、100、200 μg/mL),同时设 LPS组、空白对照组、单药组、联合用药组,培养24 h,分别吸取上清100μL,加入相同体积Griess试剂(Griess试剂A:1 g/L N-萘乙二胺盐酸盐;Griess试剂B:体积分数为5%的H3PO4,10 g/L对氨基苯磺酰胺.使用前等体积混合),充分反应后测定A540.配制不同浓度NaNO2溶液0、10、20、40、60、80、100 μmol/L,绘制标准曲线,将吸光度代入标曲计算公式,求算细胞培养上清液中NO-2浓度.依据NO抑制率公式,计算单药组及联合用药组对NO抑制率.吸取上清后,进行MTT实验,操作步骤如上述所示.进行3次重复实验.
NO抑制率=([NO]LPS-[NO]LPS+Sample/[NO]LPS-[NO]BLK)×100%.
1.2.5 ELISA法测定上清中TNF-α浓度 取RAW246.7细胞悬液200 μL,每孔接种密度为2×105个/孔,各组均平行设置3个孔.培养1 h,分别加入LPS(终浓度1 μg/mL)及不同浓度的阿奇霉素(25、50、100 μg/mL)与苦木注射液(12.5、25、50、100、200 μg/mL),同时设LPS组、空白对照组、单药组、联合用药组,置培养箱中持续培养4h后收集上清液,按照TNF-α ELISA试剂盒说明书方法步骤进行系列测定,进行3次重复实验.依据相应A450值及标准液浓度绘制标准曲线,依据标曲公式计算单药组及联合用药组TNF-α浓度.
1.2.6Q值评价组合效果 研究苦木注射液联合阿奇霉素抗炎相互作用,基于金正均法[13](在Burgi氏公式法的基础上,分析了其缺点并进行修正得出,也称概率相加法),计算组合指数Q值.基于该理论,组合效应可以定量地定义为相加作用,Q=0.85~1.15;协同作用,Q≥1.15;拮抗作用,Q≤0.85.Q值可以通过以下公式计算:
其中,E(A+B)为两药合用抑制率,EA为A药单独给药抑制率,EB为B药单独给药抑制率.
2 结 果
2.1 阿奇霉素联合苦木注射液对巨噬细胞增殖的影响
根据A570值计算得出阿奇霉素单药组(10~300 μg/mL)、苦木注射液单药组(10~300 μg/mL)及LPS组细胞存活率均大于90%.最高浓度配比苦木注射液(终浓度200 μg/mL)与阿奇霉素(100 μg/mL)联合对LPS刺激RAW264.7细胞孵育24h后的细胞存活率大于90%,如图1所示.可以看出,经LPS刺激后,RAW264.7细胞的存活率未明显改变(P>0.05);单药组及联合用药组的细胞存活率也没有降低(P>0.05).巨噬细胞的存活率均大于85%,单药组及联合用药组均不抑制RAW264.7细胞的正常增殖.
图1阿奇霉素联合苦木注射液对LPS刺激RAW264.7细胞存活率影响
Fig. 1 Effect of azithromycin combined with Kumu injection on the survival rate of RAW264.7 cells stimulated by LPS
2.2 阿奇霉素联合苦木注射液对NO的影响
检测空白组细胞上清中NO,测定浓度非常低,仅为0.98 μmol/L,在1 μg/mL的LPS刺激下,巨噬细胞RAW264.7释放大量NO(16.8 μmol/L),实验结果显示两组间有显著性差异(P<0.01),表明LPS能显诱导RAW264.7细胞释放大量炎性介质NO.与LPS组相比,苦木注射液单药组作用的RAW264.7细胞上清液中,一氧化氮的含量明显减少,随着用药浓度增高NO的浓度逐渐降低,呈现良好剂量依赖关系;阿奇霉素单药组与LPS组相比,NO含量未显著减少,随着用药浓度的增高NO的浓度未逐渐降低,并未呈现剂量依赖关系,如图2所示.
图2阿奇霉素及苦木注射液单药组不同浓度释放NO的浓度
Fig.2 Concentration of NO released by different concentrations of azithromycin and Kumu injection
阿奇霉素与苦木注射液不同联用配比(1∶1、2∶1、1∶2)释放NO浓度如图3所示.与LPS组相比,3种不同联用配比的联合用药组作用的RAW264.7细胞上清液中,NO含量均明显减少,随着用药浓度的增高NO的浓度逐渐降低,均呈现出良好剂量依赖关系;比较3种不同联用配比释放的NO浓度,阿奇霉素与苦木注射液在联用配比2∶1下释放NO浓度较其他2组相对较低,联用配比1∶2时对NO的抑制作用最强.
Fig. 3 The concentration of NO released by a combination of azithromycin and Kumu injection
综合图2、图3,比较阿奇霉素及苦木注射液单药组、联合用药组对NO释放的影响.联合用药组与单药组相比,联合用药组释放NO的浓度明显低于单药组,两药联合使用后对NO的抑制效果均优于单药组(P<0.05).
2.3 苦木注射液及阿奇霉素对TNF-α的影响
在1 μg/mL LPS刺激下,巨噬细胞释放出大量的TNF-α,实验结果显示空白组与LPS组间有显著性差异(P<0.01),表明LPS能显著诱导RAW264.7细胞释放大量炎性介质TNF-α.与LPS组相比,单药组及联合用药组,TNF-α含量均明显减少,随着用药浓度的增高TNF-α浓度逐渐降低,呈现出良好的剂量依赖关系.如图4所示.
与LPS组相比,联合用药组作用的RAW264.7细胞上清液中,TNF-α含量均明显减少,随着用药浓度的增高TNF-α的浓度逐渐降低,均呈现出良好的剂量依赖关系;比较不同联用配比对TNF-α的抑制作用,联合用药配比2∶1时对TNF-α的抑制作用相对较弱;联合用药配比1∶1及1∶2均对TNF-α有相对较强的抑制作用,且此2种配比对TNF-α抑制率未有显著性差异.如图5所示.
Fig.4 Effect of azithromycin and Kumu injection on TNF-α re-lease alone
Fig.5 Effect of azithromycin-Kumu injection on TNF-α release
由图4、图5可知,联合用药组与单药组相比,联合用药组TNF-α浓度明显低于单药组TNF-α浓度,两药联合使用后对TNF-α的抑制效果均优于单药组(P<0.05).
2.4 药效学相互作用
根据金正均法计算组合指数Q值,基于该理论,计算得出阿奇霉素联合苦木注射液对炎症因子NO具相加抑制作用(Q=0.85~1.15),对炎症因子TNF-α具协同抑制作用(Q>1.15).Q值计算结果如表5所示.
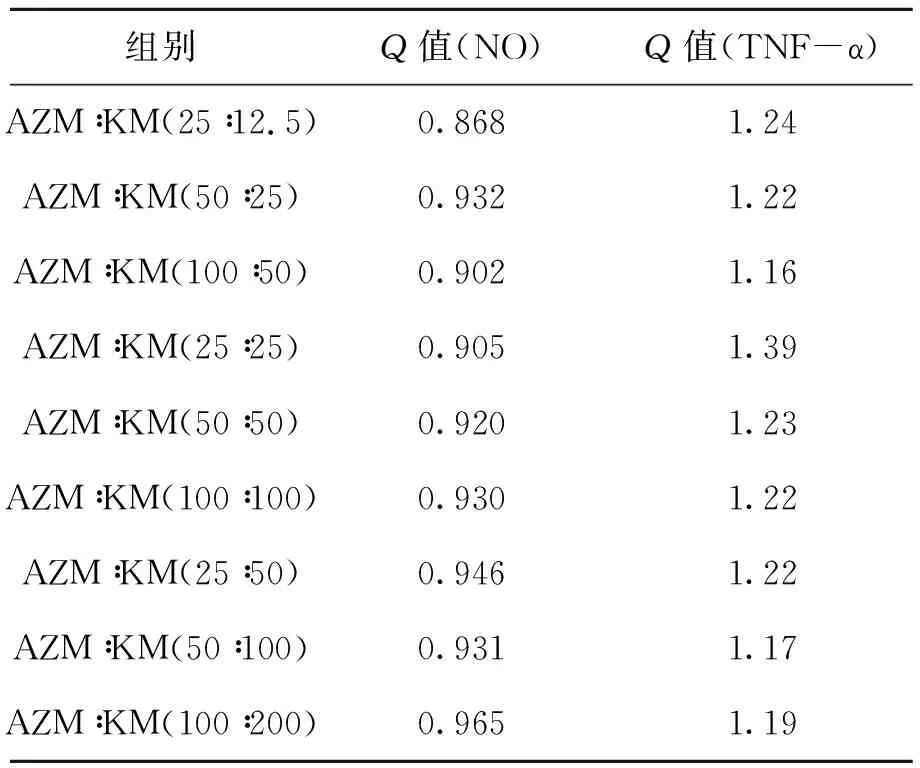
表5 联合用药组Q值计算结果
3 讨 论
阿奇霉素在临床上广泛使用,其耐药性是临床应用的最大健康威胁之一.为应对阿奇霉素耐药性,药物联合现象日渐普遍,联合治疗可有效增强阿奇霉素疗效.作为后抗生素时代的替代药物,中药可有效延缓、消除细菌耐药作用,中药制剂在临床上广泛与包括阿奇霉素在内的抗生素联用.阿奇霉素在临床广泛与清热解毒类中药制剂(如喜炎平注射液、痰热清注射液、热毒宁注射液等)联合应用,临床治疗效果评价较高,苦木注射液作为一小众清热解毒类中药制剂,目前尚未见阿奇霉素与其进行联用的临床报道.
本实验以LPS刺激RAW264.7细胞诱导产生TNF-α、NO作为炎性指标,研究表明阿奇霉素联合苦木注射液较单药组相比对炎症因子TNF-α、NO均具明显的抑制作用,联合用药具更显著体外抗炎效果,本次实验仅考察了TNF-α、NO 2种炎性指标,IL-6,NF-κB,IL-8等炎症指标仍有待进一步研究以期提高实验的可靠性、系统性.
4 结 论
本研究以炎症因子TNF-α、NO作为评价指标,以阿奇霉素联合苦木注射液对炎症因子TNF-α、NO的抑制作用进行了考察,最终确定对TNF-α、NO均具有明显的抑制作用,体外抗炎效果明显.为拓宽苦木注射液的临床应用提供了可靠的依据.
