连续自然发酵泡菜中菌群显微表征与抗氧化活性的研究
2020-02-06刘秉坤吕嘉枥晁倩文罗潇
刘秉坤,吕嘉枥,晁倩文,罗潇
(陕西科技大学 食品与生物工程学院,西安 710021)
泡菜是以蔬菜等为主要原料,添加或不添加辅料,经食用盐或食用盐水泡渍发酵等工艺加工而成的蔬菜制品。不同地区、不同配方、不同发酵条件等对菌群群落的构成、理化指标以及其他特性等均有重要影响。汪荣斌等[1]对近十年泡菜的研究进展进行了总结,主要包括原料、辅料、香辛料、自然发酵、纯种发酵等单批次发酵过程中理化指标、助消化功能、胆固醇降解、降低血脂功能、抗氧化作用、抗菌作用等的变化。叶陵等[2]对我国传统发酵蔬菜中乳酸菌群落结构多样性研究进展进行了综述,论述了泡菜发酵中乳酸菌群的研究现状。近期,毛丙永等[3]以8份四川老卤泡菜样品为研究对象,对其理化指标和特征菌群进行了研究,从8份样品中分离出了植物乳杆菌、布氏乳杆菌和耐乙醇片球菌3种菌,表明这3种菌是老卤泡菜的特征菌群,对泡菜发酵具有重要作用;张安等[4]采用构建16S rRNA基因文库技术对四川泡菜中细菌群落结构多样性进行了研究,结果表明,发酵后期乳杆菌属为优势菌,OTU丰度为50.3%。这些研究大多集中在单批次发酵,对于多批次连续发酵的研究报道不多,2018年李恒等[5]对不同发酵阶段(20代发酵)泡菜母水微生物群落组成和多样性进行了分析,发现泡菜母水中含量在0.1%以上的细菌属有7个,主要包括乳杆菌属(Lactobacillus)、拉乌尔菌属(Raoultella)、柠檬酸杆菌属(Citrobacter)、乳球菌属(Lactococcus)等,泡菜母水中的真菌属主要是Kazachstania,含量超过99%。传统泡菜发酵常由多菌群参与,一般多采用连续发酵。因此,本研究通过对连续7代自然发酵泡菜过程中微生物显微特性、SOD酶活性、DPPH自由基清除率、还原力、pH、总酸含量、亚硝酸盐含量等的分析检测,揭示了菌群变化对泡菜质量的影响。研究结果对泡菜安全性和品质的提高具有一定的理论与实际意义。
1 材料与方法
1.1 供试原材料
莲花白、黄瓜、红萝卜、花椒、辣椒、姜、食盐:购于陕西西安华润万家超市。
1.2 仪器与设备
Phenom ProX-飞纳台式扫描电镜 复纳科学仪器(上海)有限公司;DM750-LEICA数码显微镜 北京瑞科中仪科技有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;UV-2600 紫外可见分光光度计 尤尼柯(上海)仪器有限公司;HHW21-600 电热恒温水箱 天津市泰斯特仪器有限公司;DSX-280A 高压蒸汽灭菌锅 上海申安医疗器械厂。
1.3 主要试剂及配制
1.3.1 主要试剂
EDTA-2Na、DPPH(1,1-二苯基-2-苦肼基自由基):分析纯,西安东升化工有限公司;戊二醛溶液、无水乙醇、磷酸二氢钾、磷酸氢二钾、三氯化铁、邻苯三酚:分析纯,天津市科密欧化学试剂有限公司;铁氰化钾、三氯乙酸:分析纯,天津市天力化学试剂有限公司。
1.3.2 试剂配制
pH 8.20、0.1 mol/L三羟甲基氨基甲烷(Tris)-盐酸缓冲溶液(内含1 mmol/L EDTA-2Na):称取1.2114 g Tris和37.2 mg EDTA-2Na溶于62.4 mL 0.1 mol/L盐酸溶液中,用蒸馏水定容至100 mL。
4.5 mmol/L邻苯三酚盐酸溶液:56.7 mg邻苯三酚溶于少量10 mmol/L盐酸溶液并定容至100 mL。
2.5%戊二醛溶液:用pH 7.2、0.1 mol/L磷酸缓冲液将25%戊二醛溶液稀释10倍。
磷酸缓冲溶液(pH 7.2、0.1 mol/L):360 mL A+140 mL B定容至1000 mL。其中,母液A:0.2 mol/L的Na2HPO4溶液(NaH2PO4·12H2O 71.6 g用蒸馏水溶解并定容至1000 mL);母液B:0.2 mol/L的NaH2PO4溶液(NaH2PO4·2H2O 31.21 g用蒸馏水溶解并定容至1000 mL)。
0.2 mmol/L DPPH溶液:称取7.88 mg DPPH,用无水乙醇溶解并定容至100 mL。
1.4 试验方法
1.4.1 原料预处理
将新鲜蔬菜经称量、清洗、切分等预处理后,用沸水漂烫10 min后冷却,晾干备用。
1.4.2 连续自然发酵方法
称取莲花白300 g、黄瓜400 g、红萝卜300 g,按1.4.1方法处理后入坛,加入其他辅料,加水3500 mL、加盐量为3%自然条件下发酵7 d为1代,共发酵7代。每代发酵结束时取出蔬菜并投入等量新鲜蔬菜,进行第2代发酵。每代平行试验3批次,每个批次进行3次重复。每代发酵结束后进行菌群显微表征,并检测发酵液中SOD活性、DPPH自由基清除率、还原力以及理化特性。
1.5 分析检测方法
1.5.1 SOD酶活性
根据国标GB/T 5009.171-2003《保健食品中超氧化物歧化酶(SOD)活性的测定》[6]对泡菜发酵液中SOD酶活性进行测定。
1.5.2 还原力[7]
将Vc配制成浓度分别为10,20,30,40,50 μg/mL。分别取0.2 mL上述溶液,加入0.8 mL蒸馏水、2.5 mL pH 6.6、0.2 mol/L磷酸缓冲液及2.5 mL质量分数为1%的铁氰化钾,50 ℃ 水浴20 min,然后加入2.5 mL质量分数为10%的三氯乙酸,4000 r/min离心10 min。取离心后的上清液2.5 mL,加入2.5 mL蒸馏水及2.5 mL质量分数为0.1%的FeCl3。混匀后静置10 min,测定700 nm波长条件下的吸光值并绘制标准曲线,见图1。样品中还原力大小与上述方法相同,结果换算为Vc当量表示。
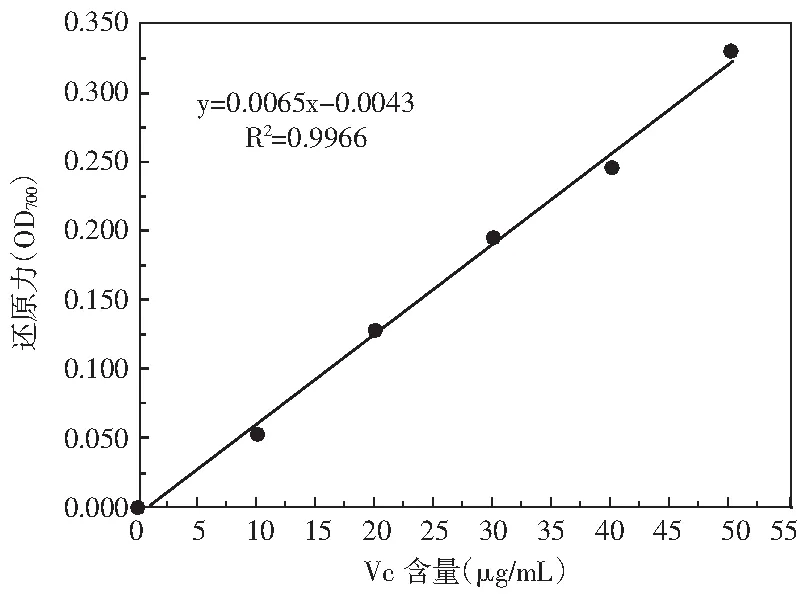
图1 还原力标准曲线Fig.1 Standard curve of reducing capability
1.5.3 DPPH自由基清除率
DPPH测定加样程序见表1。
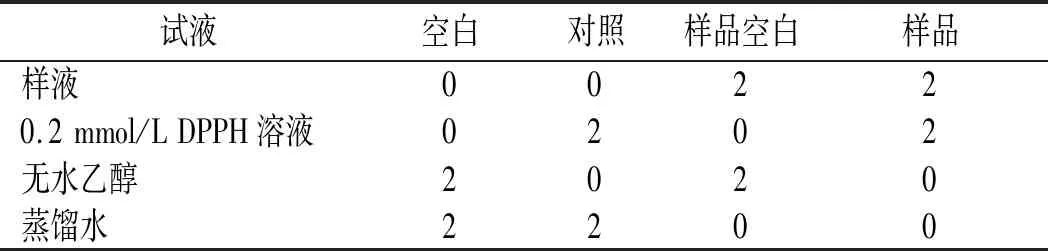
表1 DPPH测定加样表Table 1 DPPH adding samples mL
按照表1中步骤加入试液,混匀后避光反应30 min,分别在517 nm波长条件下测定吸光值。
式中:A样为样品与DPPH反应后的吸光值;A空为样品空白在517 nm波长条件下的吸光值;A对为对照在517 nm波长条件下的吸光值。
1.5.4 pH值
根据国标GB 10468-89《水果和蔬菜产品pH值的测定方法》测定泡菜发酵液的pH值[8]。
1.5.5 总酸
根据国标GB/T 12456-2008《食品中总酸的测定》测定泡菜发酵液的总酸含量[9],结果以乳酸计。
1.5.6 亚硝酸盐含量
根据国标GB 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》对泡菜发酵液的亚硝酸盐含量进行测定[10]。绘制亚硝酸盐标准曲线,见图2。

图2 亚硝酸盐标准曲线Fig.2 Standard curve of nitrite
1.5.7 菌群的显微表征
显微表征采用扫描电子显微镜观察,方法如下[11]:
待观测样品的预处理:取待测样品发酵液以6000 r/min离心10 min,倒掉上清液,再加入发酵液进行离心(离心条件同上),多次离心直至有较多菌体沉淀在离心管底部。
固定:将上述步骤中的菌体沉淀物用2.5%戊二醛溶液(稀释溶液为pH 7.2、0.1 mol/L磷酸缓冲液)固定2 h以上,固定结束时以6000 r/min离心10 min去除上清液。
清洗:用磷酸缓冲液(pH 7.2、0.1 mol/L)清洗3次,20 min/次。每次清洗结束后以6000 r/min离心10 min去除上清液。
脱水:采用乙醇梯度脱水的方式,浓度依次为30%、70%、100%,每个浓度脱水3次,20 min/次,每次脱水结束时以6000 r/min离心10 min去除上清液。
干燥:将样品放入烘箱中,50 ℃ 烘干。
喷金:利用真空镀膜设备对样品镀金以增加导电性。
观察:将处理好的样品在扫描电子显微镜下观察。
2 结果与分析
2.1 连续自然发酵过程中菌群的显微表征
将原料经过处理后进行连续自然发酵,每7 d为1代,共发酵7代,做3个批次,在发酵过程中,分别对每一代、每一批次的泡菜进行菌群显微表征,结果见图3~图5。

图3 第1批次连续自然发酵7代菌群的显微表征Fig.3 Microscopic characterization of seven generations of continuous natural fermentation in the first batch
由图3可知,第1批次第1代发酵液中有少量杆菌并且形态各异,菌群组成较为丰富,其中细长形态的杆菌占优势;首次发酵结束后,菌群变得单一,以形态粗短的杆菌占优势;第2代发酵液菌群形态以粗短的杆菌和酵母菌为主;第3代发酵液以杆菌为主,其次是酵母菌,并且有少量的球菌;第4代发酵液酵母菌较多,杆菌形态各异,还能观察到少量的球菌;第5代发酵液酵母菌所占比例有所减少,球菌比例增加,主要以杆菌为主且形态较为丰富;第6代发酵液短杆菌和球菌较多,有少量的酵母菌;第7代发酵液中杆菌总体上占优势,球菌较多,还有少量的酵母菌。整体来看,每代发酵结束都存在杆菌,而酵母菌和球菌分别开始出现在第2代和第3代发酵液中,并且出现之后就或多或少地存在于之后的每代,在发酵第2,3,4代结束时酵母菌占有较大比例,从第3代发酵结束开始,酸味较刺鼻。

图4 第2批次连续自然发酵7代菌群的显微表征Fig.4 Microscopic characterization of seven generations of continuous natural fermentation in the second batch
由图4可知,第2批次第1代发酵液中菌群较少,以短杆菌占优势,菌群较为复杂,杆菌形态各异;第2代发酵液菌群以酵母菌和杆菌为主,许多酵母菌上面还留有芽痕,杆菌的形态非典型且多样,未观测到球菌;第3代发酵液中酵母菌占优势,杆菌较少;第4代发酵液菌群组成仍然以酵母菌为主,但形态非典型的杆菌数量有所增加;第5代发酵结束后杆菌数量明显增多,杆菌形态多样,观察到大量短杆菌且具有较为典型的形态,酵母菌所占比例大大减少,未观察到球菌;第6代发酵液菌群结构与第5代发酵液菌群结构较为相似,仍以杆菌为主并且形态典型清晰,酵母菌较少;第7代发酵结束后杆菌占优势,尤其是短杆菌较多,酵母菌较少,未观察到球菌。与第1批次相比,第2批次发酵液中几乎没有球菌,与第1批次发酵过程类似的是,酵母菌出现后就一直贯穿整个连续发酵过程,并且所占比例先增加后减少。第2批次泡菜在第3代发酵结束后,相比前2代质地较软。此后几代泡菜质地较好,酸味浓郁。

图5 第3批次连续自然发酵7代菌群的显微表征Fig.5 Microscopic characterization of seven generations of continuous natural fermentation in the third batch
由图5可知,第3批次泡菜第1代发酵液中菌群较少,以短杆菌占优势且菌群较为单一;首次发酵结束后以杆菌为主并且观察到球菌;第2代发酵液中仍是杆菌占优势,但菌体形态有所改变,并无典型的杆菌形态;第3代及第4代发酵液中杆菌形态与第2代发酵液中的菌群结构类似,还观察到了大量的酵母菌;第5,6代发酵液菌群组成与第3,4代相比酵母菌的比例大大减少,杆菌形态较之前相似;从第3代发酵开始,泡菜的风味不够浓郁。
综上所述,连续自然发酵时,菌群变化对泡菜品质有较大的影响。发酵到第3代时,不典型杆菌和酵母菌(杂菌)的出现使得泡菜菜体变软并出现刺鼻的酸味或发酵风味不够浓郁等问题。随后继续发酵过程中,典型杆菌增多,酵母菌减少,但始终贯穿整个发酵过程。到发酵结束时,杂菌大量减少,菌群逐渐变纯,且主要以杆菌为主,形态典型。球菌除第2批未出现外,其余都有出现,且出现较早,出现后呈逐渐增多趋势,贯穿整个发酵过程。
2.2 连续自然发酵过程中抗氧化活性的变化
3批次连续自然发酵过程中SOD活性、还原力、DPPH自由基清除率的变化见图6~图8。

图6 连续自然发酵SOD活性变化Fig.6 Changes in SOD activity of continuous natural fermented pickles
由图6可知,泡菜能够产生SOD活性。前3代逐渐升高,此后呈现出波动性变化,但始终高于未发酵时的SOD活性。第1代结束时SOD活性分别为(28.19±1.63),(28.92±2.50),(21.30±3.22) U/mL。第1,2批次在第3代结束时SOD活性达到最大值,分别为(82.22±6.71),(68.89±5.55) U/mL。第3批次连续发酵在第7代发酵结束时SOD活性达到最大值,发酵7代后3个批次的SOD活性分别为(59.30±3.05),(63.70±7.63),(38.73±6.99) U/mL。此外,在发酵各代结束时,第1,2批次连续发酵过程中SOD活性变化趋势相似且始终高于第3批次。本次试验中SOD活性的高低顺序早在第1代结束后就基本成型。这是因为在发酵过程中,各反应的进行离不开菌群的生长代谢,而菌群的替演是一个漫长的过程,因此SOD活性较低的样品无法迅速超过酶活高于它的样品,这也说明了泡菜品质控制要尽早。
由图7可知,连续自然发酵过程中还原力波动变化,整体呈现先上升后下降再上升的趋势。还原力相比SOD活性变化较小,并且发酵各代之间始终没有较大差距。发酵前各样品还原力相当于Vc含量分别为(20.12±1.58),(21.2±4.05),(16.12±0.77) μg/mL。发酵结束时分别为(52.58±1.42),(54.35±2.84),(50.74±2.73)μg/mL,还原力提高了2~3倍。
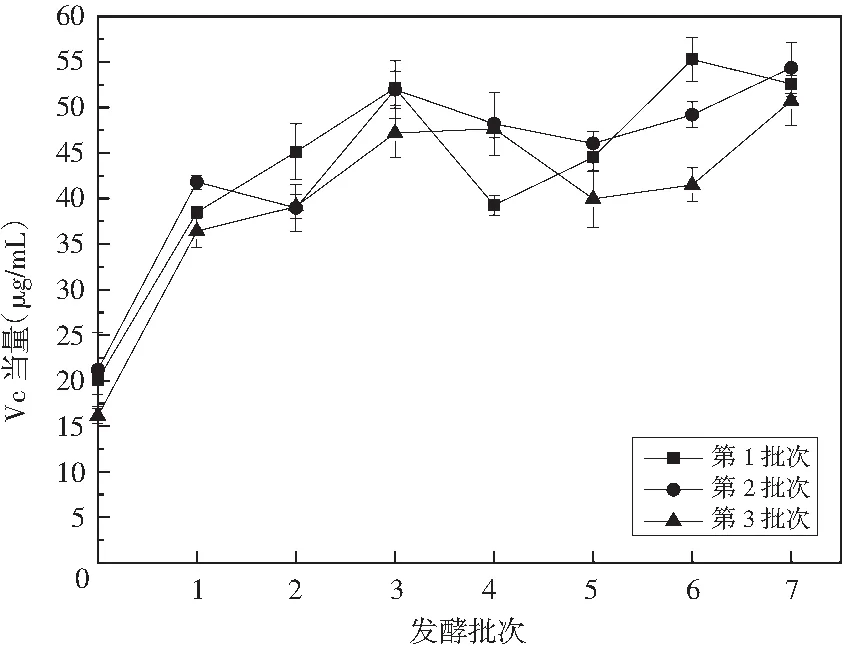
图7 连续自然发酵还原力变化Fig.7 Change in reducing capacity of continuous natural fermented pickles

图8 连续自然发酵DPPH自由基清除率变化Fig.8 Changes in DPPH free radical scavenging rate of continuous natural fermented pickles
由图8可知,连续发酵泡菜能够产生较强的DPPH自由基清除率。发酵前发酵液几乎没有DPPH自由基清除率。第1代结束后,DPPH自由基清除率迅速增加到90.00%以上,分别为(92.28±0.70)%、(93.86±0.33)%、(92.90±0.41)%。后期各样品检测值虽上下浮动但变化较小。第1批次发酵第7代达到最大值(99.09±0.50)%,其余两批次在发酵第5代结束后达到最大值,分别为(98.90±1.22)%、(99.09±2.75)%。发酵7代结束时第2,3批次DPPH自由基清除率分别为(97.66±1.91)%、(88.60±1.56)%。
综上所述,在连续自然发酵过程中DPPH自由基清除率在第1代时快速增长,后续发酵过程中基本没有较大的变化,直到发酵结束时,其最大DPPH自由基清除率达到(99.09±2.75)%。而SOD酶活性与还原力则整体呈先上升后下降再上升的趋势,结合之前显微特性的观察可知,在前3代发酵过程中,由于杂菌出现较少,所以SOD酶活性与还原力整体呈现上升趋势,在第3代后杂菌逐渐增多,影响整体抗氧化活性,使得SOD酶活性与还原力降低,之后到第5代时,菌群开始逐渐变纯,杂菌减少,整体抗氧化活性又开始呈现上升趋势。整个发酵过程中SOD酶活性最大达到(82.22±6.71)U/mL,而还原力最大达到(54.35±2.84) μg/mL。
2.3 连续自然发酵过程中理化指标的变化
3批次连续自然发酵过程中pH、总酸、亚硝酸盐含量的变化见图9~图11。

图9 连续自然发酵pH值变化Fig.9 Changes in pH of continuous natural fermented pickles
由图9可知,发酵开始前,pH值分别为8.16±0.01,8.10±0.01,8.06±0.01。每代发酵结束时,各发酵批次之间pH值差别不大。pH值的变化主要由发酵液中乳酸菌生长繁殖产生乳酸,乳酸不断积累造成的。由于pH降低到一定程度时,乳酸菌本身的生长受到抑制,乳酸不会继续积累,因此连续发酵pH值相比其他指标稳定,发酵7代时pH值总体上介于3.04±0.01~4.33±0.01之间。
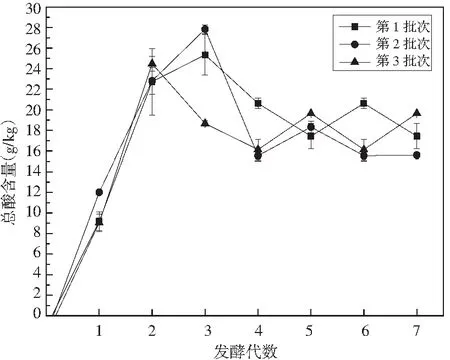
图10 连续自然发酵总酸变化 Fig.10 Change of total acid in continuous natural fermented pickles
由图10可知,各批次之间、不同代之间总酸差别较大,但整体趋势为先升高后降低。发酵开始前,各样品总酸含量几乎没有检出。发酵第1代结束时,各样品总酸含量相差不大,分别为(9.19±0.89),(12.01±0.07),(9.05±0.87) g/kg。发酵第2代时,第3批次总酸含量最高,为(24.47±0.70) g/kg。第3代时,第1,2批次总酸含量达到最高值,分别为(25.34±1.99),(27.84±0.43) g/kg。第3代之后,总酸均呈现出波动变化的趋势。发酵第7代后,总酸含量分别为(17.43±1.21),(15.58±0.20),(19.64±0.01) g/kg。

图11 连续自然发酵亚硝酸盐含量变化Fig.11 Changes of nitrite content in continuous natural fermented pickles
由图11可知,在泡菜发酵过程中,亚硝酸盐含量在不同代之间呈现出波动性变化。发酵前亚硝酸盐含量分别为(0.47±0.06),(0.00±0.08),(0.00±0.26) mg/kg。第1批次泡菜在第6代结束后亚硝酸盐含量达到最大值,第2,3批次的泡菜在第2代结束后达到最大值,分别为(4.24±0.21),(3.76±0.11),(4.10±0.00) mg/kg。泡菜在发酵前期都会出现亚硝酸盐的峰值,这是由于前期氧气含量充足,含有硝酸盐还原能力的杂菌生长旺盛,后期氧气被消耗,乳酸菌占优势,发酵液pH降低,亚硝酸盐进入酸解阶段。因此各代发酵结束时,亚硝酸盐含量较低,本试验所测结果均小于10.00 mg/kg。
综上所述,连续自然发酵过程中pH变化趋势不大,整体呈先下降后稳定的趋势,总酸先上升后下降,且都大于15.00 g/kg,而亚硝酸盐含量整体呈上升趋势,但是也没有超过10.00 mg/kg,整体理化指标正常,未出现异常指标,说明连续自然发酵过程中,泡菜整体质量符合日常人们的食用标准。
3 结论
通过对连续自然发酵泡菜过程中的菌群显微表征、SOD活性、还原力、DPPH自由基清除率、pH、总酸含量、亚硝酸盐含量进行试验研究,结果表明,3批次发酵过程中菌群趋势大体相似,前2代杆菌是优势菌群,发酵过程中抗氧化活性呈上升趋势,随后从第3代、第4代开始有球菌与酵母菌出现,抗氧化活性出现降低趋势,第5代~第7代杆菌又逐渐增多,成为优势菌群直到发酵结束,此时抗氧化活性又出现升高趋势;发酵过程中pH维持在3.04~4.33,从第2代开始总酸含量均大于15.00 g/kg;亚硝酸盐含量始终未超过10.00 mg/kg,均符合国家标准。
