无机砷在淡水底栖动物摇蚊幼虫中的吸收和累积
2020-02-03王晓辉杨常亮郑王媛淇王洁张璟黄中情
王晓辉,杨常亮,郑王媛淇,王洁,张璟,黄中情
1. 云南大学建筑与规划学院,昆明 650091 2. 云南大学生态与环境学院,昆明 650091 3. 云南大学国际河流与生态安全研究院,昆明 650091
砷(As)是一种典型的毒害性类金属元素,是人体非必需元素,毒性强,且具有蓄积性,对人的中毒剂量为0.0052~0.01 g,致死量为0.2~0.06 g,一直是毒害类元素研究的重要对象[1]。As多以各种化合物的形式广泛存在于自然界中,具有低剂量高毒性、价态多变和难降解等特征。As及其化合物是具有危害性的重要环境污染物,危害生态环境,严重威胁着人体健康[2]。它已被世界卫生组织(WHO)、国际癌症研究会(IARC)和美国疾病控制中心等国际权威机构确认为A类致癌物[3]。
由于人类活动,使得大量的As释放到水环境中,导致沉积物、水和底栖无脊椎动物中的As浓度很高。目前,世界各地均有河流湖泊受到As的污染,例如,法国Presa河从1880年至1945年因矿石开采而受到As的广泛污染,每年含As废弃物排放量高达4 000 t。由于采矿废弃物排放到淡水系统中,导致水、沉积物和底栖无脊椎动物中的As浓度分别高达3 010、9 450和1 928 μg·g-1[4-6],此As浓度是流动水域中所检测到的最高浓度[7]。Foley等[8]报道了美国Chautauqua湖中As浓度为22.4~114.8 μg·L-1,超过了美国公共卫生服务部(US PHS)发布的标准(10 μg·L-1)。近几十年来,随着我国湖泊流域人口增长与经济的快速发展,工业化和城市化活动排放进入湖泊的各类污染物质剧增,我国河流湖泊的As污染呈现出集中、多发的趋势。湖泊水环境污染不断加剧,大部分河流湖泊中溶解态As的浓度远远超过了世界淡水中溶解态As的平均背景浓度(1.0×10-4mg·L-1)[9-10]。在中国台湾,由于采矿和疏浚沉积物造成地下水污染,其中As的浓度高达0.5 mg·L-1[11];在中国广州的珠江,因长期密集的工业和城市活动,其沉积物中总As浓度范围为16.7~33.4 mg·kg-1[12]。As污染已成为全球关切的重大环境与健康问题之一,对As污染所导致的环境与健康问题已有大量的研究报道[1,13]。
人们很早就认识到As是一种普遍存在于食品、水、土壤和空气中的化学物质[14]。在水环境中,As可以以多种氧化态和化学形态存在[15],不同的氧化态和化学形态会影响其生物利用度和生理毒性效应[16]。As在自然界中存在4种氧化态(+5,+3,0,-3),而水环境中最常见的无机As形态是砷酸盐(As(Ⅴ))和亚砷酸盐(As(Ⅲ))[17]。有机体中As的毒性决定于As的浓度和形态[18-19],无机As具有极强的毒性[20],而有机As,像砷甜菜碱(AsB)、砷胆碱(AsC)和部分砷糖(AsS)则被认为是低毒性的[21-22]。长期的As暴露研究表明,As可通过饮水或沿着食物链进入人体,导致皮肤、肺、肝、肾和膀胱等器官的病变,乃至诱发癌症[17,23],因此,了解As在食物链中积累和转化的机制对于评估As污染(特别是食物中)至关重要。通常认为,在食物网中随着生物体营养等级的升高,生物体内重金属As的累积量会逐渐升高,从而产生生物放大作用[24]。金属的生物累积性是相关水体污染状况的标志,并且是研究高等水生生物体(尤其是鱼类)中金属的生物学作用的一个有用工具[25]。在这种情况下,底栖动物作为水生系统的关键组成部分和高营养级生物体的食物,在天然食物网生态系统中具有重要作用。
迄今为止,关于在As(Ⅲ)或As(Ⅴ)暴露后的生物累积已在许多物种中有过研究报道,包括真菌[26]、细菌[27]、海藻[28]、多毛类[29]和海洋鱼类[30]。但是,水生系统中As的研究主要集中在海洋生态系统,而淡水生态系统中的As污染研究,尤其是淡水底栖生物对As的累积方面的研究报道还很少[7]。摇蚊幼虫广泛分布于湖泊和河流的沉积物中,并且能耐受高浓度痕量元素的污染,因此常用于评估痕量元素的生物可利用度,多项研究表明,摇蚊幼虫在旨在保护底栖生物群落和以其为食的高营养级捕食性动物的生态风险评估中具有重要的作用[31-32]。本研究的目的是监测淡水底栖无脊椎动物摇蚊幼虫(chironomid larvae)对As的生物累积,了解水相摄入途径中As的生物可利用度。探究淡水底栖动物对As的累积以评估潜在的危害及自然风险,为保护区域环境与人类健康提供科学依据。
1 材料与方法(Materials and methods)
1.1 试验生物
摇蚊幼虫于2018年1月购自天津市一家鲜活摇蚊幼虫批发公司。为了尽量减少样品尺寸对As暴露实验的影响,挑选大小基本一致的个体(体长1.5 cm)。在运送到实验室后,用去离子水对摇蚊幼虫进行反复彻底的漂洗以除去污泥杂质等表面附着物以及死虫,然后放入已曝气过的自来水中暂养(13 ℃,pH 7.5),以便达到净化和驯化的目的。在实验室培养期间,光暗循环周期为12 h∶12 h,2 d换水一次。在暴露实验开始之前,在此条件下适应培养一周左右。
1.2 试验设计
将摇蚊幼虫随机均匀分开,放入盛有3 L已曝气过的自来水的容积为5 L的聚乙烯塑料烧杯中培养。实验共设置8个不同的暴露组和1个空白对照组。暴露组的质量浓度梯度分别为50、100、500和1 000 μg·L-1的As(Ⅲ)和As(Ⅴ),空白对照组使用已曝气过的脱氯自来水,不添加无机As。各个暴露组的含As水溶液通过加入适当体积的1 000 mg·L-1的标准储备液(NaAsO2或Na2HAsO47H2O)来配制。每实验组各放入25 g经驯养净化后的摇蚊幼虫,保持室温和自然光照,在静态淡水条件下进行为期18 d的暴露培养。暴露期间定期取水样检测水中As浓度,每天及时移除死虫。实验过程中分别在第0、3、6、9、12、15和18天取样,每组实验每次采集3个平行样本。首先,将所取水样放于5 mL聚乙烯离心管中并立即放入-20 ℃的冰箱中保存;其次,将收集的存活的红虫短暂浸入去离子水中,然后用纸巾将多余的水分吸干,用万分之一天平称量记录其湿重,之后将摇蚊幼虫进行冷冻干燥(用万分之一天平称量记录其干重)以及均质化(研磨),最后储存在小型聚乙烯袋中,以便进一步用于总As浓度的分析。
在摇蚊幼虫的不同暴露组和空白对照组中,其平均湿重和干重都没有明显的差异,所以这些参数对数据的影响可以忽略。As(Ⅴ)暴露组中摇蚊幼虫的平均湿重为(1.00±0.06) g,范围在0.81~1.19 g之间;平均干重为(0.13±0.03) g,范围在0.08~0.25 g之间。As(Ⅲ)暴露组中摇蚊幼虫的平均湿重为(0.97±0.08) g,范围在0.76~1.17 g之间;平均干重为(0.14±0.02) g,范围在0.10~0.20 g之间。空白对照组中摇蚊幼虫的平均湿重为(1.01±0.10) g,范围在0.91~1.31 g;平均干重为(0.14±0.02) g,范围在0.10~0.20 g之间。
1.3 总As浓度分析
1.3.1 水样总As浓度测定
将冰冻的水样从冰箱取出,解冻后用于总As浓度分析。无机As浓度参照中华人民共和国水利行业标准《水质 砷的测定 原子荧光光度法》(SL.327.1—2005)[33]测定:准确移取适量水样(视浓度而定,精确至0.1 mL)置于50 mL容量瓶中,依次加入体积分数为50%的盐酸(32%,优级纯,上海阿拉丁试剂公司)水溶液10.0 mL、硫脲+抗坏血酸(50 g·L-1,分析纯,上海阿拉丁试剂公司)混合溶液5.0 mL,用纯水定容后摇匀,放置30 min后待测。同时按同样的方法制备空白样品。采用高效液相色谱-紫外-氢化物发生-原子荧光光谱仪(HPLC-UV-HG-AFS)(LC-AFS 9600,北京海光仪器有限公司)测定水样中总As浓度(μg·L-1)。
1.3.2 生物样品总As浓度测定
采用湿法消解制备摇蚊幼虫样品,其无机As浓度参照《食品中总砷及无机砷的测定》(GB5009.11—2003)[34]中无机As氢化物原子荧光光度法测定:准确称量部分均匀样品粉末(0.05 g),置于50 mL锥形瓶中,依次加入硝酸(65%,优级纯,上海阿拉丁试剂公司)20 mL,硫酸(98%,优级纯,上海阿拉丁试剂公司)1.25 mL,高氯酸(72%,优级纯,上海阿拉丁试剂公司)4 mL,放置过夜,次日置于电热板(XMTD-9000,天津工业实验室仪器有限公司)上加热消解。若消解液处理至1 mL左右时仍有未分解物质或色泽变深,取下放冷,补加硝酸5~10 mL,再消解至2 mL左右,如此反复2~3次,注意避免炭化,继续加热至消解完全后,再持续蒸发至高氯酸的白烟散尽,硫酸的白烟开始冒出。取下放冷,之后加去离子水25 mL,再蒸发至冒硫酸白烟,冷却,用去离子水将内溶物转入25 mL比色管中。最后加入硫脲+抗坏血酸(100 g·L-1,分析纯,上海阿拉丁试剂公司)混合溶液2 mL,补加去离子水至刻度,混匀,放置30 min,待测,使用相同的操作程序处理空白样品。采用HPLC-UV-HG-AFS(LC-AFS 9600,北京海光仪器有限公司)测定摇蚊幼虫组织样品中的As浓度(μg·g-1干重)。
总As标准溶液是将总As标准储备液(中国国家标准物质研究中心)连续稀释制备的。本次实验水样总As以及生物样品总As浓度的测定均采用HPLC-UV-HG-AFS(LC-AFS 9600,北京海光仪器有限公司)。先测量样品空白,之后按顺序测定各样品浓度。依次测定试剂空白、标准系列溶液总As浓度,相同条件下,测定样品溶液总As浓度。通过分析加标回收率,证实了所采用消化方法的准确性。水样总As浓度加标回收率在109.4%~119.6%之间,摇蚊幼虫样品总As浓度加标回收率在99.1%~118.6%之间。
1.4 数据统计分析
使用SPSS 24.0软件进行统计学分析。通过单因素方差分析(ANOVA)来检测不同实验组中的相关水平差异,然后进行最小显著差异(LSD)检验。概率水平P<0.05被认为具有统计学意义。采用OriginPro 2016作图。
2 结果(Results)
2.1 水溶液中的As浓度
摇蚊幼虫暴露于无机As 18 d后,不同浓度梯度的As(Ⅲ)和As(Ⅴ)暴露组中水体总As浓度及其变化情况如表1所示。空白对照组中水体总As浓度范围在0.753~0.824 μg·L-1之间。在As(Ⅲ)暴露实验中,除50 μg·L-1As(Ⅲ)暴露组中水体As浓度随时间变化无明显差异(P>0.05)外,其他As(Ⅲ)暴露组(100、500和1 000 μg·L-1)中水体As浓度均在15 d后相较于初始暴露浓度有了显著增加(P<0.05)。在整个暴露实验期间,As(Ⅲ)暴露组中水体As浓度误差范围保持在2.70%~13.90%之间。而在As(Ⅴ)暴露实验中,100 μg·L-1和500 μg·L-1As(Ⅴ)暴露组中水体As浓度随时间变化不显著(P>0.05),仅50 μg·L-1和1 000 μg·L-1As(Ⅴ)暴露组中水体As浓度分别在18 d和15 d后与初始暴露浓度相比有了显著差异(P<0.05)。在整个暴露实验周期中,As(Ⅴ)暴露组中水体As浓度误差范围为2.65%~18.12%。这表明,在短时间内,水体中As浓度随时间变化不显著,As暴露浓度无明显变化差异。
2.2 暴露时间对摇蚊幼虫中As累积的影响
摇蚊幼虫暴露于无机As水溶液中18 d后,在不同浓度梯度的As(Ⅲ)或As(Ⅴ)暴露组中,其生物体组织中As的累积随时间变化情况如图1和图2所示。在对照组中,摇蚊幼虫中As浓度较低,且随时间没有显著性变化,总As浓度范围为1.16~1.22 μg·g-1(干重),这些数值处于淡水湖泊生物体中常见的As浓度范围的下限。
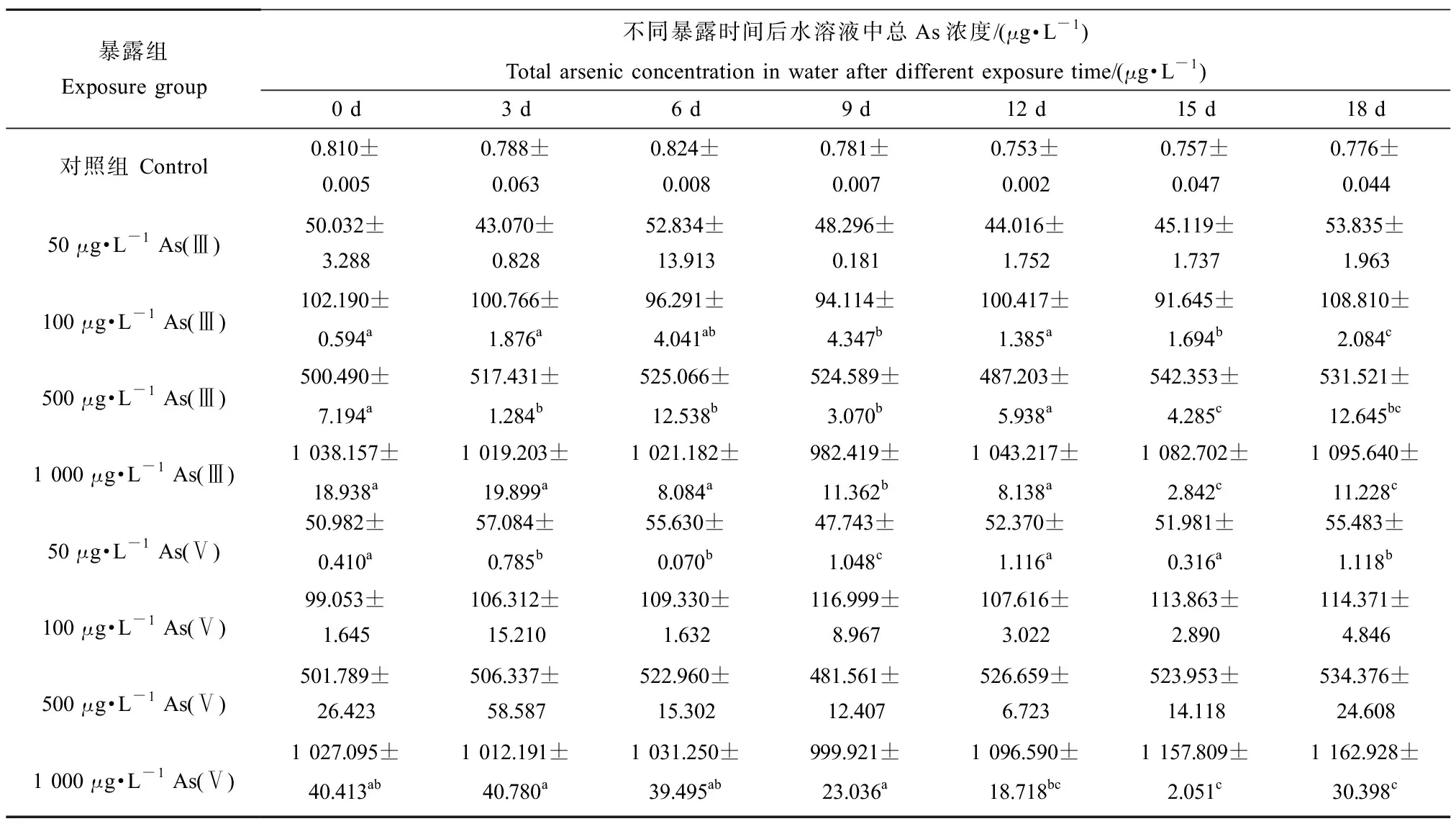
表1 不同浓度无机As暴露实验水溶液中总As浓度Table 1 Total arsenic concentration in water under exposure treatments of inorganic As with different concentrations
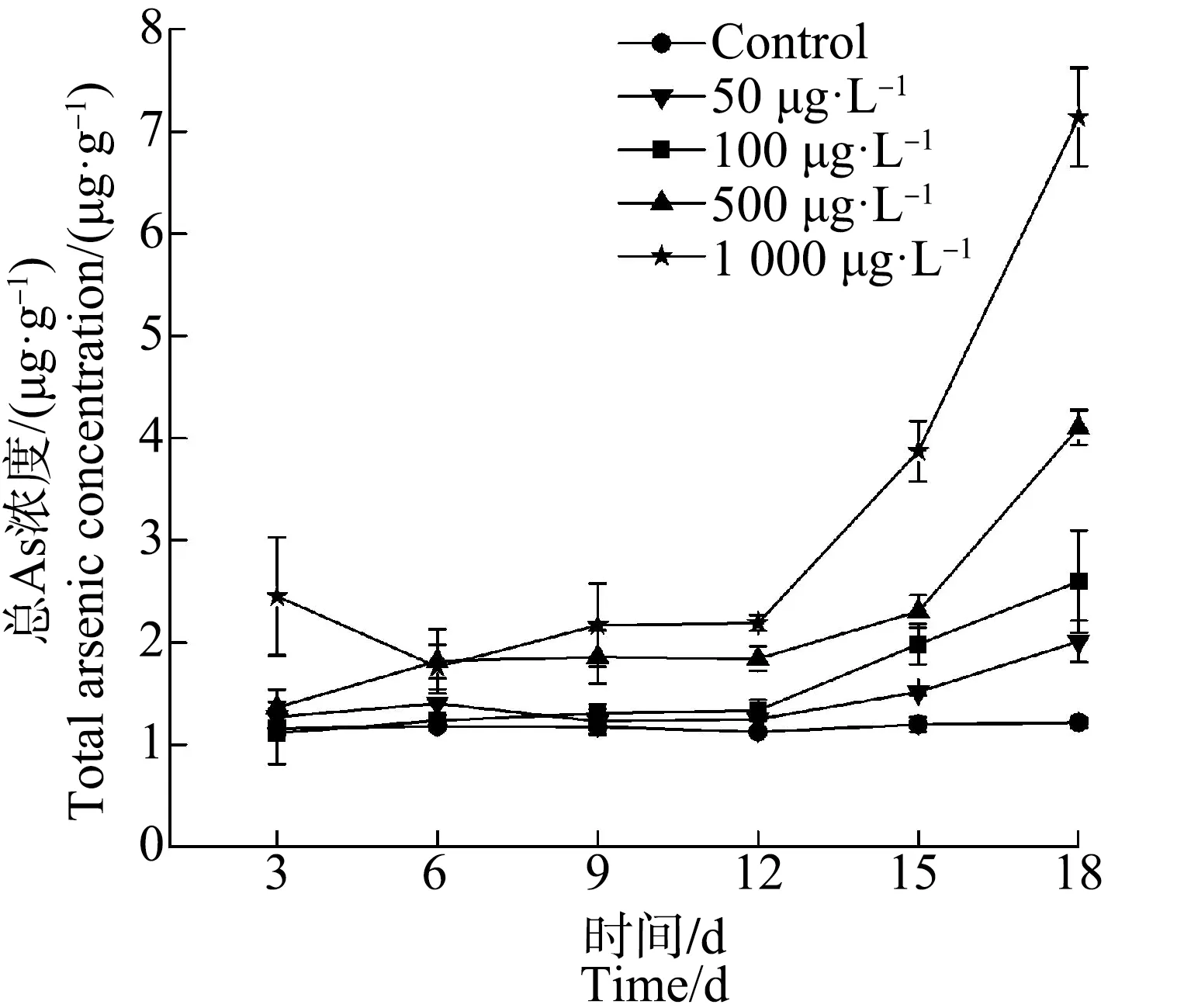
图1 暴露于不同浓度As(Ⅲ)水溶液18 d后摇蚊幼虫中总As浓度变化注:数据表示为平均值±标准偏差(n=3)。Fig. 1 Changes of total arsenic concentrations in chironomid larvae after waterborne As(Ⅲ) exposure for 18 dNote: Data are expressed as means±SD (n=3).
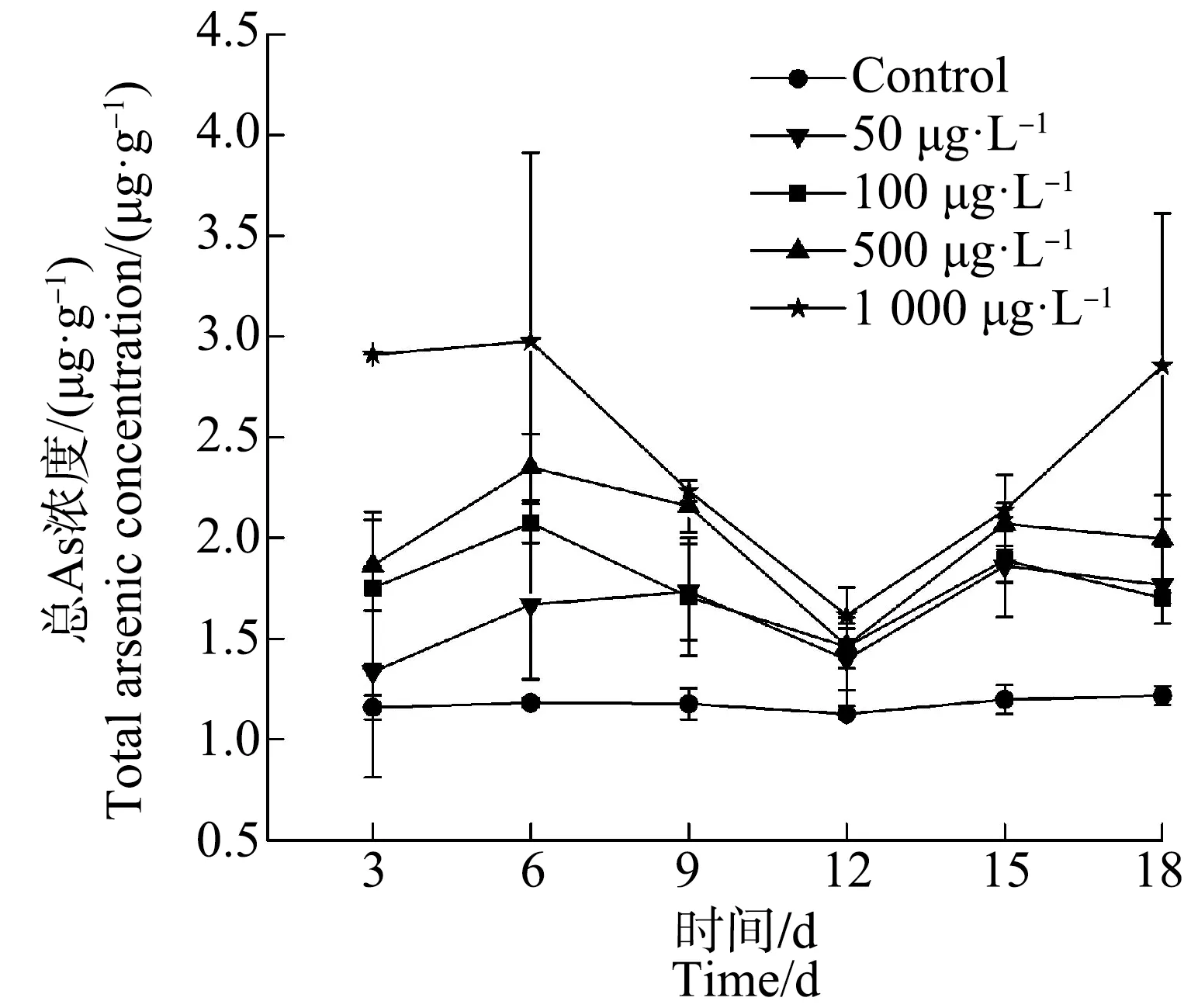
图2 暴露于不同浓度As(Ⅴ)水溶液18 d后摇蚊幼虫中总As浓度变化注:数据表示为平均值±标准偏差(n=3)。Fig. 2 Changes of total arsenic concentrations in chironomid larvae after waterborne As(Ⅴ) exposure for 18 dNote: Data are expressed as means±SD (n=3).
与空白对照组相比,不同浓度的As(Ⅲ)暴露组中摇蚊幼虫体内As浓度随时间呈总体上升趋势。50 μg·L-1和100 μg·L-1As(Ⅲ)暴露组中总As浓度在前12 d内变化均趋于平缓且差异不大,总As浓度范围分别为1.23~1.40 μg·g-1(干重)和1.11~1.34 μg·g-1(干重),而在12~18 d的暴露周期内,50 μg·L-1和100 μg·L-1As(Ⅲ)暴露组中总As浓度有小幅度上升趋势,变化较为明显,且在第18天时,摇蚊幼虫体内As的累积量达到最大值,分别为(2.01±0.20) μg·g-1(干重)和(2.60±0.50) μg·g-1(干重)。500 μg·L-1和1 000 μg·L-1As(Ⅲ)暴露组中总As浓度在前12 d内同样呈平缓趋势,但摇蚊幼虫体内As的累积量略有增加,总As浓度范围分别为1.36~1.86 μg·g-1(干重)和1.76~2.45 μg·g-1(干重),而在12~18 d的暴露周期内,总As浓度同样呈大幅度上升趋势,且在第18天时,摇蚊幼虫体内As的累积量达到最大值,分别为(4.10±0.17) μg·g-1(干重)和(7.14±0.48) μg·g-1(干重)(图1)。可见,在不同浓度梯度的As(Ⅲ)暴露组中,随着时间的改变,摇蚊幼虫体内As的累积量均有较大变化,表明As的累积与暴露时间有关。可能在高浓度As(Ⅲ)的胁迫下,进入摇蚊幼虫体内的无机As远大于代谢排出的无机As,造成无机As在摇蚊幼虫体内的快速积累,如果无机As在摇蚊幼虫体内蓄积的浓度达到一定值,会对摇蚊幼虫产生毒害作用,影响到摇蚊幼虫的代谢活动和摄食活动等,最终导致其死亡。本实验中没有发现摇蚊幼虫大量异常死亡,说明所采用的As(Ⅲ)浓度还不足以使摇蚊幼虫致死。
与As(Ⅲ)暴露组不同,As(Ⅴ)暴露组中摇蚊幼虫体内As浓度随时间变化是总体上呈先上升、后下降、最后趋于平缓或持续上升趋势。在前12 d的暴露周期内,50、100、500和1 000 μg·L-1As(Ⅴ)暴露组总As浓度均是有小幅度上升,之后呈下降趋势,总As浓度范围分别为1.33~1.73 μg·g-1(干重)、1.46~2.07 μg·g-1(干重)、1.46~2.34 μg·g-1(干重)和1.61~2.98 μg·g-1(干重),除50 μg·L-1As(Ⅴ)暴露组总As浓度在第9天达到最大值(1.73±0.24) μg·g-1(干重)之外,100、500和1 000 μg·L-1As(Ⅴ)暴露组总As浓度均在第6天达到最大值,分别为(2.07±0.10) μg·g-1(干重)、(2.35±0.16) μg·g-1(干重)和(2.98±0.93) μg·g-1(干重)(图2),这表明摇蚊幼虫对As的累积能力随着暴露条件变化而变化,高代谢期和As的排泄期与As在其组织中的累积是相互交替进行的。摇蚊幼虫组织直接与淡水中的As(Ⅴ)接触时,可能存在一定的解毒机制。当组织内As的累积量达到一定值后,其代谢速率可能大于吸收速率。而在12~18 d的暴露周期内,As(Ⅴ)暴露组总As浓度上升至最大值后均趋于平缓,其摇蚊幼虫中体内As累积量的最大值分别为(1.86±0.08) μg·g-1(干重)、(1.89±0.28) μg·g-1(干重)和(2.07±0.03) μg·g-1(干重)(图2),与前12 d内对应的As(Ⅴ)暴露组中摇蚊幼虫体内总As浓度的最大值非常接近,表明摇蚊幼虫对As的累积趋于稳定。1 000 μg·L-1As(Ⅴ)暴露组总As浓度呈持续上升趋势,这与1 000 μg·L-1As(Ⅲ)暴露组的情况相似,且在第18天时,摇蚊幼虫体内As累积量达到(2.85±0.76) μg·g-1(干重)(图2)。
2.3 无机As暴露浓度和形态对摇蚊幼虫中As累积的影响
如图3和图4所示,在摇蚊幼虫暴露于无机As不同时间后,其体内As的累积随着暴露浓度的升高均有增加,并且As(Ⅴ)暴露组总As浓度明显低于As(Ⅲ)暴露组。对As(Ⅲ)暴露组而言,除在500 μg·L-1As(Ⅲ)暴露3 d的摇蚊幼虫体内总As浓度没有显著增加外,500 μg·L-1As(Ⅲ)暴露组(6、9、12、15和18 d)和1 000 μg·L-1As(Ⅲ)暴露组(3、6、9、12、15和18 d)
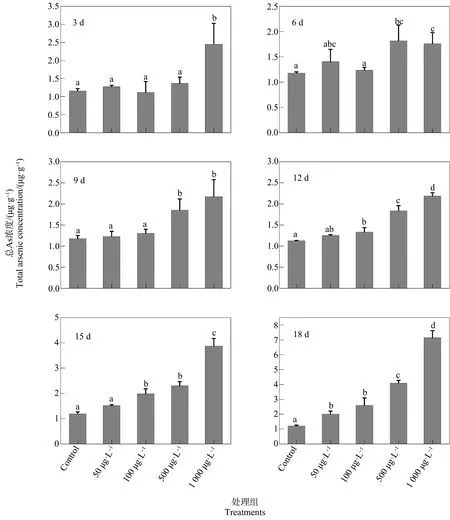
图3 不同浓度As(Ⅲ)暴露条件下摇蚊幼虫中总As浓度注:数据表示为平均值±标准偏差(n=3);不同字母表示不同处理组间的差异显著,P<0.05。Fig. 3 Total arsenic concentrations in chironomid larvae exposed to different concentrations of As(Ⅲ)Note: Data are expressed as means±SD (n=3); different letters represent significant difference between treatments (P<0.05).
总As浓度与对照组相比均显著升高(P<0.05),然而,50 μg·L-1As(Ⅲ)暴露组(3、6、9、12和15 d)和100 μg·L-1As(Ⅲ)暴露组(3、6和9 d)的摇蚊幼虫体内总As浓度与对照组相比均没有显著性差异,并且50 μg·L-1和100 μg·L-1As(Ⅲ)暴露组总As浓度非常接近(图3)。另外,除12 d时所有As(Ⅴ)暴露组总As浓度与对照组没有显著差异外,3、6、9、15和18 d时,1 000 μg·L-1As(Ⅴ)暴露组总As浓度与对照组相比均显著升高(P<0.05),3、6、9和15 d时,500 μg·L-1As(Ⅴ)暴露组的摇蚊幼虫总As浓度与对照组相比均显著升高(P<0.05),9 d和15 d时,50 μg·L-1和100 μg·L-1As(Ⅴ)暴露组摇蚊幼虫体内总As浓度与对照组相比有了显著增加(P<0.05),同样的,50 μg·L-1和100 μg·L-1As(Ⅴ)暴露组总As浓度非常接近(图4)。由此可见,较高的As暴露浓度(500 μg·L-1和1 000 μg·L-1As(Ⅲ)、500 μg·L-1和1 000 μg·L-1As(Ⅴ))可能会影响摇蚊幼虫对As(Ⅲ)和As(Ⅴ)生物累积的模式,在低浓度无机As暴露条件下,摇蚊幼虫对As的生物利用度较低。值得注意的是,在无机As暴露18 d后,As(Ⅲ)暴露组总As浓度与对照组相比均有显著增加(P<0.05)(图3),而对于As(Ⅴ)暴露组,仅仅1 000 μg·L-1As(Ⅴ)暴露组总As浓度与对照组相比显著增加(P<0.05)(图4),在1 000 μg·L-1As(Ⅲ)暴露组的摇蚊幼虫体内As的累积量高于1 000 μg·L-1As(Ⅴ)暴露组,这表明,在高浓度的无机As暴露条件下,对于摇蚊幼虫来说,As(Ⅲ)可能比As(Ⅴ)更具生物可利用性。
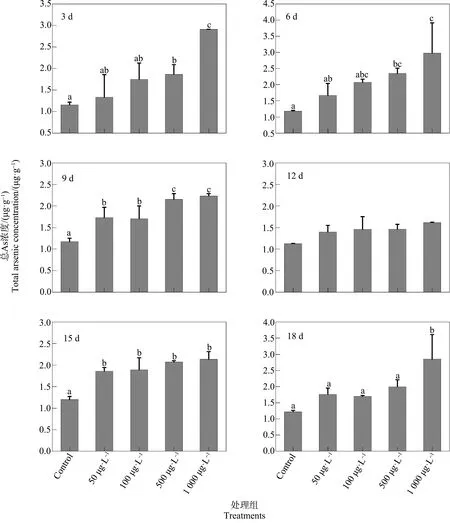
图4 不同浓度As(Ⅴ)暴露条件下摇蚊幼虫中总As浓度注:数据表示为平均值±标准偏差(n=3);不同字母表示不同处理组间的差异显著,P<0.05。Fig. 4 Total arsenic concentrations in chironomid larvae exposed to different concentrations of As(Ⅴ)Note: Data are expressed as means±SD (n=3); different letters represent significant difference between treatments (P<0.05).
如图5所示,暴露于As(Ⅲ)不同时间后,摇蚊幼虫中总As浓度与暴露浓度之间呈现显著的线性相关关系(P<0.05),其总As浓度随暴露浓度升高逐渐增加。如图6所示,在As(Ⅴ)暴露实验中,除暴露12 d的As(Ⅴ)暴露组摇蚊幼虫中总As浓度与暴露浓度之间没有显著相关性,其他As(Ⅴ)暴露组(3、6、9、15和18 d)总As浓度与暴露浓度之间均呈显著的正相关(P<0.05)。且随着暴露浓度升高,As(Ⅴ)暴露组摇蚊幼虫中总As浓度增加趋势相对As(Ⅲ)暴露组更为平缓,又一次表明摇蚊幼虫对As(Ⅲ)的生物利用度高于As(Ⅴ)。
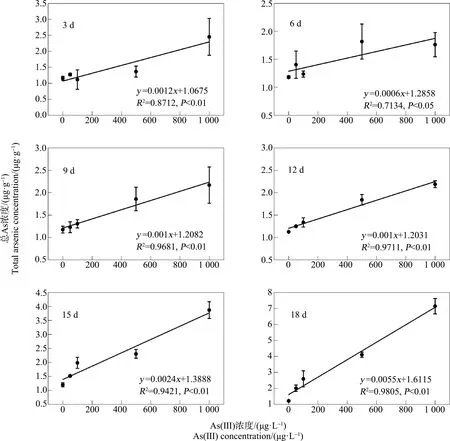
图5 不同浓度As(Ⅲ)暴露条件下摇蚊幼虫中总As浓度与As(Ⅲ)暴露浓度相关性分析注:数据表示为平均值±标准偏差(n=3)。Fig. 5 Correlation analysis of total As concentrations in chironomid larvae and different As(Ⅲ) exposure concentrationsNote: Data are expressed as means±SD (n=3).
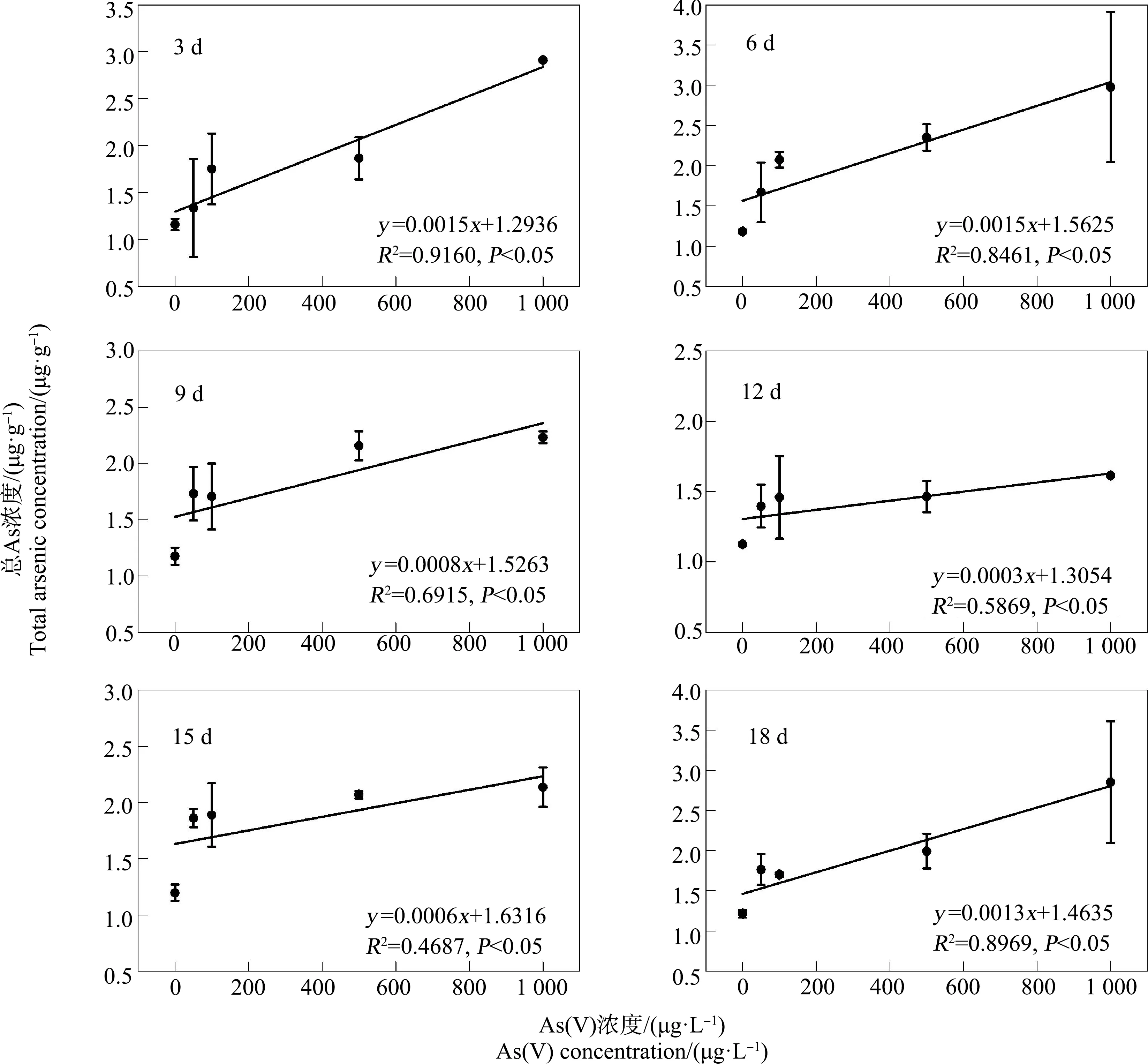
图6 不同浓度As(Ⅴ)暴露条件下摇蚊幼虫中总As浓度与As(Ⅴ)暴露浓度相关性分析注:数据表示为平均值±标准偏差(n=3)。Fig. 6 Correlation analysis of total As concentrations in chironomid larvae and different As(Ⅴ) exposure concentrationsNote: Data are expressed as means±SD (n=3).
2.4 生物累积因子(BAF)
美国环境保护局(US EPA)提出了一套估算各种污染物的生物累积因子(BAF)的方法和指南,以反映鱼类、贝类等水生生物通过各种来源(食物、沉积物等)对污染物的吸收情况,且不仅限于水中来源[32]。BAF是指特定营养水平下的水生生物体和水中某种化学物质的浓度之比,其中生物体及其食物都暴露于该营养水平下[35-36]。As的BAF可以按公式(1)进行计算。
(1)
式中:ct为生物体组织中总As浓度(mg·kg-1干重),cw为水体中As浓度(mg·L-1)。
在目前的研究中,我们计算了在无机As暴露18 d后摇蚊幼虫对As的生物累积因子(BAF18 d),结果如图7所示,在As(Ⅲ)和As(Ⅴ)暴露组中,摇蚊幼虫对As的BAF18 d随无机As暴露浓度的升高呈下降趋势,其值从高到低依次为BAF(50 μg·L-1)>BAF(100 μg·L-1)>BAF(500 μg·L-1)>BAF(1 000 μg·L-1),且在不同的无机As暴露条件下,As(Ⅲ)暴露组摇蚊幼虫中BAF均高于As(Ⅴ)暴露组,表明摇蚊幼虫对As的生物累积能力随无机As暴露浓度的升高而降低,且摇蚊幼虫对As(Ⅲ)的累积能力高于As(Ⅴ)。在50、100、500和1 000 μg·L-1As(Ⅲ)暴露组中,摇蚊幼虫对As的BAF18 d分别为37.44±4.42、23.90±4.70、7.73±0.50和6.36±0.48,在50 μg·L-1暴露浓度条件下BAF18 d达到最大值,且在500 μg·L-1和1 000 μg·L-1较高As浓度暴露条件下,摇蚊幼虫对As的BAF18 d值非常接近。另外,在50、100、500和1 000 μg·L-1As(Ⅴ)暴露组中,摇蚊幼虫对As的BAF18 d分别为29.04±3.24、14.90±0.62、3.33±0.46和2.27±0.66,同样也可以发现摇蚊幼虫在较高的As暴露浓度条件下BAF18 d值较为接近,但低于As(Ⅲ)暴露组。
3 讨论(Discussion)
在前12 d的暴露周期内,As(Ⅴ)暴露组中摇蚊幼虫体内总As浓度均有小幅度上升,之后呈下降趋势,摇蚊幼虫组织直接与淡水中的As(Ⅴ)接触时,可能存在一定的解毒机制。当组织内As的累积量达到一定值后,其代谢速率可能大于吸收速率。Mogren等[37]研究发现,溪流摇蚊幼虫(Chironomusriparius)能够承受相对高浓度As的长期暴露。诸多研究表明,水生软体动物通常有多种从细胞中排除有毒化合物的策略,包括:(1)对金属的吸收速率和排泄速率具有平衡调节机制;(2)金属与金属硫蛋白进行细胞内螯合作用,再进一步通过溶酶体内膜系统将其消除;(3)金属与谷胱甘肽络合,并隔离到液泡中[38];(4)将As(Ⅴ)还原为As(Ⅲ),然后甲基化为毒性较低的有机形态进而通过排泄释放[39]。此外,有研究表明,蜕皮也作为无脊椎动物一种解毒重金属化合物的手段[40]。Mogren等[41]将溪流摇蚊幼虫(Chironomusriparius)暴露于1 000 mg·L-1As(Ⅴ)中研究其在不同的生活阶段个体中As的浓度及其形态分布情况,发现溪流摇蚊在蛹期和成年期时As浓度显著降低,表明在幼虫期到蛹期这一阶段一部分As被排出体外,同样地,在先前的一项研究中,Mogren等[37]发现溪流摇蚊在四龄期和成年期之间能够排出72%的总As。而在12~18 d的暴露周期内,50、100和500 μg·L-1As(Ⅴ)暴露组总As浓度上升至最大值后均趋于平缓,与前12 d内对应的As(Ⅴ)暴露组中摇蚊幼虫体内总As浓度的最大值非常接近,表明摇蚊幼虫对As的累积趋于稳定。有研究报道,大多数海洋动物,包括海藻、腹足动物、虾和其他无脊椎动物,从海水中累积As的能力有限[28,42-43]。另外,Ciardullo等[44]研究发现,虹鳟鱼各个组织(鳃、肾脏、肝脏、肌肉和皮肤)中As的生物累积均在14个月时达到峰值,之后在其他生长年龄阶段显著降低,同样表明As的生物累积能力低。Zhang等[30]研究发现,与对照组相比,细鳞鯻(Teraponjarbua)幼鱼在100 μg·L-1As(Ⅲ)和As(Ⅴ)中暴露10 d后鱼肉中As的累积亦较少。同样地,菲律宾蛤仔在100 μg·L-1As(Ⅴ)中暴露14 d后鳃组织中总As累积与对照组相比没有显著差异,且肝胰腺和鳃组织中总As浓度增加趋势缓慢[45]。以上研究表明无机As的低生物利用度。
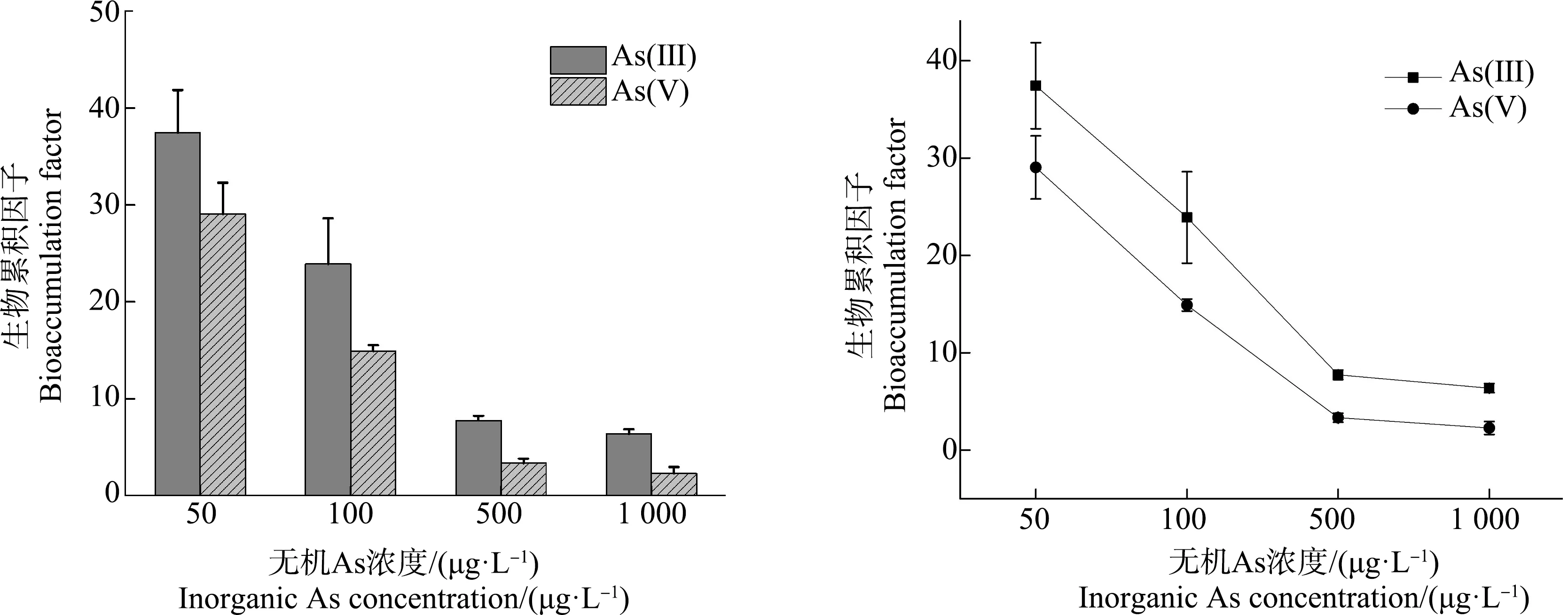
图7 不同浓度无机As暴露条件下摇蚊幼虫生物累积因子注:数据表示为平均值±标准偏差(n=3)。Fig. 7 The bioaccumulation factors of chironomid larvae exposed to different concentrations of inorganic AsNote: Data are expressed as means±SD (n=3).
在本研究中,暴露于较高浓度条件下的As(Ⅴ)(500 μg·L-1)的摇蚊幼虫中总As浓度没有显著升高,这再次表明软体动物对As(Ⅴ)的生物利用度低。相比之下,在As(Ⅲ)暴露条件下的摇蚊幼虫中As的累积量比在As(Ⅴ)暴露条件下更高,表明当暴露于较高浓度的无机As时,与As(Ⅴ)相比,As(Ⅲ)对上皮细胞更具渗透性或更容易被摇蚊幼虫代谢。其他研究人员也发现了类似的研究结果,Zhang等[46]研究发现,僧帽牡蛎(Saccostreacucullata)在1 mg·L-1As(Ⅴ)中暴露30 d后,组织中总As浓度与空白对照组相比没有显著增加,在1 mg·L-1As(Ⅲ)中暴露的僧帽牡蛎中总As累积要高于1 mg·L-1As(Ⅴ)暴露组,且在1 mg·L-1As(Ⅲ)暴露下组织中总As浓度与5 mg·L-1As(Ⅴ)暴露组的相当。Gailer等[47]研究报道,蓝贻贝(Mytilusedulis)在100 μg·L-1As(Ⅲ)和As(Ⅴ)暴露10 d后,其组织中总As浓度分别为5.1~6.4 mg·kg-1和3.3~4.8 mg·kg-1(湿重),与对照组中蓝贻贝组织总As浓度(4.2~5.1 mg·kg-1(湿重))相比没有显著差异,表明As(Ⅲ)和As(Ⅴ)这2种无机As形态的生物利用度都非常低,并且As(Ⅲ)在这种软体动物中的生物利用度略高于As(Ⅴ)。Suhendrayatna等[48]发现,在As(Ⅲ)中暴露的淡水鱼类日本青鳉(Oryziaslatipes)中总As累积比在As(Ⅴ)暴露组中高4~10倍,另有研究表明,在As(Ⅲ)中暴露的罗非鱼(Tilapiamossambica)组织中总As浓度高于As(Ⅴ)暴露组[49],这些结果表明,As(Ⅲ)可能比As(Ⅴ)更容易通过消化道黏膜或更容易被代谢。然而,也有学者研究了蛤蜊(Gafrariumtumidum)和双齿围沙蚕(Nereissuccinea)对As的生物可利用性,结果发现2种无脊椎动物对As(Ⅲ)的吸收效率低,As(Ⅲ)更容易被迅速消除[50-51]。
已有研究表明,菲律宾蛤仔[45]和僧帽牡蛎[46]组织中总As的累积随水体中As暴露浓度的升高成比例增加,这与之前在淡水鱼类日本青鳉[48]和罗非鱼[49]中的研究结果类似。Usese等[52]研究发现,尼日利亚拉各斯舄湖4种底栖性鱼类(Chrysichthysnigrodigitatus、Mugilcephalus、Lizafalcipinis和Bathygobioussoporator)的肌肉组织和淡水螺(Tymponotoniusfuscatus)各组织中的As浓度均与水体中As浓度呈显著正相关(P<0.05)。另外,Wang等[53]研究了淡水藻类铜绿微囊藻(Microcystisaeruginosa)在不同浓度的As(Ⅲ)和As(Ⅴ)(0、5、10、20、50和100 μmol·L-1)中暴露15 d后对As的累积情况,发现在As(Ⅲ)中暴露的藻细胞内总As浓度显著高于As(Ⅴ)暴露后的浓度,且铜绿微囊藻累积的总As浓度与添加到生长培养基中的As浓度成正比。在海洋多毛类动物杂色沙蚕(Nereisdiversicolor)和环节动物沙蚕(Nereisvirens)这2种沙蚕的实验中也发现了从海水中摄入的As浓度随着砷酸盐浓度的增加而上升[29]。而Zhang等[54]对从中国大亚湾海域12个地点采集的19种野生海洋生物进行了总As和As形态分析,并测定了海水和沉积物中的As浓度,发现底栖鱼类李氏(Callionymusrichardsonii)和虾类宽突赤虾(Metapenaeopsispalmensis)体内As浓度与沉积物中As浓度呈显著正相关,而中上层鱼类二长棘鲷(Parargyropsedita)中的As浓度与沉积物中的As浓度呈显著负相关。这表明,海洋生物体中的As浓度并不取决于暴露水体中的As浓度,但与沉积物中的As浓度高度相关。而这些不同海洋生物体中As浓度的差异可能是由于有机体的选择性食物来源不同所造成的。
综上所述,本研究考察了淡水底栖动物摇蚊幼虫经不同浓度As(Ⅲ)或As(Ⅴ)水相暴露后,其对As的吸收和累积情况。在不同浓度梯度的无机As暴露实验中,溶液中As浓度随时间变化不显著;摇蚊幼虫对As的累积量与暴露时间长短有关,对As(Ⅲ)的累积较As(V)显著;摇蚊幼虫对无机As的生物利用度较低,在高浓度的无机As暴露条件下,As(Ⅲ)比As(Ⅴ)更具生物可利用性;暴露于As(Ⅲ)或As(Ⅴ)溶液中的摇蚊幼虫,其体内总As浓度随无机As暴露浓度的升高逐渐增加,但生物累积能力随无机As暴露浓度的升高反而降低。
