不同材质微塑料对三氯生的吸附及其在斑马鱼体内累积分布的影响
2020-02-03盛诚王馨颖易珍张宴任洪强
盛诚,王馨颖,易珍,张宴,任洪强
污染控制与资源化研究国家重点实验室,南京大学环境学院,南京 210046
塑料由于具有较高的耐冲击性、耐磨性和绝缘性以及加工成本低等优点,在全球得到广泛应用。预计到2050年,全球塑料生产总量将达到330亿t[1]。然而,由于塑料化学性质稳定,在环境中难降解,导致大量塑料垃圾在环境中逐年累积。塑料垃圾在环境中经过物理、化学和生物降解作用,会转变成粒径更小、比表面积更大的颗粒和碎片[2],其中,粒径<5 mm的塑料碎片、纤维或颗粒称为微塑料(MPs)[3]。作为一种新型污染物,MPs的生态和健康风险已成为环境领域的研究热点。环境中的MPs可以分为原生MPs和次生MPs。原生MPs指在个人护理品和研磨剂等产品中添加的小粒径塑料颗粒(<5 mm);次生MPs指环境中较大的塑料碎片通过长期的裂解、磨蚀和自然风化等作用形成的粒径<5 mm的塑料颗粒[4-5]。
MPs按照聚合物类型可以分为:聚乙烯(PE)、聚丙烯(PP)、聚氯乙烯(PVC)、聚苯乙烯(PS)、聚酰胺(PA)和聚对苯二甲酸乙二醇酯(PET)等,其中,PE、PP和PVC既有较高的产量又有较高的环境检出率[6]。MPs粒径微小,在环境中迁移时容易被生物误食。据统计,截至2015年,在海洋塑料污染中暴露过的物种有693个,其中,267个物种中检测出了塑料碎片[7]。水生生物主要通过鳃和口摄入MPs,MPs在生物体内的累积和分布受其粒径影响显著。例如,Lu等[8]将斑马鱼暴露于不同粒径PS-MPs(5 μm和20 μm)7 d后,发现5 μm PS-MPs可累积于鳃、肠道和肝脏中,而20 μm PS-MPs只在鳃和肠道中检测到。
生物摄入MPs会导致炎症反应、氧化损伤、神经毒性、生殖毒性和代谢紊乱等各种生物效应[9]。此外,MPs具有疏水性强和比表面积大等特性,可从周围环境中吸附多环芳烃和多氯联苯等有机污染物,并对生物产生复合毒性[10-11]。研究发现,MPs表面携带的化学物质浓度可高出周围环境浓度10万倍[12]。MPs通过吸附作用可以影响有机污染物的环境归趋和生物累积。现有研究多关注粒径和浓度等因素对微塑料环境行为的影响,对于不同材质MPs对有机污染物的吸附和生物累积影响规律尚缺乏系统研究。
三氯生(TCS),作为药物和个人护理品(PPCPs)中常见的抗菌剂,广泛用于牙膏、漱口水、沐浴露、洗手液、儿童玩具和厨房用具中[13]。TCS在PPCPs中的添加量高达产品质量的0.1%~0.3%,由于PPCPs的广泛使用,环境中TCS浓度越来越高[14]。一方面,TCS随着PPCPs的排放进入污水处理系统,在废水和活性污泥中均检测到了高浓度TCS;另一方面,经污水处理系统处理后,TCS不能被完全清除,随出水进入受纳水体对环境造成污染。调查发现,美国30个州139条河流中有85条检测到了TCS的存在,TCS最高浓度达到了2.3 μg·L-1[15]。Chalew和Halden[16]研究发现淡水沉积物中TCS浓度高达53 mg·kg-1(以干重计)。中国也有不少关于TCS在环境中检出的报道。比如,珠江水域中TCS浓度达1.12 μg·L-1[17];福州内河沉积物中TCS平均浓度达50.1 μg·kg-1(以干重计)[18]。此外,由于热稳定性高,TCS还被作为添加剂用于塑料和纤维生产中,最终会随塑料垃圾一起排入环境,而且实际环境中广泛存在的TCS和MPs也存在很大的复合污染风险。
目前关于不同材质的MPs对TCS的吸附行为和机理尚不明确,MPs对TCS的吸附是否能够改变TCS在生物体不同组织器官的累积和分布尚不清楚。因此,选用斑马鱼为模式生物,选取PE、PP和PVC这3种材质的MPs作为模式MPs,研究不同材质MPs对TCS的吸附,并通过斑马鱼暴露实验研究MPs对TCS体内累积和分布的影响规律。研究结果可为深入探索MPs与其他环境污染物共存时的环境健康风险提供理论基础。
1 材料与方法(Materials and methods)
1.1 实验材料
3种塑料原料粒径为60~70 μm,购于华创塑料原料商行。通过冷冻/烘干、粉碎和过筛后获得粒径为1~15 μm的3种材质的MPs。TCS和13C12-triclosan均购自美国Sigma公司,纯度>99.7%,-20 ℃保存。甲醇(99.9%)购自德国Merck公司。硝酸(68%)、二甲基亚砜(99%)、无水硫酸镁(99%)和无水乙酸钠(99%)均购自阿拉丁试剂有限公司(中国上海)。氯化钠(99.5%)和乙酸(99.8%)购自国药集团化学试剂有限公司。采用扫描电镜(Qnanta 250 FEG,美国FEI公司)、傅里叶红外光谱仪(NEXUS870,美国NICOLET公司)和接触角仪(DSA100,德国Krüss公司)对MPs进行表征;采用拉曼显微光谱仪(inViaReflex,美国Renishaw公司)对斑马鱼组织中MPs进行定性分析;采用高效液相色谱仪(Agilent 1260 SL,美国Agilen公司)对吸附体系中TCS浓度进行测定;采用三重四级杆液相色谱质谱联用仪(Triple TOF 5600,美国AB SCIEX公司)对斑马鱼组织中TCS浓度进行测定。
1.2 实验方法
1.2.1 吸附实验
吸附动力学实验中,分别称取10 mg PE-MPs、PVC-MPs和PP-MPs加入一系列50 mL棕色玻璃管中,并加入50 mL超纯水,充分混合均匀后加入一定体积TCS储备溶液,吸附体系中MPs和TCS的终浓度分别为200 mg·L-1和300 μg·L-1。将棕色玻璃管放置于恒温振荡器中,在25 ℃转速为180 r·min-1的条件下振荡。分别在20 min、1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h、48 h、72 h、96 h、120 h、144 h和168 h共15个时间点取50 mL水样,用0.22 μm滤膜过滤水样后收集于玻璃瓶中,置于4 ℃冰箱保存。吸附热力学实验中,TCS浓度分别设置为50、100、150、200、250、300、350、400、450和500 μg·L-1,吸附实验进行168 h后取样,用0.22 μm滤膜过滤水样后收集于玻璃瓶中,置于4 ℃冰箱保存。水样处理后,用高效液相色谱仪测定TCS浓度。MPs对TCS的吸附量由初始TCS浓度和滤液中剩余TCS浓度相减计算得出。
1.2.2 累积分布实验
斑马鱼驯养:选用18周龄野生型斑马鱼,购于中国科学院水生生物研究所,体重为(0.32±0.04) g,体长为(30±3) mm。开展正式实验之前,所有斑马鱼按照以下条件驯养2周,光照∶黑暗(14 h∶10 h);养殖水pH为7.2±0.5,溶解氧为(6.6±0.3) mg·L-1,电导率为(0.256±0.005) mS·cm-1,硬度为(185±9) mg·L-1CaCO3,紫外灯消毒,每2天测定1次水质参数以确定驯养条件稳定;每天以体重的1%喂食2次。
按照吸附实验的配比,将200 μg·L-1MPs和300 μg·L-1TCS进行充分混合并振荡吸附120 h。累积分布实验分组如下:空白组(养殖水),TCS组(300 μg·L-1TCS),TCS+PE组(200 μg·L-1PE-MPs和300 μg·L-1TCS),TCS+PP组(200 μg·L-1PP-MPs和300 μg·L-1TCS)以及TCS+PVC组(200 μg·L-1PVC-MPs和300 μg·L-1TCS)。斑马鱼随机分入以上实验组,累积6 d后取斑马鱼的肝脏、肠道、脑、性腺和剩余鱼体进行测定,每个样本包含3个平行,每个平行为5条鱼。实验过程中,每天换一次水,每次更换1/2的水,并补充对应体积的TCS和MPs混合溶液确保暴露浓度稳定,暴露期间其他条件与驯养条件完全一致。为避免外源塑料的污染,实验过程中使用的所有耗材均为玻璃材质并经过超纯水洗涤,所有实验用水均为经过0.22 μm滤膜过滤的超纯水。
1.3 MPs和TCS的检测
MPs的定性分析:将采集的组织样品冻干后,转移至10 mL的比色管中,加入1 mL硝酸(质量分数为68%),置于75 ℃水浴锅中消解30 min。将消解液用1 μm的聚碳酸酯膜过滤,收集滤膜,用拉曼显微光谱仪对滤膜上的残余物进行鉴定。拉曼显微光谱仪的参数设置如下:激光器选用633 nm,光栅选择1 800 l·mm-1(vis),光谱范围中心为1 150 cm-1,曝光时间为1 s,激光功率为100%。
吸附体系中TCS的测定:将吸附动力学和吸附热力学实验收集的样品,超声混合均匀后,用经过活化平衡后的Oasis-HLB固相萃取小柱进行萃取(流速为每分钟75滴)。分别用6 mL超纯水淋洗,6 mL甲醇洗脱,经氮气和甲醇复溶后,采用高效液相色谱仪进行测定。测定条件如下:色谱柱C18,柱温40 ℃,进样体积10 μL,流动相为甲醇/水(V(甲醇)∶V(水)=90∶10),流速为0.2 mL·min-1,检测波长为280 nm。
组织中TCS的测定:将累积分布实验中收集的样品冻干后,称取干重,加入2 mL超纯水,匀浆后,转入15 mL离心管,并加入4 mL乙腈(含体积分数为0.1%的乙酸),充分混匀后,加入0.5 g无水乙酸钠和1.5 g无水硫酸镁,快速震荡摇匀,冷却至室温后,4 000 r·min-1离心5 min,提取上清液。上清液经固相萃取、氮吹和甲醇复溶后,用三重四级杆液相色谱质谱联用仪进行测定。液相条件:色谱柱柱温40 ℃,进样体积10 μL,流动相为甲醇/水,采用梯度洗脱程序(0~4 min,V(甲醇)∶V(水)=70∶30;4~5 min,V(甲醇)∶V(水)=80∶20;5~5.5 min,V(甲醇)∶V(水)=90∶10;5.5~8 min,V(甲醇)∶V(水)=70∶30)。质谱条件:电喷雾离子源为负离子模式,数据采集方式为多反应监测,离子源温度为150 ℃,去溶剂温度为350 ℃,去溶剂气流量为650 L·h-1,毛细管电压为2.5 kV,碰撞气流量为50 L·h-1。TCS定量离子对为母离子286.9,子离子35.0,定性离子对为母离子288.9,子离子为35.0。该检测方法中,TCS在线性范围1~300 μg·L-1呈良好线性(r2>0.998)。3个加标水平下,TCS的加标回收率为86.3%~108.2%,相对标准偏差(RSD)均≤10%。
1.4 吸附模型及数据处理
本实验采用准一级反应动力学模型、准二级反应动力学模型和韦伯-莫里斯颗粒扩散模型对动力学实验结果进行拟合。公式分别如下:
qt=qe(1-exp(-k1t))
(1)
(2)
qt=kit0.5+ci
(3)
式中:qt是任意时刻t时TCS在MPs表面的吸附量,qe是吸附平衡时TCS在MPs表面的平衡吸附量,k1为准一级反应的反应速率常数,k2为准二级反应的反应速率常数,ki为内扩散模型速率常数,ci为涉及到厚度和边界层的常数。
本实验采用常用Henry吸附模型和Freundlich吸附模型对吸附等温线进行拟合,方程如下:
Henry吸附模型:qe=kdce
(4)
(5)
式中:qe是吸附平衡时TCS在MPs表面的平衡吸附量(μg·g-1);ce是吸附平衡时对应的TCS浓度(μg·L-1);kd是Henry吸附模型中的吸附常数;KF和1/nf都是与温度有关的常数,KF与吸附能力有关。
2 结果与讨论(Results and discussion)
2.1 MPs的表征
对经过冷冻/烘干、粉碎和筛分后符合粒径需求的MPs用扫描电子显微镜(SEM)和傅里叶变换红外光谱(FTIR)进行表征,结果如图1所示,3种MPs粒径均一,集中分布在3~12 μm(>80%),将不同材质MPs的红外光谱图与标准谱图对比分析,发现PE-MPs、PP-MPs和PVC-MPs表面除标准峰外没有其他杂质峰,表明加工处理过程没有改变MPs化学成分,材料可用于后续试验。此外,使用接触角仪测定了PE-MPs、PP-MPs和PVC-MPs的接触角大小,结果如图2所示,PE-MPs、PP-MPs和PVC-MPs的接触角分别为135.1°、142.3°和137.7°
2.2 吸附实验结果
不同材质MPs对TCS的吸附动力学曲线如图3所示。由图3可知,TCS在3种不同材质MPs表面的吸附动力学过程呈现出相似的趋势。吸附开始时,MPs对TCS的吸附速率快,吸附量增加也较快,随着反应进行到24 h,吸附量增长缓慢,吸附逐渐饱和并趋于平衡,这种吸附过程与文献中提到的MPs吸附TCS的过程类似[19]。出现这种结果的原因是吸附前期MPs表面的空余吸附位点多,并且固液两相之间TCS浓度差大,此时,TCS从水相向MPs表面的扩散速率大。但随着吸附的进行,MPs表面吸附位点逐渐减少,固液两相之间TCS浓度差也不断变小,TCS在MPs表面的吸附逐渐趋于平衡。
采用准一级反应动力学模型和准二级反应动力学模型对吸附动力学结果进行拟合,结果如表1所示。准一级反应动力学拟合得到PP、PE和PVC这3种MPs的r2分别为0.59、0.34和0.77;而准二级反应动力学拟合得到3种MPs的r2均在0.99以上,且准二级反应动力学拟合得出的PP-MPs、PE-MPs和PVC-MPs的平衡吸附量分别为1.22、0.53和0.55 mg·g-1,该拟合结果与实验所得3种材质的实际吸附量1.18、0.52、0.54 mg·g-1更为贴近。由此可见,准二级反应动力学能更加准确描述本研究中MPs对TCS的吸附过程。此外,实验结果显示,PP-MPs对TCS的吸附能力显著高于PE-MPs和PVC-MPs(P<0.05)。

图1 不同材质微塑料(MPs)的表征注:(a)扫描电镜图(SEM),(b)粒径分布图,(c)傅里叶红外光谱(FTIR)图;PVC、PP和PE表示聚氯乙烯、聚丙烯和聚乙烯。Fig. 1 Characteristics of microplastics (MPs) of different polymersNote: (a) scanning electron microscope images; (b) size distribution; (c) Fourier transform infrared spectra; PVC, PP and PE stand for polyvinyl chloride, polypropylene and polyethylene.

图2 PVC、PP和PE的接触角Fig. 2 The contact angles of PE, PP and PVC

表1 TSC的吸附动力学模型拟合参数Table 1 Fitting parameters for adsorption kinetics of TCS
为了进一步阐明3种材质MPs对TCS的吸附机理,本研究采用颗粒扩散模型对动力学结果进一步拟合分析,实验结果如图4所示。可以看出,TCS在3种MPs上的吸附过程可以分为3个阶段:第1阶段是TCS在MPs表面的多相吸附过程。在这一阶段,TCS通过疏水分配作用、共价键力和范德华力等作用吸附在MPs表面,其中疏水分配作用最为关键;第2阶段是外液膜扩散过程。在此阶段,TCS从外液膜缓慢地向微孔内进行扩散;第3阶段是吸附平衡阶段。在此阶段,吸附达到饱和,固液两相间TCS达到分配平衡[20]。分析得知,TCS在这3种MPs表面的吸附方式主要为表面吸附和外液膜扩散作用。
吸附等温方程拟合结果如表2所示,Herry吸附模型和Freundlich吸附模型的拟合结果较好。PP-MPs、PE-MPs和PVC-MPs通过Herry吸附模型拟合得到的r2分别为0.918、0.962和0.868,与PVC-MPs相比,PP-MPs和PE-MPs的吸附等温线更趋近于线性,这可能受微塑料本身性质的影响。根据聚合物的玻璃化转化温度,MPs可以分为高弹态和玻璃态。PE-MPs和PP-MPs都属于高弹态,它们的吸附等温线一般呈线性,这主要是因为这类聚合物对有机物的吸附不是简单的表面吸附,而是将吸附的物质分配到聚合物上。PVC-MPs属于玻璃态,它对有机物的吸附主要是表面吸附,随着吸附的进行,PVC-MPs表面的吸附位点会越来越少,吸附速率也会随之降低,从而导致吸附等温线的线性程度有所降低[21]。通过非线性的Freundlich吸附模型进行拟合,3种材质MPs的吸附等温线拟合度r2均高于0.75,拟合效果较好,说明TCS在这3种MPs表面的吸附是多层吸附。PP-MPs、PE-MPs和PVC-MPs的Kf值分别为1.014、0.229和0.255,说明吸附能力大小为PP>PE≈PVC。这与动力学实验结果一致,并且表明MPs的材质对其吸附能力有显著的影响。为了进一步明确MPs材质对其吸附能力的影响。测定了3种MPs的接触角大小,结果发现,PP-MPs接触角最大,接触角越大,表明材料的疏水性越大,从而对有机物的吸附能力越强[19]。

图3 三氯生(TCS)在不同材质MPs表面的吸附动力学曲线Fig. 3 The adsorption kinetics of triclosan (TCS) on MPs of different polymers

图4 TCS在不同材质MPs表面的颗粒扩散模型拟合注:qt表示任意时刻t时TCS在MPs表面的吸附量;t表示吸附时间。Fig. 4 The intraparticle diffusion model of TCS on MPs of different polymersNote: qt stands for the adsorption of TCS on MPs surface at any time; t stands for adsorption time.

表2 TCS的吸附热力学模型拟合参数Table 2 Fitting paramaters for adsorption isotherms of TCS
2.3 累积分布实验结果
暴露6 d后,TCS在斑马鱼各组织器官中的累积量如图5所示。对于单一的TCS暴露,肠道、肝脏、脑、性腺和剩余鱼体中均检出TCS,其累积量分别为191.56、63.92、21.32、25.19和11.59 μg·g-1,其累积规律基本符合肠道>肝脏>脑≈性腺≈剩余鱼体。饮食转移即通过食物链或食物网的生物放大作用是水生生物蓄积TCS的重要途径[22]。进入生物体内的TCS,一部分会在肝脏中经过葡萄糖醛酸化作用或者磺化作用,转化为水溶性更大的代谢物排出体外;另一部分通过血液循环分散到其他组织器官,最后经过肝肠循环排出体外[23]。由于TCS具有亲脂性,因此在脂肪含量高的组织(如肝脏和性腺)中具有高度的生物积累性,而在脂肪含量较低组织中(如肌肉和大脑),生物积累性则会降低[24]。这与本研究得到的结果存在一定的差异,推测可能是污染物的暴露方式、暴露剂量和暴露时间等因素对TCS在体内的累积分布产生了影响。
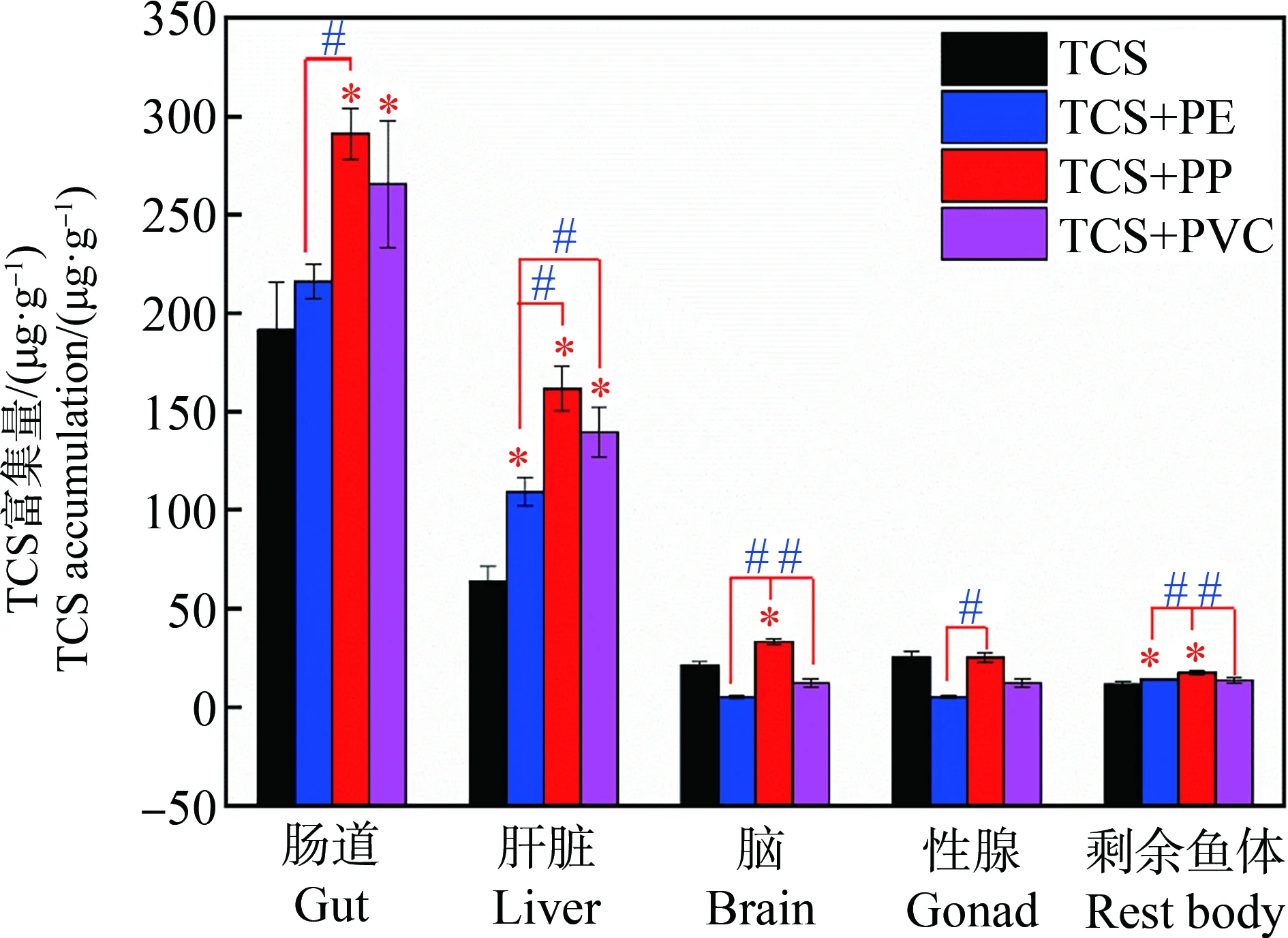
图5 不同实验组中TCS在各组织的累积量注:*表示复合组与TCS组相比具有显著性差异,P<0.05;#表示复合组之间对比具有显著性差异,P<0.05。Fig. 5 The accumulation of TCS in tissues of different experiment groupsNote: *indicates the significant difference between the combined groups and TCS group (P<0.05); # indicates the significant difference between the combined groups (P<0.05).
此外,MPs的存在对TCS在斑马鱼体内的累积分布也产生了影响。与TCS组相比,MPs和TCS的复合暴露组显著提高了TCS在肠道和肝脏中的累积量,其最大累积量分别为291.12 μg·g-1和161.71 μg·g-1。与TCS组相比,PP+TCS组、PE+TCS组和PVC+TCS组中肠道TCS的累积量分别提高了51.9%、12.7%和38.6%(P<0.05),肝脏TCS的累积量分别提高了152.9%、70.9%和118.4%(P<0.05)。与其他复合组相比,PP+TCS复合组的所有检测组织中TCS的累积量均最高(P<0.05),这可能是由于PP-MPs对TCS的吸附量最大所导致。PP-MPs表面吸附TCS越多,以经口摄入途径进入生物体内的TCS量则越大,从而提高了TCS在体内的累积量。
为了进一步分析MPs对TCS在生物体内累积分布的影响,分别计算了实验组中TCS在不同组织器官累积量的百分比,结果如图6所示。TCS的主要累积器官为肠道和肝脏,其累积量占比均达到了80%以上,且复合组中TCS在肠道和肝脏的累积量占比高于TCS组。TCS组中,TCS在脑、性腺和剩余鱼体中的累积量占比分别为6.80%、8.03%和3.70%,而复合组中TCS在脑和性腺中的累积量占比发生了明显的下降,但剩余鱼体中没有发生明显变化。此外,MPs的拉曼显微光谱仪定性分析结果如图7和图8所示,斑马鱼的肠道和肝脏均检测出PP-MPs、PE-MPs和PVC-MPs,而在脑和性腺中则未检出MPs。先期研究发现微米级MPs经胃肠道摄入后,可穿过肠道上皮细胞进入循环系统,进而到达肝脏[25]。由此可知,MPs的吸附及其在生物体内的分布规律对TCS的生物累积影响显著。一方面,MPs显著提高了TCS在肠道和肝脏中的累积量,且MPs吸附能力越强,TCS累积量越高;另一方面,MPs在体内的分布能够影响TCS在体内的累积分布规律,增加了肠道和肝脏的累积,降低了在脑和性腺的累积。这一结果对MPs和其他有机污染物的复合毒性评价至关重要。

图6 不同实验组中TCS在各组织中的累积量占比Fig. 6 The percentage of TCS accumulation in tissues of different experiment groups

图7 不同材质MPs在肠道中拉曼光谱图Fig. 7 The Roman spectroscopy of MPs of different polymers in gut
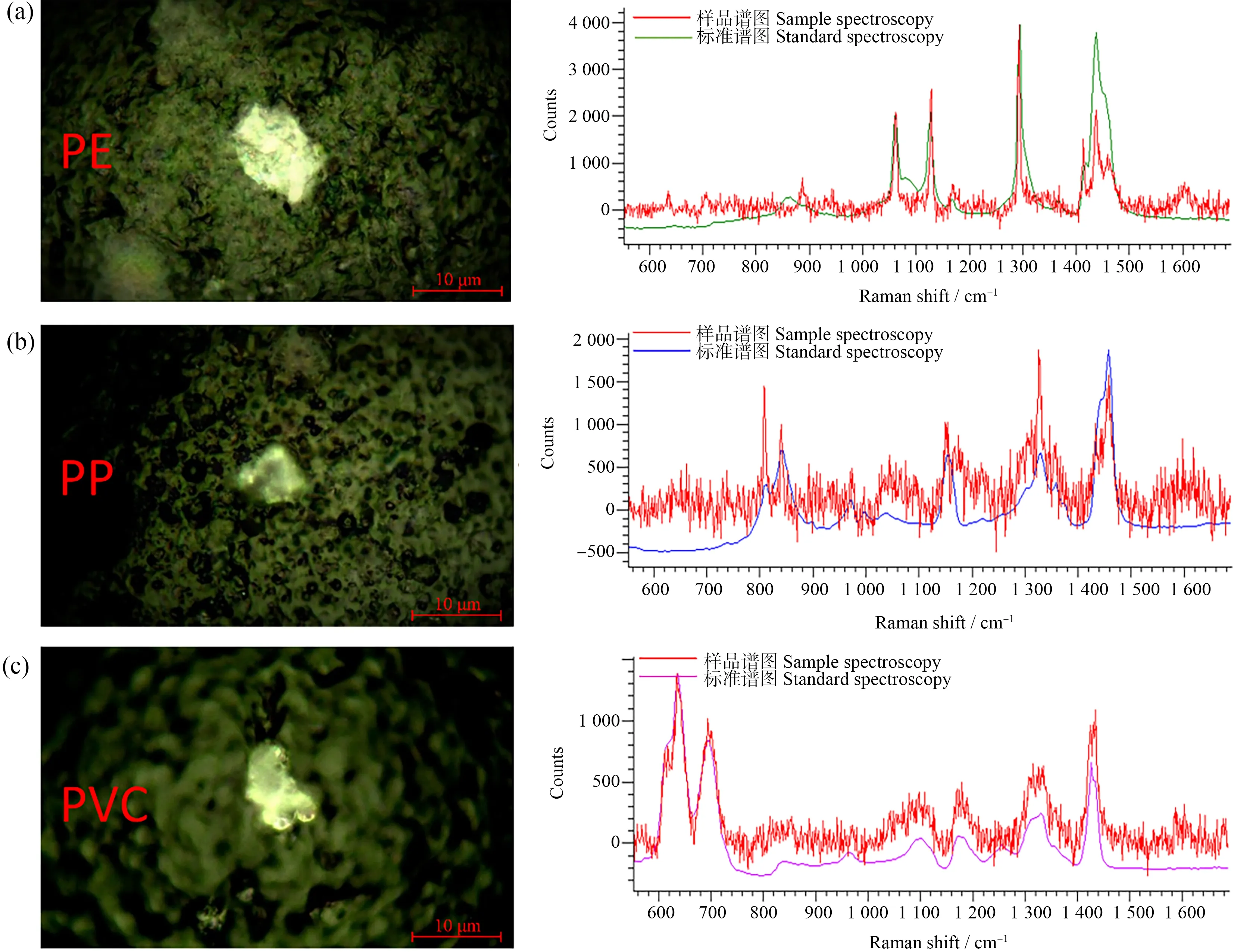
图8 不同材质MPs在肝脏中拉曼光谱图Fig. 8 The Roman spectroscopy of MPs of different polymers in liver
