CT/DSA双重引导下经腰部置入下腔静脉隧道性涤纶透析导管
2020-02-03梁顺添梁永红周忠信
梁顺添 梁永红 冯 超 陈 清 周忠信
病史摘要
现病史女性患者,50岁,因“维持性血液透析6年,拟建立血液透析通路”入院。6年前在当地医院确诊尿毒症,为行维持性血液透析治疗,曾接受多次手术建立和修复血液透析通路(表1)。3个月前患者血液透析通路失功,遂行左上肢动静脉直穿行血液透析,透析质量欠佳,病程中患者精神睡眠胃纳一般,大便正常,无尿,体重无明显变化。
既往史发现乙肝6年余,未行规范诊治,发现血压升高1年余,规律口服降压药控制(具体不详),否认冠心病、慢阻肺、脑卒中、糖尿病、大血管炎、肾病综合征、心力衰竭等病史,否认结核、疟疾等传染病史,否认外伤史,否认输血史,自诉对“阿莫西林”过敏,预防接种史不详。
个人史及家族史无烟酒嗜好,无其他不良嗜好。家人均体健,否认家族性、遗传性病史。
体格检查体温36.2℃,脉搏85 次/min,呼吸20 次/min,右上肢血压157/91 mmHg,左上肢血压145/88 mmHg,右下肢血压178/105 mmHg,左下肢血压166/100 mmHg,身高160 cm,体重61 kg。神志清,慢性病容,贫血貌,精神倦怠。颜面部水肿,口唇无紫绀,伸舌居中。腹软,无压痛及反跳痛,麦氏点无压痛。肾区无叩痛。双侧颈部、双侧锁骨下、双上肢、双侧腹股沟可见陈旧性手术疤痕,胸腹壁及腹股沟区可见明显浅表静脉扩张。四肢活动可,四肢无明显水肿,无色素沉着,皮肤完整,未见足靴区坏死或溃疡,双侧肱动脉、股动脉搏动对称且正常,双侧桡动脉、足背动脉搏动对称且减弱。
实验室检查白细胞计数(WBC) 7.1×109/L,淋巴细胞比值23.5%,中性粒细胞比值59.6%,血红蛋白(Hb)115 g/L,血小板173×109/L,C反应蛋白(CRP)<1 mg/L,白蛋白47.1 g/L,球蛋白28.9 g/L,尿素18.54 mmol/L,肌酐797 μmol/L,尿酸317 μmol/L,葡萄糖4.07 mmol/L,钾4.31 mmol/L,钠139 mmol/L,氯99.8 mmol/L,总二氧化碳22.1 mmol/L,钙2.20 mmol/L,磷2.66 mmol/L,肾小球滤过率4.53 ml/min,B型钠尿肽>35 000 pg/ml,乙肝表面抗原(定量)118 IU/ml,凝血功能、肝胆指标、心酶心梗指标、降钙素原未见明显异常。

表1 患者血管通路手术史
辅助检查
心脏 超声:左室壁增厚,二尖瓣轻度返流;左室舒张功能减低。心电图:窦性心律,轻度ST-T改变。
胸片 (1)双肺上叶纤维灶可能;(2)主动脉硬化,心影增大;(3)胸椎退行性变;肢体血管彩超提示所有的自体内瘘或人工血管均为血栓后机化条索样改变。
全腹部CT (1)胆囊结石;(2)双肾萎缩,考虑慢性肾功能不全改变,左肾结石。
诊断(1)慢性肾脏病(CKD) 5D期;(2)周围血管通路枯竭。
诊疗经过
尝试开通闭塞血管通路 经过手术团队充分讨论,拟定多套手术方案和进行术前演练,同时考虑到患者的年龄、反复多次多部位自体动静脉内瘘(autogenous arteriovenous fistula,AVF)、人工血管动靜脉内瘘(arteriovenous graft,AVG)、非隧道性涤纶透析导管即临时管(non-cuffed catheter,NCC)和隧道性涤纶透析导管即长期管(tunnel-cuffed catheter,TCC)手术史,经济条件等因素,排除腔内开通AVF或AVG的方案,先尝试开通闭塞血管通路。
患者取平卧位,双颈部、前胸部、双腹股沟和双上肢外展消毒,穿刺前予以利多卡因原液局部浸润麻醉,并用Seldinger技术行静脉穿刺术。先尝试穿刺右股静脉三次失败后(图1A);改行左股静脉穿刺,三次尝试仍难以经机化闭塞的左髂外静脉进入下腔静脉(图1B);遂改行细针穿刺右无名静脉,多次尝试中有三次误穿右锁骨下动脉或头臂干,予以常规压迫后放弃右颈部穿刺(图1C);然后尝试经迂曲扩张的颈外静脉下行,穿刺成功后用泰尔茂150 cm超滑导丝难以进入闭塞的左无名静脉(图1D);采用双锁骨下静脉穿刺不成功。术中图像所见,患者常规血管通路几乎闭塞,只能完成经侧枝循环穿刺造影明确病变,难以完成常规经颈胸部或双股静脉TCC置入术,为避免出现误穿动脉继发的颈胸部难以控制的大出血,决定停止尝试穿刺,结束手术。
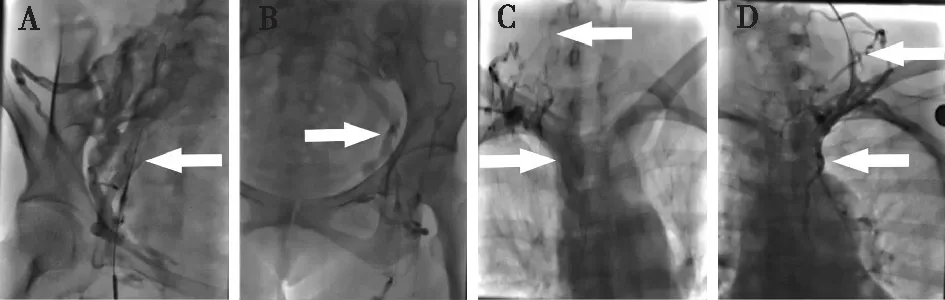
图1 闭塞血管通路造影A: 经右股静脉入路,造影显示右髂外静脉段闭塞;B: 经左股静脉入路,造影显示左髂外静脉段闭塞;C:尝试穿刺右颈部静脉入路,造影显示右颈内静脉及无名静脉闭塞,侧枝循环建立;D:尝试穿刺左颈部静脉入路,造影显示左颈内静脉及无名静脉闭塞,侧枝循环建立
经腰下腔静脉穿刺置管术 嘱患者俯卧于CT检查床上,在CT下定位穿刺点,予以常规消毒铺巾。
短铁棒置于右髂嵴上方5 cm,距中线10 cm,约L3水平作为入路标记(图2A),予利多卡因原液行右腰部穿刺点局部浸润麻醉,在CT引导下,用Seldinger技术成功穿刺下腔静脉,经穿刺针引入泰尔茂260 cm超滑导丝至上腔静脉(图2B),CT明确导丝经右腰置入腔静脉内(图2C-D),排除进入肾静脉内,以无菌敷料包扎固定穿刺针及导丝,转运患者于DSA治疗床上。

图2 CT引导下穿刺下腔静脉A:用短铁棒置于右髂嵴上方5 cm,距中线10 cm,约L3水平作为入路标记;B:在CT引导下,运用Seldinger技术穿刺下腔静脉,经穿刺针留置超滑导丝;C、D:CT明确超滑导丝经腰部组织进入下腔静脉内
DSA透视下确认导丝末端位于上腔静脉后(图3A),再次行腰背部皮肤消毒、铺巾。撤出穿刺针,经导丝引入强生5F造影导管至上腔静脉,经造影导管交换库克260 cm特硬导丝,撤出导丝经造影导管注入适量对比剂(图3B):上腔静脉管壁尚光滑,右无名静脉闭塞,下腔静脉管壁光滑,未见明显血栓、狭窄病变或侧枝循环,遂行下腔静脉TCC(美国柯惠8888145016中心静脉导管29 cm)置入术。紧贴腰部穿刺口向外侧横行切开皮肤约5 cm,蚊嘴钳分开皮肤直至肌层,用扩张器扩张下腔静脉及穿刺道后将带撕脱鞘的扩张器置入下腔静脉内(图3C),拨出撕脱鞘芯,将TCC经特硬导丝沿撕脱鞘置入下腔静脉,同时将撕脱鞘分离并拉出下腔静脉,导管末端位于下腔静脉与右心房交界处(图3D)。回抽TCC动静脉端见血流通畅,肝素盐水封管。用3-0 PROLENE线分别缝合上述皮肤切口,将TCC固定于皮下。术毕,术中失血约10 ml,术中及术后患者无特殊不适,安返病房。
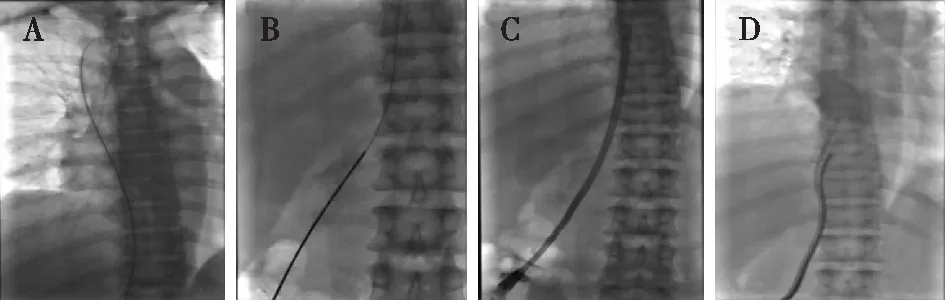
图3 DSA引导下经腰下腔静脉置入TCCA:DSA透视下确认特硬导丝末端位于T3水平左右;B:沿腰部特硬导丝引入造影导管,DSA下造影确认导丝位于腔静脉内;C、D:DSA透视下置入TCC,导管末端位于下腔静脉与右心房交界处
术后随访 术后12h患者到血透室进行常规血液透析,透析流速在250 ml/min,在整个手术及透析过程无诉不适。
术后1周患者返院复查,予以伤口换药时可见右腰部TCC固定无松脱,伤口周围无红肿、皮下血肿及渗液渗血(图4A)。复查胸腹部CT显示TCC体内段全程位于下腔静脉内,未发现易位、扭曲、断裂及血肿形成等并发症(图4B~D)。
术后10个月,患者透析导管流速渐进性下降,多次用尿激酶溶管后效果欠佳,遂返我科处理。术中造影未见下腔静脉管腔狭窄,考虑导管末端纤维鞘形成,因患者透析导管通路无狭窄,遂继续行DSA下经腰下腔静脉TCC更换调整,置换TCC后复查CT未见明显异常(图5)。参照TCC的平均寿命,设定该患者总随访时间为24个月,出院后每3个月进行门诊随访,目前术后14个月随访过程中,患者诉颜面部水肿明显缓解,胸腹部浅静脉扩张减轻,无胸闷气促,无肢体肿胀疼痛,无头晕头痛,无腰痛腿麻,无发热畏寒等不适,精神睡眠食欲可,导管周围无明显渗血流脓,导管固定通畅,复查WBC 5.84×109/L, 中性粒细胞比值57.5%,Hb 139 g/L,CRP<1 mg/L,白蛋白40.1 g/L,肌酐700 μmol/L,钾4.31 mmol/L,钠134 mmol/L,氯99.2 mmol/L,钙2.26 mmol/L,磷2.70 mmol/L,B型钠尿肽9 025 pg/ml,降钙素原 0.655 μg/L,EF=68%,血压控制在150/75 mmHg左右,每周规律透析三次,每次血流量可达250 ml/min,超滤量约2 500 ml。
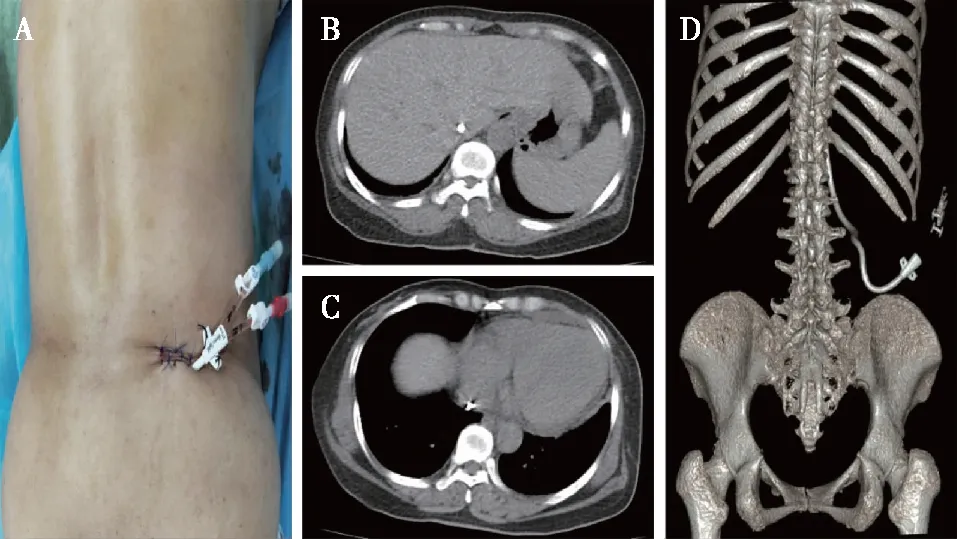
图4 术后1周复查A:右腰部TCC固定通畅,无松脱,伤口周围无红肿渗出、渗血流脓等异常表现;B、C:CT证实TCC全程位于下腔静脉内,多个层面均未发现导管易位、扭曲、断裂、血肿形成及内脏副损伤等并发症,导管末端到达右心房水平;D:右腰部TCC的CT三维重建图像
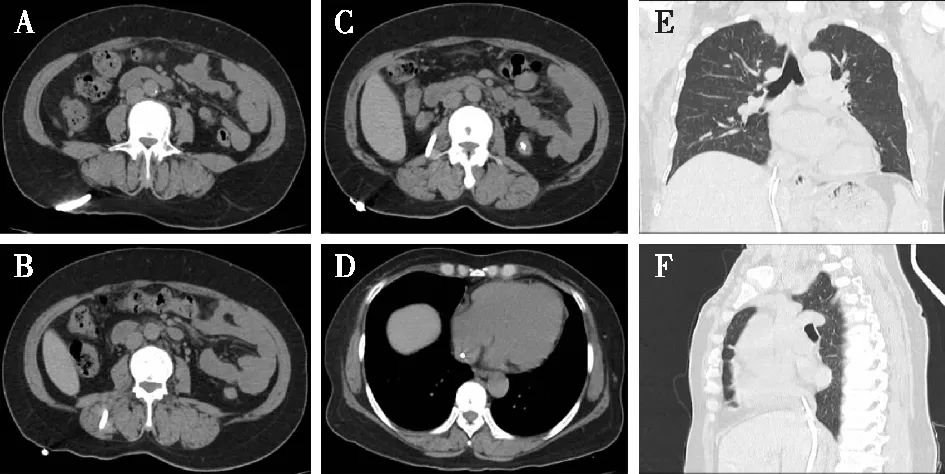
图5 置换TCC术后复查A-C:从CT横断位观察右腰部TCC移行路径分别经过皮下组织、竖脊肌、腰大肌、腰方肌、避开右肾静脉穿入下腔静脉内,其他各层面均未发现导管易位、扭曲、断裂、血肿形成及内脏副损伤等并发症;D-F:分别从CT横断位、冠状位、矢状位扫描确认置换后TCC末端到达右心房与下腔静脉交界水平
讨 论
本次报道为国内首次在CT/DSA双重引导下经腰下腔静脉TCC置入术成功为1例周围血管通路枯竭患者重建透析通路,手术历时2h。面对如此困境,科学家们致力于寻找可行有效的非常规置管方法,如经颈侧支经中心静脉、经颈闭塞静脉经中心静脉、直穿阻塞中心静脉、经腰经下腔静脉、经肝静脉、经皮经肾静脉等[1-3]。与传统方法相比,其并发症发生率、透析流量、导管相关菌血症及使用寿命等方面无显著差异[4]。据报道,肾静脉穿刺置管存在无功能肾动脉分支出血高风险[5]、肝静脉穿刺置管存在透析导管血栓发生率(24/1 000导管日)[6]、移位率(14%~16%)[7]、感染率高(21.7%)的风险[8],因此,本团队决定经腰行下腔静脉穿刺置管。
1985年Kenney教授首次提出经下腔静脉穿刺置管的概念[9],当时置管目的是用于短肠综合征患者的长期肠外营养。到90年代,该术式经过改良后开始用于血液透析治疗,被认为是除常规方法外相对可靠的置管方法,6个月内导管通畅率为52%,13个月内为17%[10]。其并发症包括败血症、纤维蛋白鞘形成、血栓形成、导管移位至皮下软组织、腹膜后及髂静脉[11-12]。回顾性研究分析发现,下腔静脉置管导管感染发生率为2.84/1 000导管日,导管相关菌血症发生率为0.82/1 000导管日,再干预率(需要溶栓或更换导管)为每1 000个导管日入院0.88次,并指出比经股静脉置管具有更好的通畅率和更低的导管感染率[13]。总体而言,经下腔静脉置管并发症发生率较低[14]。
本案例的成功除了得到多学科的支持配合,还需要一定的经验技巧。在穿刺下腔静脉之前,选用短铁棒在腰背部穿刺处协助CT下体表定位,能有效避免盲目反复穿刺造成内脏组织副损伤及皮下血肿的发生。成功穿刺下腔静脉后选用柔软顺应性较好的超滑导丝送至上腔静脉,能避免过硬导丝损伤血管内膜及异位操选。当明确导丝达到上腔静脉,目的是防止操作过程中导丝容易滑脱,减少对心脏刺激,增加安全性及可操作调整空间。然后引入造影导管或长鞘交换特硬导丝,避免后期无法支撑推送透析导管导致置管失败。腰背部皮下隧道与脊柱应成钝角,并充分游离皮下软组织接近肌肉筋膜表面,以减少TCC与下腔静脉过分成角或扭曲,降低发生导管盘曲在皮下软组织、腹膜后甚至血管外的风险。最后在DSA下透视和造影明确TCC走行、形态、末端定位和通畅性,及时处理导管移位、断裂、扭曲和堵塞等问题。综上所述,该术式优势主要体现在先用CT引导下穿刺靶血管(下腔静脉),能提高手术安全性及成功率,在DSA下置入TCC,能明确定位导管位置及导管入下腔静脉处是否成角,更有助于导管顺利置入及调整。
术后10个月,患者腰部TCC血流量渐进性下降,多次用尿激酶溶管后效果欠佳,结合术中造影未见下腔静脉管腔狭窄,考虑导管末端纤维蛋白鞘形成,据文献报道,TCC出现功能不良时纤维蛋白鞘发生率可高达70%[15], CT扫描可发现置入中心静脉导管患者中存在钙化的纤维蛋白鞘层占6%左右[16],基于该病例多次尿激酶溶管效果不理想,遂决定更换置管,如有条件可用纤维鞘剥离器清除纤维鞘包裹。术后14个月复查胸腹部CT提示下腔静脉TCC固定通畅,未见移位、断裂、扭曲现象,尚未出现严重并发症。后续如果该患者再出现通路失功,将视乎具体情况采取相应对策,如复查造影显示下腔静脉通畅,无狭窄闭塞等病变存在,则考虑为导管问题,应选择尿激酶溶栓或再次更换导管,如下腔静脉通路无法修复,则尝试在球囊引导下穿刺上腔静脉置管。
本文采用在CT/DSA双重引导下经腰下腔静脉置入TCC是罕见新颖、有挑战性的术式,具有可操作性和一定的技术优势,但至今在全中国乃至全球并未得到普及推广,其原因可能是:第一,本身为非常规的血管通路方式,肥胖患者可能更易发生导管移位,其适用范围相对狭小;第二,手术难度大,需要多学科协助配合;第三,临床数据不足,其远期通畅率、再干预率等问题有待更多临床试验进一步研究及验证。
总之,维持性血液透析患者在面临血管通路枯竭的情况下,经CT/DSA双重引导下经腰下腔静脉隧道性涤纶透析导管置入术是可行且安全有效的替代手术方案。
