表观扩散系数全容积直方图在鉴别高级别胶质瘤与脑转移瘤中的应用价值
2020-02-03刘文慧钱银锋李小虎
刘文慧 钱银锋 曾 艳 李小虎
高级别胶质瘤及脑转移瘤均为常见的脑恶性肿瘤,二者拥有相似的好发年龄、临床表现及影像学表现,尤其是原发肿瘤不明确的单发转移瘤,通常是影像鉴别的难点,准确地鉴别对后期治疗有重要的指导意义[1]。传统的表观扩散系数(apparent diffusion coefficient,ADC)值测量可重复性很差,受测量者主观因素影响较大。本研究通过比较ADC全容积直方图与传统测量ADC值对高级别胶质瘤和脑转移瘤的诊断效能,探讨ADC全容积直方图在这2种肿瘤鉴别中的优势,现报道如下。
1 资料与方法
1.1 一般资料 选择安徽医科大学第一附属医院2016年5月至2020年5月所有临床诊断为脑肿瘤的患者,并行常规头颅MR平扫、增强扫描及DWI扫描(b=0、1 000 s/mm2)。入组标准:①在进行磁共振检>查之前均未接受手术和其他任何抗肿瘤治疗;②病灶直径>1 cm,图像清晰,无显著运动伪影;③均有手术病理或穿刺病理证实为高级别胶质瘤或脑转移瘤。入组患者共45例,其中高级别胶质瘤20例(WHO Ⅲ级5例,WHO Ⅳ级15例);脑转移瘤25例,原发肿瘤分别为肺癌(15例)、乳腺癌(3例)、食道癌(2例)、卵巢癌(2例)、尿路上皮癌(1例)、胃癌(1例)及子宫内膜癌(1例)。高级别胶质瘤患者中,男性12例,女性8例,年龄40~78岁,平均(55.28±8.32)岁;脑转移瘤患者中,男性13例,女性12例,年龄20~84岁,平均(65.73±12.03)岁。
1.2 MRI成像方法 采用美国GE公司MR 750W 3.0T磁共振扫描仪及8通道头颅相控阵线圈;患者仰卧位,常规平扫序列依次行轴位T1WI、T2WI、T2 flair及DWI。扫描参数:T1WI(TR 2 004 ms,TE 22.4 ms,TI 694 ms,矩阵320×224);T2WI(TR5 100 ms,TE 128.4 ms,矩阵384×224);T2 flair(TR 9 000 ms,TE 119.7 ms,TI 2 471 ms,矩阵 256×224); FOV 240 mm×192 mm,NEX=1,层厚5 mm,层间距1 mm。轴位增强扫描对比剂采用钆喷酸葡胺(Gd-DTPA), 剂量为0.1 mmol/kg,TR 8.5 ms,TE 3.3 ms,矩阵 256×256,FOV 240 mm×216 mm,层厚1 cm,无间距扫描,NEX=1,总扫描时间为222 s。DWI扫描采用单次激发SE-EPI序列,b=0、1 000 s/mm2,TR 4 500 ms,TE 100 ms,矩阵 128×128,FOV 240 mm×240 mm,NEX=1,层厚5 mm,层间距1 mm。
1.3 数据处理 ADC全容积直方图、传统ADC的测量均由2位5年以上经验的放射科医师进行并对测量结果进行评估。将所有患者的DWI图像在GE AW 4.6专用工作站上利用Functool软件重建ADC图。传统ADC测量法即在肿瘤直径最大的层面,避开囊变、坏死及出血等弥散未受限区域,选择DWI呈明显高信号的区域绘制感兴趣区(region of interest,ROI),连续测量3次,取平均值作为肿瘤的ADC值。ADC全容积直方图的测量是将ADC图以DICOM格式导入Osirix,并在ADC图中逐层勾画出肿瘤的边界(参考T2WI图像),将肿瘤每一个体素的ADC值汇总生成ADC全容积直方图及相关参数,包括:峰度、偏度、平均ADC、最大ADC、最小ADC、中位ADC、极差及第10百分位数(P10)、第90百分位数(P90)之间每间隔10个百分位点的ADC。
2 结果
2.1 传统测量法ADC值比较 脑转移瘤患者的平均ADC为(0.89±0.25)×10-3mm2/s,高级别胶质瘤患者的平均ADC为(0.82±0.23)×10-3mm2/s,差异无统计学意义(t=0.453,P=0.623)。
2.2 全容积ADC直方图测量结果比较 高级别胶质瘤多呈正偏态分布(偏度系数>0),直方图的峰型较陡;脑转移瘤的偏度系数值一般小于高级别胶质瘤,峰型多平缓,见图1、2。脑转移瘤患者的最大ADC、极差、偏度系数、峰度系数均低于高级别胶质瘤患者,差异有统计学意义(P<0.05)。见表1。
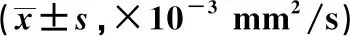
表1 传统ADC值测量及ADC全容积直方图对2种肿瘤的测量结果比较
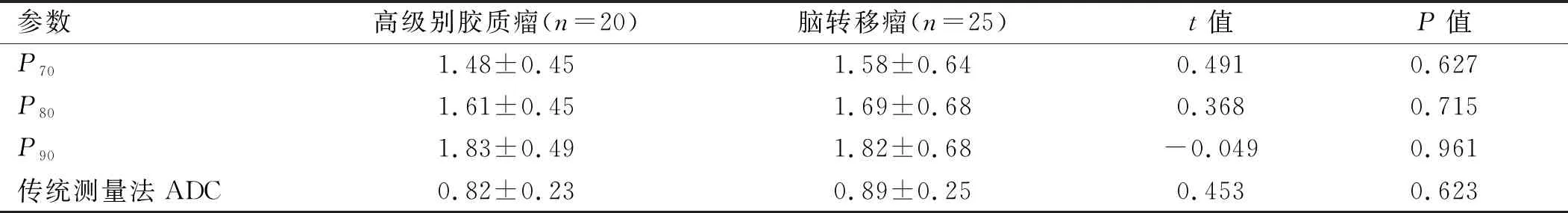
续表1
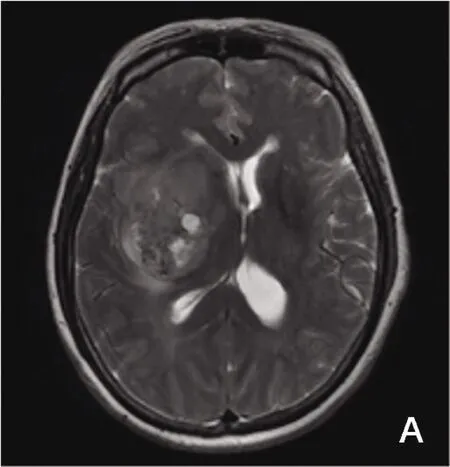
图1 胶质母细胞瘤的边界绘制及ADC全容积直方图
2.3 ROC曲线分析结果 以病理学检查结果为金标准,对两组间差异具有统计学意义的参数进行ROC曲线分析,其中极差的曲线下面积(area under curve,AUC)最大,为0.76,以1.70×10-3mm2/s为诊断阈值其诊断效能最好,其敏感度最高,为84.62%;偏度系数的特异度最高,为90.00%。见表2。
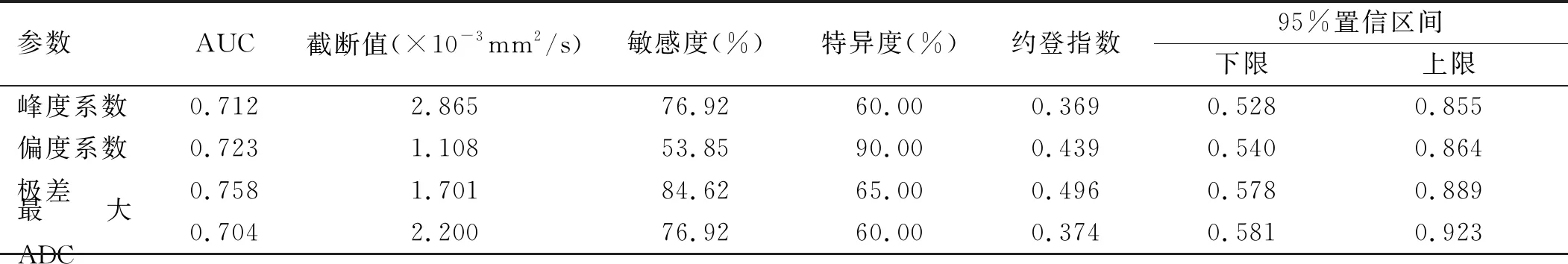
表2 全容积ADC直方图相关参数鉴别高级别胶质瘤与脑转移瘤的ROC曲线分析结果
3 讨论
DWI作为一种功能MRI成像技术,因其可反映水分子的扩散情况而广泛应用于疾病诊断中,ADC值是对组织水分子扩散程度的定量评估指标。传统ADC值测量通常是于病灶DWI高信号区域选取ROI,避开了出血、囊变及坏死区域,得到所选取的ROI内所有像素点的平均ADC值[2],这种测量方法容易出现抽样误差,主观性很强,可重复性不强,结果更侧重于弥散明显受限的区域,无法体现出病灶内细胞结构的异质性及组织密度、代谢方面的信息,导致相关研究结果不一。Chiang等[3]研究认为,高级别胶质瘤实性组织内ADC值低于脑转移瘤,可作为鉴别二者的方式。张劲松等[4]认为高级别胶质瘤与脑转移瘤的实质部分的ADC值没有明显区别。近年来,ADC全容积直方图的研究已成为热点,并在各系统的肿瘤鉴别、肿瘤分级、肿瘤分期及放化疗效果评估方面均有不错的研究成果[5-9]。
在直方图相关参数中,峰度系数反映的是直方图的形态,峰度系数值越大,直方图峰形越陡峭,提示肿瘤的内部结构越致密。偏度系数反映的是直方图数值的分布情况,偏度系数值越高,提示肿块内扩散受限程度越高,坏死囊变少,细胞结构致密。国内研究[10-11]认为,脑转移瘤生长速度快,呈膨胀性生长,瘤内细胞较为松散,而高级别胶质瘤呈浸润性生长,瘤内细胞较为致密,且高级别胶质瘤的的血管增生、血管密度、血管畸变的程度均高于脑转移瘤,故脑转移瘤更易出现坏死囊变。本研究中,高级别胶质瘤的峰度系数值为(4.40±2.08)×10-3mm2/s,偏度系数值为(0.87±0.72)×10-3mm2/s,均大于脑转移瘤的相应参数值,符合其内部结构及病理特点。另外,高级别胶质瘤的极差为(2.14±0.52)×10-3mm2/s,最大ADC为(2.63±0.44)×10-3mm2/s,均高于脑转移瘤的相应参数值,可能是由于脑转移瘤内的细胞均来源于原发肿瘤灶,较为单一,而高级别胶质瘤内的细胞成分较为复杂,包括增生异常的胶质瘤细胞、免疫细胞、新生血管内皮细胞等,甚至可包含多个级别的胶质瘤细胞成分,故异质性较高。本研究的直方图相关参数中,极差的AUC值及敏感度最大,分别为0.76、84.62%,偏度系数的特异度最高,为90.00%。王翅鹏等[12]研究认为小百分位数ADC值在鉴别高级别胶质瘤与脑转移瘤中效能最高,与本研究结果有差异,笔者认为可能由于其研究病例数较少,且只取了单一层面的瘤体作为ROI,并未囊括整个瘤体,同时其转移瘤原发灶种类与本研究不完全相同,可能对结果也有一定影响。
本研究中,高级别胶质瘤传统测量法的ADC值为(0.82±0.23)×10-3mm2/s,低于脑转移瘤患者,差异无统计学意义(P<0.05),与张劲松等[4]研究结果相符。
综上所述,与传统ADC值测量相比,全容积ADC直方图及其相关参数在高级别胶质瘤与脑转移瘤的鉴别中具有优越性,极差为鉴别二者最理想的参数,结合直方图图形,可为影像诊断提供更多参考。
