白茅苷抑制β-catenin/TCF4通路的活化对肝癌HepG2细胞增殖、侵袭和间质转化的调节作用
2020-02-03赵伶伶郭静波白冬梅杨晓晴杜可新
赵伶伶,郭静波,白冬梅,杨晓晴,杜可新
肝癌是世界范围内最常见的三大致死癌症之一。经过医学研究者们数十年的努力,尽管已在其筛查、诊断和治疗等方面运用了新技术,但发病率和死亡率仍不断上升[1]。全球每年约有60万人死于肝癌,其治疗方案需随肿瘤负荷和转移情况的不同而进行调整,遗憾的是,肝癌晚期患者的治疗效果不佳且费用昂贵[2-4]。因此,在医学和医药领域加强对该病的研究是很有必要的。白芷是治疗偏头痛、牙痛和癌症的常用中药,白茅苷(Imperatorin, Imp)是白芷根的主要成分之一,属于天然呋喃果单抗,已被用于治疗神经退行性疾病、心血管疾病、高血压等[5-7];它不仅存在于药用植物中,也存在于常见的烹饪草药中,如欧芹和茴香,如在1型糖尿病大鼠中,Imp可增加胰高血糖素样肽(GLP-1)的分泌,从而降低大鼠血糖水平[8]。此外,Imp还在结肠癌[5-6]、子宫颈癌[9-10]、喉头癌[10]、肺癌[11]和胃癌[12]等多种癌症中抑制或辅助抑制其发展进程。研究人员发现Imp在肝癌中也有一定的作用,有报道称,Imp能作为MCL-1降解诱导剂,在体内和体外诱导肝癌细胞凋亡[13-14]。而本文则以人肝癌HepG2细胞为体外模型,探讨Imp对其增殖、侵袭和间质转化的作用及潜在的相关机制。
1 材料与方法
1.1 试剂与仪器
Imp(纯度≥99.8 %)购自中国食品药品检定研究院。DMEM培养液、胎牛血清和0.25%胰酶均购自美国Gibco公司。RIPA裂解液购自美国Sigma公司。文中用到的抗体均购自英国Abcam公司。BCA试剂盒购自上海易色医疗科技有限公司。BrdU和免疫组化试剂盒均购自上海联硕生物科技有限公司。Matrigel购自美国Invitriogen公司。Ki67抗体(货号AF0198,批号23DB17)、PCNA(货号AF0239,批号23UL54)、VEGF(货号AF5131,批号41CF76)、E-cadherin(货号AF0131,批号92HE38)、N-cadherin(货号AF4039,批号39DG73)、β-catenin(货号AF6266,批号48OH73)、TCF-4(货号DF6275,批号37SL34)和c-Myc(货号AF0358,批号39PS56)均购自美国Affinity Biosciences公司。
Gel View 6000化学发光凝胶成像系统购自广州云星仪器有限公司。电泳仪及半干转膜仪均购自北京六一仪器厂。普通光学显微镜购自日本奥林巴斯公司。
1.2 细胞培养
人肝癌HepG2细胞株购自中国医学科学院基础医学研究所细胞中心。HepG2细胞于37 ℃、5% CO2条件下培养于含有10% 胎牛血清的DMEM培养基中,当细胞融合率>85%时进行传代培养。
1.3 实验方法
1.3.1 Brdu染色检测细胞增殖 以每孔2×106个/mL细胞的密度接种1 mL细胞悬液于6孔板中,细胞生长至贴壁后,在培养液中添加0.4% FBS的继续孵育72 h,每组设置3个平行。将细胞随机分为4组,分别为Control组、50 μmol/L Imp组、100 μmol/L Imp组和200 μmol/L Imp组。各组用相应浓度药物处理后,再添加Brdu使其终浓度为0.03 μg/mL,继续孵育40 min后倾倒掉培养液,运用PBS洗涤3次,多聚甲醛固定10 min后,按照试剂盒说明检测细胞增殖情况,记录Brdu阳性细胞数。
1.3.2 Transwell检测细胞侵袭能力 在涂或不涂Matrigel的Transwell隔室上室中接种密度为4×105个/mL的细胞,用不含胎牛血清的培养液培养,下室加入含有10%胎牛血清的培养液。按照1.3.1分组并处理后继续培养48 h,将迁移至小室下层的细胞用0.1%结晶紫进行染色,每组随机选取5个视野对染色细胞进行计数统计。
1.3.3 划痕实验检测细胞迁移能力 将细胞以1×105个/mL密度接种于12孔板,铺满单层后,用10 μL枪头垂直在孔中间划痕,然后用PBS清洗两次。按1.3.1分组并给药后继续培养24 h。在划痕0 h和24 h拍摄的图像,使用Image J评估细胞迁移能力。划痕闭合率(%)=[(0 h时的划痕面积- 24 h时的划痕面积)/ 0 h的划痕面积]×100%。
1.3.4 移植瘤动物模型建立 SCID裸鼠(年龄:5周)购自北京维通利华实验动物公司,许可证号为SCXK (京) 2018-0011,合格证号:0016557。裸鼠饲养于温度为26~28 ℃,湿度在50%~60%的环境下,光照时间为10 h/d,自由进食灭菌水和无菌饲料,喂养一周,待适应新环境后进行实验。本试验经铁岭市中心医院动物伦理委员会批准,并严格按照实验动物使用的3R原则给予人道关怀。于每只小鼠颈部同一部位给予上述细胞悬液0.2 mL。第2天,将小鼠随机分为Control组、Imp(2.5 mg)组、Imp(5 mg)组和Imp(10 mg)组,分别腹腔注射灭菌PBS、2.5、5和10 mg/kg Imp药液,给药频率为每天1次,连续给药7 d。造模后将裸鼠连续饲养30 d,每5 d测量一次肿瘤体积。肿瘤体积:V=长×宽2/2。
1.3.5 Western blot检测 各组肿瘤组织总蛋白用RIPA蛋白裂解液在冰块上进行提取。各组蛋白浓度用BCA试剂盒检测。将提取的蛋白用SDS-PAGE分离后,转移到聚偏二氟乙烯膜,室温下用5%脱脂牛奶封闭蛋白2 h,加入PCNA、Ki67、VEGF、E-cadherin、N-cadherin、c-Myc、TCF-4和β-catenin的一抗, GAPDH作为内参,4 ℃环境下孵育过夜。第2天弃去一抗,清洗PVDF膜,加入对应二抗,室温封闭1 h后,滴加ECL于暗室曝光显影。
1.3.6 免疫组化检测荷瘤小鼠肝组织内Ki67和VEGF表达 取各组移植瘤组织,用4%多聚甲醛室温固定,常规制备4 μm厚的石蜡切片。严格按照试剂盒说明书测定阳性细胞数目。每个样品选取5个视野,取平均值。阳性率=阳性细胞数/总细胞数×100%。
1.4 统计学方法
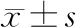
2 结果
2.1 HepG2细胞增殖
与Control组相比,Imp处理组Brdu阳性细胞数显著降低(P<0.05,图1A),且与Imp处理浓度呈反比;同时Imp处理组细胞中Ki67和PCNA相对蛋白表达水平明显降低(P<0.05,图1B),且也呈Imp浓度依赖性。
2.2 HepG2细胞侵袭能力
与Control组相比,Imp处理组Transwell实验侵袭细胞数均明显减少(P<0.05,图2),且随Imp处理浓度增加而明显减少。
2.3 HepG2细胞迁移能力
与Control组相比,Imp处理组划痕实验细胞闭合率均明显下降(P<0.05,图3),且呈Imp浓度依赖性。
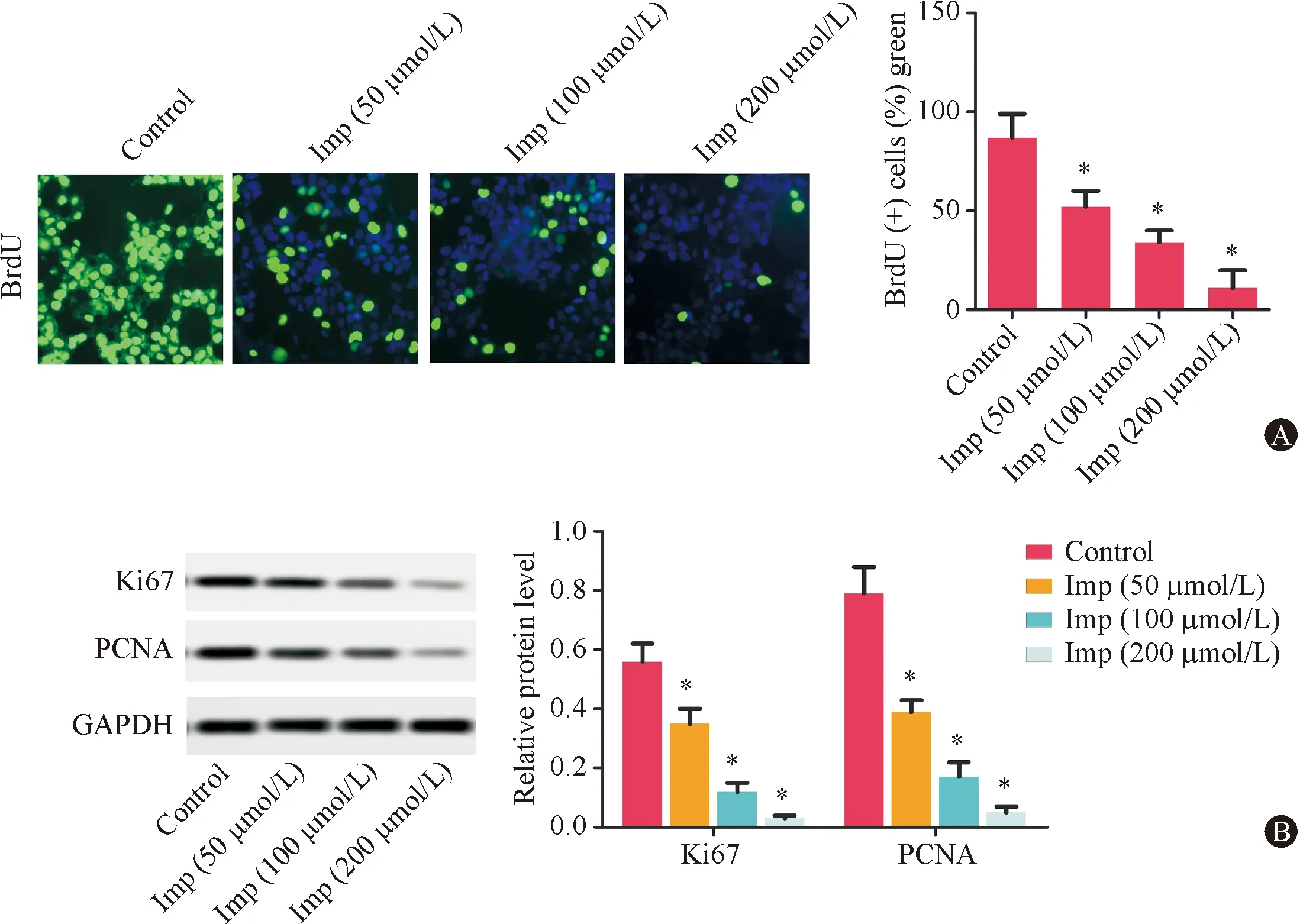
图1 HepG2细胞增殖情况 A: BrdU检测细胞增殖;B: Western blot检测Ki67和PCNA的蛋白表达。与对照组相比,*P<0.05
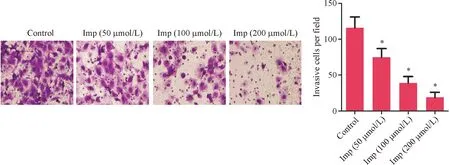
图2 HepG2细胞侵袭能力 与对照组比较, *P<0.05
图3 HepG2细胞迁移能力 与对照组比较, *P<0.05
2.4 HepG2细胞上皮间质转化(epithelial mesenchymal transition, EMT)相关蛋白表达情况
与Control组相比,Imp处理组细胞中N-cadherin和VEGF蛋白水平均显著降低(P<0.05,图4),而E-cadherin的蛋白水平则显著上调(P<0.05,图4),且三者表达量与Imp处理浓度有关。
2.5 HepG2细胞通路蛋白表达情况
与Control组相比,Imp处理组细胞中β-catenin、TCF4和c-Myc的相对蛋白表达水平均显著降低(P<0.05,图5),且随Imp处理浓度增加而降低。
2.6 Imp对移植瘤生长及肿瘤组织中相关蛋白表达的影响
与Control组相比,Imp处理组肿瘤组织体积明显降低(P<0.05,图6A和B);同时,免疫组化结果显示,各组肿瘤组织中Ki67和VEGF阳性细胞数明显降低(P<0.05,图6C和D)。且上述指标趋势呈Imp剂量依赖性。
3 讨论
原发性肝癌是起源于肝脏的上皮或间叶组织的恶性肿瘤,在我国发病率居高不下。虽然现代医学发展快速,但对肝癌相关病因和确切的分子机制尚不完全清楚,目前公认肝癌发病是多因素、多步骤的复杂过程。其治疗需根据病情阶段进行个体化综合治疗,包括手术、肝动脉结扎、射频、冷冻、激光、微波和化疗等方法。大量研究表明,Imp具有多种生物学功能,对心脑血管疾病、糖尿病和多种癌症的治疗均有明显作用[5-14]。因此,我们以人肝癌HepG2细胞为研究对象,研究Imp对其在体内体外生长的影响及其可能机制。
Zheng等[6]报道称Imp可明显抑制人结肠癌HT-29细胞的生长,且能通过上调p53和半胱天冬氨酸酶(Caspase)级联诱导细胞凋亡。在Am等[12]的研究中,Imp对胃癌SGC-7901细胞的生长也具有抑制作用,且具有剂量依赖性;除此之外,还能诱导细胞凋亡和细胞周期阻滞,最终实现对胃癌的抗癌作用。而本文从人肝癌HepG2细胞的增殖、侵袭、转移等方面阐述了Imp对肝癌的抑制作用,即Imp能剂量依赖性地降低Brdu阳性、侵袭和转移细胞数量。
EMT是指上皮细胞失去极性和细胞获得间质特性从而增加细胞转移和侵袭能力的过程[15-16]。EMT参与多种肿瘤的转移和侵袭过程。E-cadherin是重要的细胞粘附因子之一,介导细胞间粘附作用,其表达与肿瘤的转移侵袭具有紧密联系,它的低表达或者表达缺失被认为是肿瘤EMT的关键步骤[17]。据研究人员报道TCF4在犬肾脏上皮细胞中的过表达可促进其侵袭能力,进而加剧肿瘤EMT发生。重要的是,在EMT现象剧烈的肿瘤中上皮标记蛋白E-cadherin明显下调且间质标记蛋白Vimentin显著上升[18]。为进一步探讨Imp的抗癌作用,我们通过实验发现:Imp处理组细胞高表达上皮标记蛋白E-cadherin、低表达间质标记蛋白Vimentin和迁移标记蛋白VEGF。说明Imp能抑制体外培养的人肝癌HepG2细胞之间极性丧失,减缓间质细胞发展进程,减弱细胞转移侵袭能力,进而阻碍HepG2细胞中EMT发生。
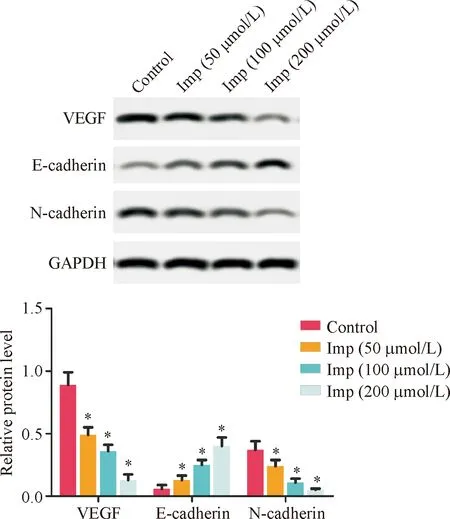
图4 HepG2细胞EMT相关蛋白表达情况 与对照组比较, *P<0.05
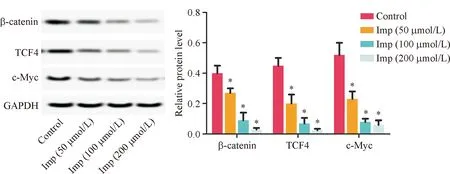
图5 HepG2细胞通路蛋白表达表达情况 与对照组比较, *P<0.05

图6 Imp对移植瘤生长及肿瘤组织中相关蛋白表达的影响 A、B:第30天每组的肿瘤体积; C、D:免疫组织化学方法检测Ki67和VEGF的阳性细胞,并统计结果。与对照组相比,*P<0.05
研究发现,β-catenin可在Wnt信号通路激活时转移到细胞核内竞争性结合TCF4并形成β-catenin/TCF4复合物,从而激活c-Myc 和cycD等TCF4下游转录因子,最终导致细胞增殖异常并促进肿瘤的发生[19]。还有研究发现Wnt信号的异常突变可激活TCF4的靶基因,从而促进结直肠癌的恶性转化[20];下调Wnt /β-catenin信号通路还能抑制非小细胞肺癌上皮间质转化[21]。研究已经表明,Imp能靶向PI3K/AKT/M-TOR信号通路而剂量依赖性地抑制胃腺癌SGC-7901细胞生长[12]。而Imp能否靶向β-catenin/TCF4信号通路对人肝癌HepG2细胞产生影响尚不可知。我们通过实验得出Imp处理可显著抑制细胞中β-catenin、TCF4的表达,并进一步抑制其下游c-Myc的表达。这些结果说明Imp对β- catenin/TCF4信号通路具有显著的抑制作用,进而实现其抑制人肝癌HepG2细胞增殖、迁移、侵袭和EMT发生的作用。Mi等[5]体内实验结果表明,Imp能通过下调mTOR/p70S6K/4E-BP1和MAPK途径抑制缺氧诱导因子-1α(HIF-1α)蛋白的合成,从而抑制人结肠癌HCT116细胞G1期停滞;同时,在移植瘤模型中,Imp能通过抑制血管内皮生长因子阻断肿瘤血管生成和肿瘤生长速度。我们的研究也证实,在人肝癌HepG2细胞中,Imp能抑制其增殖;在移植瘤模型中,则能抑制Ki67、VEGF表达和肿瘤生长。结合上文所述,推测其机制可能与抑制Wnt /β-catenin信号通路活化相关。
综上所述,本文探讨了体外Imp对人肝癌HepG2细胞增殖、迁移、侵袭和EMT的作用以及其在移植瘤小鼠中的作用,说明Imp可以靶向抑制β-catenin/TCF4通路活化从而在体外实现对人肝癌HepG2细胞增殖、侵袭和EMT的抑制作用,同时能抑制肿瘤的体内生长。本研究为进一步探讨Imp在肝癌发生发展过程中的作用提供了实验依据。