内镜下诊治胃底孤立性错构瘤性息肉1例
2020-02-03辛洪杰朱正文王世豪吴伟浩白杨
辛洪杰,朱正文,王世豪,吴伟浩,白杨
胃错构瘤性息肉临床上较为少见,多数病例常合并有P-J综合征、幼年性息肉病等遗传性息肉病病史。近年来陆续有报道提及不伴小肠、结直肠累及的胃错构瘤性息肉的存在,多为单发,无相关胃肠外表现。目前认为其属于一种独立的疾病,与遗传无关。本文报道1例胃底孤立性错构瘤性息肉(gastric hamartomatous polyps, GHP)诊疗过程,以期提高对此病的认识。
1 病历资料
患者女性,53岁,因“发现胃底肿物1周”于2018年7月31日就诊于我院。1周前于外院体检,胃镜检查示“胃底巨大黏膜下肿物,性质不明”。无腹痛、腹胀等不适,血红蛋白、电解质及肝肾功能均无异常,胃肠道肿瘤标志物、粪便OB试验及幽门螺杆菌检测(-),无胃肠道息肉病家族史。腹部CT示胃底后壁黏膜下肿块影,考虑胃间质瘤可能性大。超声内镜检查示:病灶起源于黏膜下层,呈不均匀混合回声光团,边缘呈低回声,中央呈实性不规则回声光团,大小约12.5 mm×24.9 mm,边界清楚,内部无血流信号,固有肌层完整,见图1。
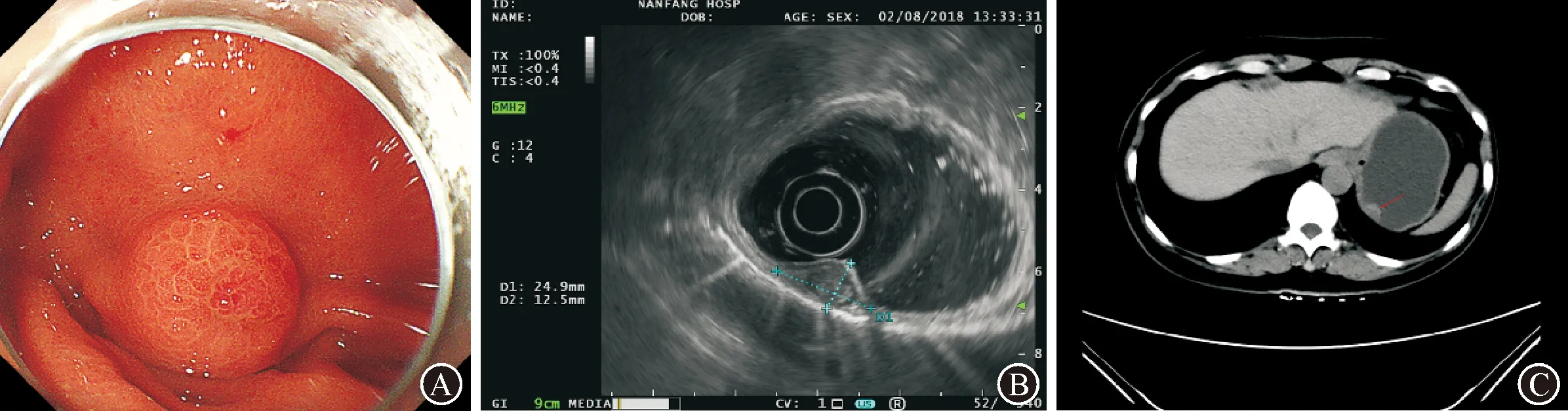
图1 术前检查 A:胃底可见一隆起肿物,中央呈脐样凹陷,黏膜表面光滑;B:EUS探查病灶起源于黏膜下层,呈不均匀回声光团,边缘呈低回声,中央呈实性不规则回声光团,切面大小约12.5 mm×24.9 mm,边界清楚,内部无血流信号,固有肌层完整;C:CT检查,胃底部后壁见一结节状软组织密度影突入胃腔,增强扫描呈中度不均匀强化
为明确肿物性质,患者于2018年8月8日气管插管麻醉下行内镜黏膜下剥离术(ESD),见图2。术后病理(图3):光镜下可见肿物由杂乱的平滑肌与不同程度扩张的胃腺体组成;间质少量炎性细胞浸润,部分区域水肿。免疫组化:CD34(+)、S-100(少量+)、SMA(+)、Desmin(+)、CD117(-)、Dog-1(-)、Ki-67(+,<1%)、β-catenin(腺上皮膜+)。诊断:孤立性错构瘤性息肉。术后予抑酸、禁食、补液等支持治疗,患者术后第4天出院。随访时间至2020年11月3日,患者未诉特殊不适,复查胃镜示创面愈合良好,腹部CT未见异常。
2 讨论
错构瘤成分复杂,脂肪组织和钙化灶是大部分错构瘤的特征表现,极少恶变。目前已知的消化道错构瘤性息肉病有Peutz-Jeghers综合征、Cowden综合征和幼年性息肉综合征,多数具有向消化道恶性肿瘤转化的潜能[1]。胃错构瘤多发生于胃窦和幽门部,胃底部极为罕见,患者临床症状和体征均不明显[2]。本例病变表现为黏膜下肿物,临床上需与胃间质瘤、异位胰腺、胃畸胎瘤、嗜酸性胃肠炎及假性炎症反应增生性病变等相鉴别[3]。超声内镜在胃错构瘤的诊断上具有一定的特异性,它可以辨认病变的起源、血供、与周围组织及器官的关系,但确诊仍需依赖大体组织病理学及免疫组化检测[3]。已报道的病例中术后病理均可见平滑肌组织及畸形增生的腺体[4]。虽然错构瘤并非真性肿瘤,其构成在细胞形态学上无质的异常,但本质上处于畸形与肿瘤之间,可伴发恶性肿瘤,在生长过程中亦可向真性肿瘤发展。国外已有胃错构瘤向胃腺癌转化的报道[5]。因此,该病一经诊断,及时切除是最佳选择,可根据病变大小选择内镜黏膜下剥离术(ESD)[6]或外科手术。同内镜下黏膜切除术(EMR)相比,ESD不受病变大小和溃疡的限制,实现了病变的整块切除,有利于术后病理评估。同外科手术相比,ESD在术后住院时间、花费、远期并发症及生活质量方面明显占优。胃错构瘤性息肉目前报道不多,其癌变的可能性及机制仍不明确,需进一步收集临床病例后汇总讨论。
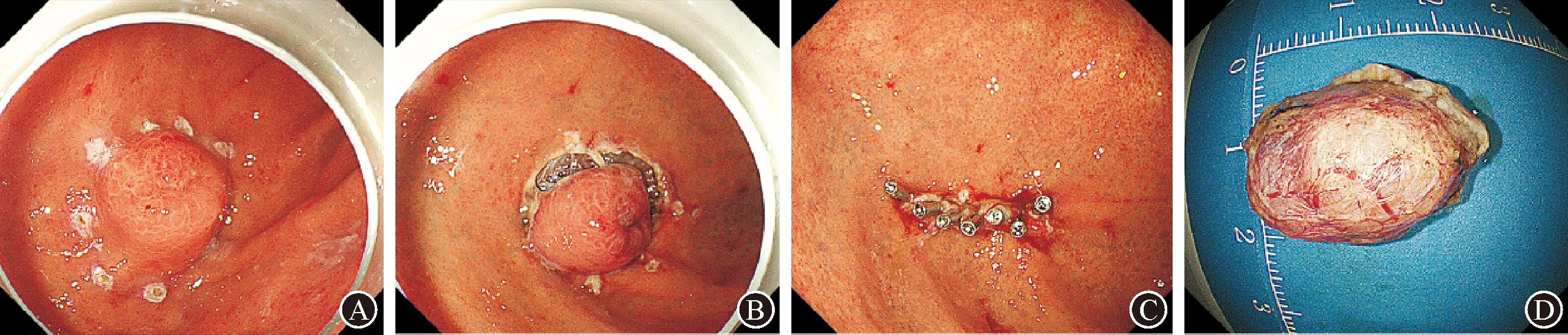
图2 内镜ESD切除 A:APC标记肿物边缘,周边行黏膜下注射;B:HOOK刀沿标记点外侧缘行环周切开,同时联合IT刀完整剥离肿物;C:钛夹夹闭创面;D:完整剥离瘤体
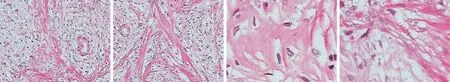
图3 术后病理 光镜下可见肿物由杂乱的平滑肌与不同程度扩张的胃腺体组成;间质少量炎性细胞浸润,部分区域水肿