Alamandine对肝纤维化大鼠肝窦血管生成的抑制作用
2020-02-03宁佐伟李秀梅王亚东李洋
宁佐伟,李秀梅,王亚东,李洋
肝窦是不连续毛细血管,窦壁主要由肝窦内皮细胞(liver sinusoidal endothelial cell, LSEC)组成[1]。LSEC无基底膜,带有开放的窗孔,细胞连接松散并可汇集成筛板,这些特征便于形成低灌注压的动态滤过系统,有利于大分子代谢产物及营养物质及时地进入肝细胞代谢[2]。当肝脏肝纤维化发生时,肝窦内皮细胞持续去窗孔化,形成内皮下基底膜,肝窦出现毛细血管化[3]。越来越多的关于肝纤维化的研究表明:病理性血管生成与肝纤维化的发生二者之间的关系密不可分,激活后的肝星状细胞(hepatic stellate cells, HSC)可分泌促血管生成因子作用于肝窦内皮细胞,使其发生增殖与迁移,可促使血管生成进而促进肝纤维化的发生[4-6]。肝纤维化发生发展过程中具有大量的病理性血管生成与重构,阻碍了肝纤维化的逆转与恢复[7]。Alamandine是肾素-血管紧张素系统(Renin-Angiotensin-System,RAS)中的一个新的组分,研究表明Alamandine可抑制肝纤维化的发生[8],但是Alamandine能否能通过抑制肝窦血管生成来抑制肝纤维化的发生,有关于这方面的研究报道鲜见。我们研究目的在于探讨Alamandine抑制肝窦血管生成的作用机制。
1 材料与方法
1.1 材料及试剂
4周龄wistar SPF级雄性大鼠(南方医科大学实验动物研究所提供);药物注射泵购自美国ALZET公司。主要试剂:Alamandine购自美国Sigma公司; Masson三色染色试剂盒(福建迈新生物技术开发有限公司);免疫组织化学试剂盒和DAB显色剂(北京中杉金桥生物技术有限公司);vWF多克隆抗体(北京博奥森生物技术有限公司);VEGFA多克隆抗体(美国Epitomics公司);荧光二抗(碧云天生物技术研究所)。
1.2 动物模型制备及分组
选取18只wister SPF级雄性大鼠,体重250~300 g,由南方医科大学动物中心提供。适应性饲养1周后随机分为control组、CCL4组、CCL4+Alamandine组,每组各6只。Control组Wistar雄性大鼠腹腔内以2 ml/kg的剂量注射橄榄油,每两周注射一次;CCL4组Wistar雄性大鼠腹腔内以2 ml/kg的剂量注射浓度为40%的溶于橄榄油的CCL4,每两周注射一次;CCL4+Alamandine组:CCL4建立肝纤维化模型,同时在腹腔埋注射泵,以25 μg·kg-1·h-1的速度持续注射Alamandine[9]。4周后宰杀动物、取材。
1.3 组织学检测
取肝组织置于4%的多聚甲醛中固定24 h,然后梯度酒精脱水,石蜡包埋后切片(4 μm/片),再烤片,常规脱蜡至水,行HE染色。采用Metavir评分系统[3],F0:无纤维化;F1:肝门束扩大,但未形成间隔;F2:肝门束扩大,有小的间隔形成;F3:间隔很多,无肝硬化;F4 肝硬化。对于不同分级给予相应分数,F0:0分;F1:1分;F2:2分;F3:3分;F4:4分。行Masson染色测定胶原面积,各组每张切片随机选取5个视野,显微图像分析系统分析,测定灰度值。
1.4 免疫组织化学
取大鼠肝组织置于4%的多聚甲醛中固定24 h,梯度酒精脱水,石蜡包埋后切片(4 μm/片),烤片常规脱蜡至水,微波修复抗原;加入1 ∶1 000抗vWF、 CD-31、VEGFA抗体4 ℃孵育过夜;辣根过氧化物酶标记的羊抗兔二抗(1 ∶5 000)孵育1 h,DAB显色,苏木素染核。PBS代替一抗做阴性对照。蛋白表达部位呈有别于背景的棕色,判定为阳性,各组每张切片随机选取5个视野,显微图像分析系统分析,测定灰度值。
1.5 组织免疫荧光
取大鼠肝组织置于4%的多聚甲醛中固定24 h,梯度酒精脱水,石蜡包埋后切片(4 μm/片),烤片常规脱蜡至水,微波修复抗原,用TBSx(TBS+0.25%曲拉通)洗片3次,5%牛血清白蛋白室温封闭1 h,分别加入vWF(1 ∶200)、CD-31(1 ∶200)、VEGFA(1 ∶200)一抗4 ℃封闭过夜,TBSx洗片3次,加入与一抗对应的荧光二抗(碧云天)室温1 h,TBSx洗片3次,后以DAPI染核3 min,TBSx洗3遍,用正置显微镜荧光检测。
1.6 Western blot
取大鼠肝组织提取总蛋白,然后测蛋白浓度。各组总蛋白均以50 μg组织上样。电泳过程中,上胶电压60 V 40 min,下胶电压110 V 70 min。然后以130 mA恒流转膜,根据分子量的大小设定转膜时间,5%脱脂奶粉室温封闭1 h,分别加入vWF(1 ∶1 000)、CD-31(1 ∶1 000)、VEGFA(1 ∶1 000)一抗,4 ℃孵育过夜。分别加入辣根过氧化物酶标记二抗(1 ∶5 000,Santa Cruz Biotechnology Inc. CA, USA)室温孵育1 h,ECL显色系统进行显色。
1.7 统计方法
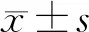
2 结果
2.1 组织学改变
HE染色(图1)显示,CCL4组肝脏胶原纤维显著增生;CCL4+Alamandine组大鼠肝组织胶原纤维增生明显减轻。CCL4组纤维化评分4分4只,3分2只;与Control组评分均为0分;CCL4+Alamandine组评分2分2只,1分4只。三组评分比较差异有统计学意义(H=16.105,P<0.001),两两比较均有统计学差异(P<0.01)。肝组织切片Masson染色显示,Control组大鼠胶原着色仅见于血管壁,CCL4组肝脏胶原纤维明显增加,形成纤维隔。CCL4组胶原面积灰度值与Control组相比显著增加(62.36±5.38对比0.96±0.13,P=0.000),差异有统计学意义;CCL4+Alamandine组胶原面积灰度值与CCL4组相比显著减低(19.28±2.75对比62.36±5.38,P=0.000),差异有统计学意义(图2)。
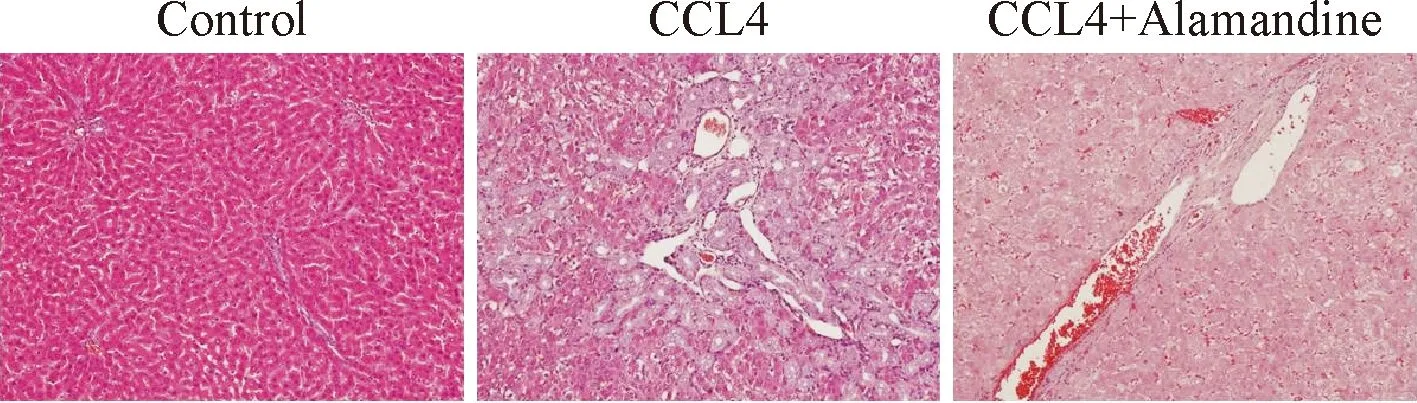
图1 各组大鼠肝组织HE染色图片(×200) Control组肝组织正常;CCL4组肝组织胶原纤维明显增生,形成纤维隔,形成假小叶趋势;CCL4+Alamandine组汇管区可见胶原纤维轻度增生,未形成纤维间隔
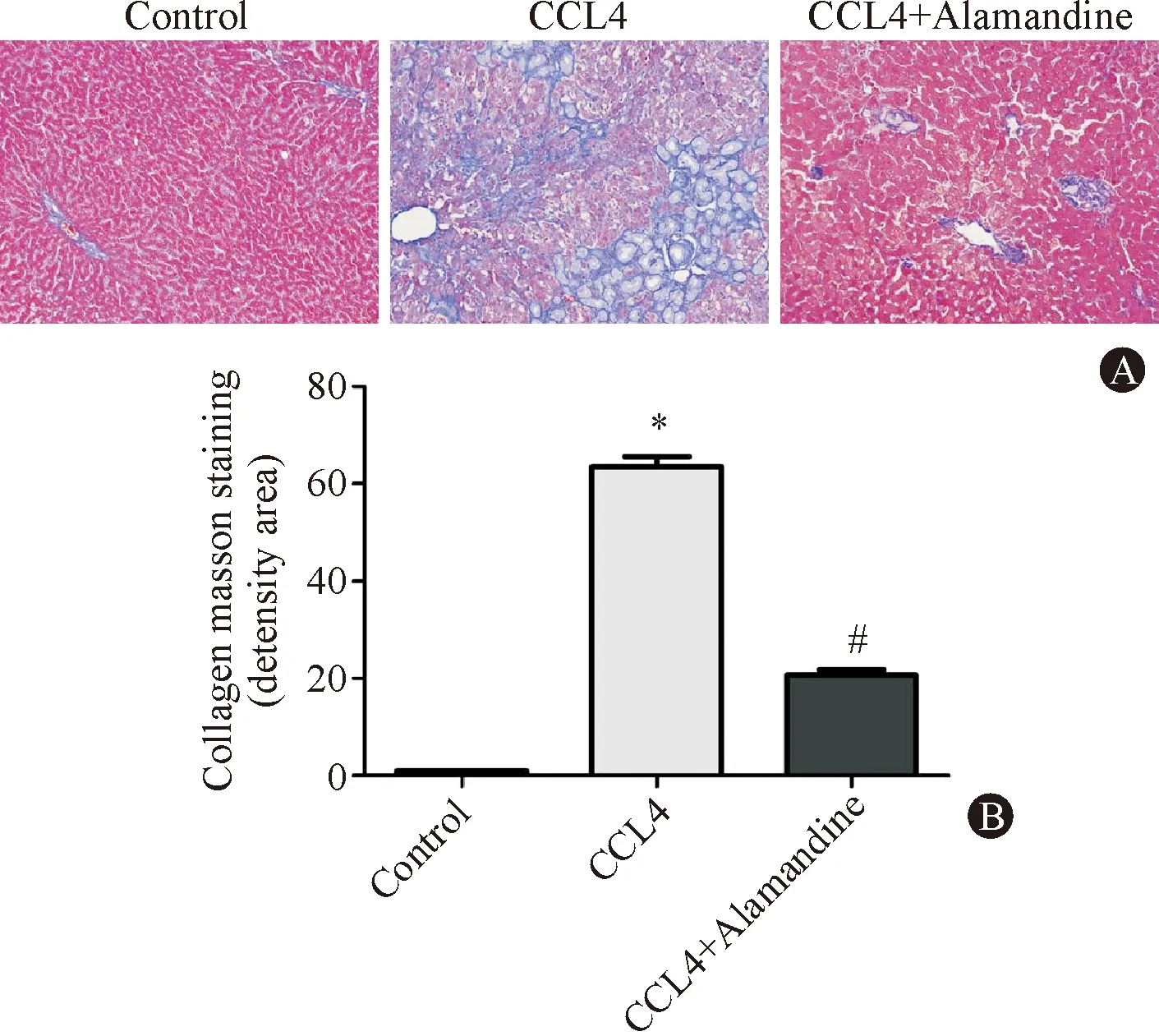
图2 各组大鼠肝组织Masson染色图片(×200) A:Control组肝组织正常,仅汇管区少量胶原纤维染色(蓝色);CCL4组肝组织胶原纤维明显增生,形成纤维隔,有形成假小叶趋势;CCL4+Alamandine组汇管区可见蓝色胶原纤维轻度增生,未形成纤维间隔。B:各组大鼠Masson染色灰度值,*与Control组比较P<0.05;#与CCL4组比较,P<0.05
2.2 免疫组化
目的蛋白阳性表达呈与背景有别的棕色颗粒,vWF经灰度值分析显示:与Control组相比,CCL4模型组的vWF表达水平升高(28.35±0.37对比1.00±0.05,P=0.000),CCL4+Alamandine组与CCL4组相比vWF表达量明显下降(4.58±0.12对比28.35±0.37,P=0.000)。VEGFA经灰度值分析显示:与control组相比,CCL4模型组的VEGFA表达水平升高(40.18±2.63对比1.00±0.08,P=0.002),差异有统计学意义;CCL4+Alamandine组与CCL4组相比VEGFA表达量明显下降(3.16±0.32 对比 40.18±2.63,P=0.037),差异有统计学意义(图3)。
图3 各组大鼠肝组织中血管生成标志蛋白免疫组化结果(DBA,×200) Control组肝组织仅极少量呈棕黄色阳性表达细胞;CCL4组肝组织胶原纤维间隔可见大量呈棕黄色阳性表达的细胞;CCL4+Alamandine组汇管区及肝窦可见中等量棕黄色阳性表达细胞(*与Control组比较P<0.05;#与CCL4组比较,P<0.05)
2.3 免疫荧光
在免疫荧光染色的图片中,与Control组相比,CCL4组中表达血管生成的标志(vWF、VEGFA)的细胞显著增多;而与CCL4组相比,CCL4+Alamandine组中vWF、VEGFA表达的细胞显著减少(图4)。
2.4 Western blot
对Western blot结果用pro-gel analyzer软件进行灰度分析,vWF经灰度值分析显示:与Control组相比,CCL4组肝脏总蛋白中的血管生成的标志vWF表达水平明显增加(0.82±0.07对比0.25±0.06,P=0.000);而与CCL4组相比,CCL4+Alamandine组的vWF表达水平明显下降(0.23±0.06对比0.82±0.07,P=0.000)。VEGFA经灰度值分析显示:与Control组相比CCL4组肝脏总蛋白中的血管生成标志VEGFA表达水平明显增加(0.57±0.04对比0.14±0.03,P=0.006);而与CCL4组相比,CCL4+Alamandine组的VEGFA表达水平明显下降(0.14±0.05对比0.57±0.04,P=0.000),差异有统计学意义(图5)。
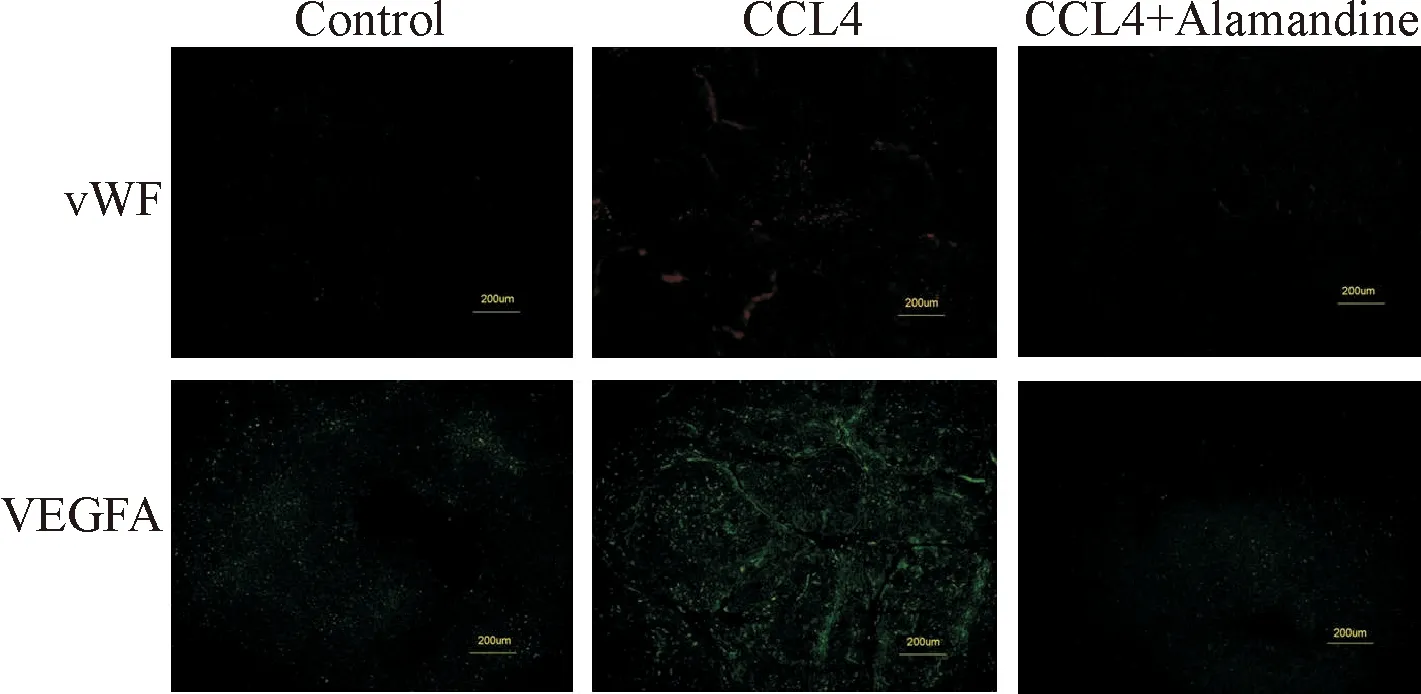
图4 各组大鼠肝组织中血管生成标志蛋白免疫荧光染色的结果(×100) Control组中表达血管生成标志蛋白的细胞极少,荧光极弱,只在汇管区和中央静脉的大血管部位表达;CCL4组中表达血管生成标志蛋白的细胞明显增多,荧光很亮,主要表达在纤维间隔周围;而CCL4+Alamandine组中表达血管生成标志蛋白的细胞比CCL4组明显减少,只有零星的荧光点
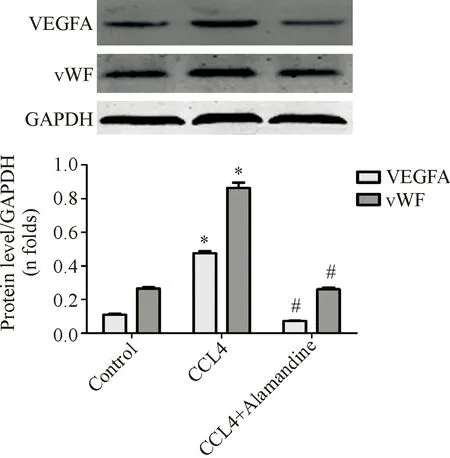
图5 各组大鼠肝组织中血管生成标志蛋白含量的改变 *与Control组比较P<0.05;#与CCL4组比较,P<0.05
3 讨论
血管新生为在原有的血管结构基础上通过套叠增生及芽生的形式生成新血管的生物学过程,主要有生理性和病理性两类[10]。肝纤维化发生发展进程中主要存在病理性血管新生类型,该类型主要有两种形式:其一为一般性血管内皮细胞生成新生血管的过程, 其二为肝窦内皮细胞特有的生成新生血管的形式。肝窦内皮细胞特有的生成新生血管的过程并非使血管数量增多,而是肝窦内皮细胞的增殖及迁移使之去分化,促使肝窦发生毛细血管化进而形成初步的血管结构,而肝窦毛细血管化是肝窦内皮细胞生成新生血管的主要病理改变[11]。肝窦是由库否细胞、肝星状细胞、隐窝细胞及内皮细胞组成的一种特殊的毛细血管[12],内皮细胞大约占4种细胞中的70%,连接汇集成肝窦的内壁,且内皮下没有基底膜,肝窦壁的窗孔是开放的、没有横膈膜,便于物质的交换[13]。肝纤维化发生发展进程中,细胞外基质(extracellular matrix, EMC)的生成多于分解使之沉积,促使内皮下形成连续的基底膜及肝窦内皮细胞持续去窗孔化,进而生成连续的新生血管,该病理性血管的生成阻碍了肝细胞和肝窦之间的物质交换以及加重肝细胞的缺氧,导致肝功能异常及门静脉循环障碍,加速了肝纤维化发生发展的进程[14]。
大量研究证明血管内皮生长因子(VEGF)是最为重要的促血管生成的因子,其可促使血管内皮细胞增殖及毛细血管化,在新生血管生成过程中发挥重要作用[15]。我们的研究对VEGF家族的代表VEGF-A在各个分组老鼠肝组织中的表达丰度进行了检测,结果显示,当大鼠肝脏发生肝纤维化时,VEGFA表达量会增加。而在CCL4诱导的肝纤维化大鼠体内泵入Alamandine时,VEGFA表达量明显下降,证明了Alamandine可通过抑制血管内皮生长因子的表达进而抑制肝窦内皮毛细血管化及肝窦血管的生成,当肝窦内皮毛细血管化及肝窦血管的生成收到抑制后肝纤维化的程度也明显减轻。血管性血友病因子(vWF)是由血管内皮细胞合成并分泌的一种稳定性强的多聚体高分子糖蛋白,是内皮细胞连续性的标志,正常肝窦内皮细胞很少表达vWF,当内皮细胞受到损伤或刺激而激活后,内皮细胞的vWF表达量升高[16]。当肝脏发生纤维化时,肝窦内皮细胞不但发生毛细血管化,而且vWF的表达增高[17]。我们的研究通过不同方法对各个分组老鼠肝组织中vWF的表达进行检测,结果显示,当肝组织发生纤维化时,肝窦内皮连续性标志物vWF表达升高,表明,在发生肝纤维化时,肝窦内皮细胞固有特征消失、表型发生变化,开始出现连续性肝窦内皮细胞毛细血管化,进而阻碍了肝窦微循环及细胞间的物质交换。当CCL4诱导的肝纤维化大鼠体内泵入Alamandine时,vWF的表达量下降,证明了Alamandine可抑制肝窦内皮细胞毛细血管化及肝窦连续性血管的生成,使肝窦微循环及细胞间的物质交换得到改善。vWF与VEGFA检测结果及趋势呈现一致性。
肝纤维化进一步发展至肝硬化的过程中,存在大量的肝窦内皮细胞去分化、毛细血管化、血管新生和重塑等病理变化,可阻碍肝窦物质及氧的交换,加重肝纤维化的发生,最终导致门脉高压甚至肝脏衰竭[18]。肝肝纤维化过程中生成的新生血管结构紊乱、未成熟,并不能真正促进肝窦微循环反而加剧肝细胞的损伤[19]。因此,肝窦新生血管形成与肝纤维化的发生存在恶性循环,肝纤维化的发生促使肝窦血管新生,肝窦新生血管的形成加重了肝纤维化的发生。最近研究表明血管紧张素II(Ang II)不但可促使肝脏发生肝纤维化,而且可促进肝组织中VEGFA、vWF的表达[20],进而促使肝纤维化发生发展进程中肝窦毛细血管化及连续性血管的生成。Alamandine是新近发现的肾素-血管紧张素家族的成员之一,可抑制AngⅡ的作用[9],我们的研究也证明了上述结论。虽然有大量研究表明Alamandine可抑制肝纤维化的发生,但Alamandine在抑制肝纤维化发生的过程中抑制了肝窦内皮细胞毛细血管化及连续性新生血管的形成具有较强的创新性,是个新的研究领域。因此, 深入研究肝纤维化发生发展进程中Alamandine抑制肝窦内皮细胞毛细血管化及连续性血管生成的机制对慢性肝病的防治具有深远的意义。