基于网络药理学与分子对接探讨黄芪-女贞子药对治疗阿尔茨海默病的作用机制
2020-02-02陈博威刘柏炎唐荣梅
陈博威,易 健,刘柏炎,3*,唐荣梅,曾 铖
1湖南中医药大学,长沙 410208;2湖南中医药大学第一附属医院,长沙 410007;3益阳医学高等专科学校,益阳 413000
阿尔茨海默病(Alzheimer’s disease,AD)是老年性痴呆的主要类型,以认知、生活功能逐渐下降为主要临床表现。随着人口老龄化的逐渐加剧,我国AD的发病几率逐年递增,导致大量老年人日常生活质量难以逆转的下降,给家庭、社会带来了沉重的负担。AD发病机制十分复杂,目前主要考虑与β-淀粉样蛋白(amyloidβ-protein,Aβ)的沉积和微管相关蛋白Tau的过度磷酸化有关,包括突触丢失、特异性神经递质减少、神经炎症和神经元死亡等多种病理过程[1]。多年以来,美国FDA仅批准了极少数治疗AD的药物上市,即乙酰胆碱酯酶(acetyl cholinesterase,AChE)抑制剂和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)拮抗剂,但目前的药物效果均不理想。如今,如何有效的防治AD,延缓老年人记忆及认知功能的下降已成为研究热点之一。
中医药治疗AD在我国已有数百年的历史,其疗效已经得到认可[2]。有研究发现,相较既往单纯以补肾填髓治疗AD的方法,现代中医常在此基础上配伍益气活血药[3],黄芪-女贞子药对(Astragalus Radix-Ligustri Lucidi Fructus,AR-LLF)便是其思想体现。黄芪味甘性温,可外固表虚、充盈腠理、升阳举陷;女贞子味甘、苦、性凉,能滋补肝肾,长养精神。课题组前期研究表明,女贞子的活性成分齐墩果酸能够促进神经干细胞增殖,发挥神经保护作用[4],此外黄芪提取物黄芪多糖也具有减轻AD小鼠神经炎性反应,并改善认知功能的功效[5]。然而,既往的研究多针对单一靶点与单一机制,无法系统的分析黄芪女贞子配伍治疗AD多成分、多靶点的协同作用特点。
网络药理学是一种新兴的药物研究方法,可有效弥合现代医学与传统医学之间的鸿沟,极大地促进中药协同作用的机理研究,能够系统揭示中医药的多靶点效应。目前,研究者已将网络药理学广泛应用于中药药效物质基础研究、复方及药对配伍规律的认识和新药开发等[6]。因此,本研究拟通过网络药理学手段,辅以生物信息学与分子对接技术,希望进一步阐明黄芪女贞子药对治疗AD的分子机制。
1 资料与方法
1.1 药物活性成分筛选与作用靶点预测
运用中药系统药理学数据库(TCMSP,http://tcmspw.com/tcmsp.php)获取黄芪、女贞子的活性成分及预测靶点。依据药物的药动学特性,以口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug like,DL)≥0.18为筛选条件[7],并通过手工筛选,保留部分有明确实验依据证明其对神经有保护作用的成分。如有文献报道黄芪甲苷可能通过抑制小胶质细胞活化介导的神经炎症反应来改善AD小鼠的学习记忆功能[8],而齐墩果酸能够改善AD大鼠的突触可塑性[4],且对AChE有很好的抑制作用[9]。随后在该数据库中输入各活性成分,查询其潜在作用靶点,并将靶点导入Uniprot数据库(http://www.uniprot.org),获取靶点官方基因名。
1.2 疾病靶点的收集
从基因表达数据库(GEO,https://www.ncbi.nlm.nih.gov/geo)下载编号为GSE28146的基因原始数据,该基因数据来自美国肯塔基州立大学,包含22个阿尔茨海默病患者的大脑标本,及8个健康捐献者的大脑标本,基因探针平台为GPL570(http://www.agilent.com)。通过R语言(https://www.r-project.org)“limma”包进行基因数据挖掘,得出差异表达基因,并用R语言“pheatmap”包绘制火山图及热图。同时以“Alzheimer’s disease”为关键词,检索人类基因数据库(GeneCards,https://www.genecards.org),获取AD已知靶点后,将上述已知标靶与GEO筛选出的差异表达基因合并,构建AD的靶点库。
1.3 筛选药物-疾病核心作用基因
通过Perl软件相关脚本,将黄芪、女贞子的预测靶点与AD的相关靶点取交集,获取药物-疾病关键作用基因。运用Cytoscape软件创建活性成分-靶点网络图。接着通过String数据库,输入上述获得的关键作用基因,物种设定为“Homo sapiens”,最低互动得分设置为0.4,得到蛋白互作网络图。String数据库是一个储存蛋白质相互作用的数据库,可对每个蛋白相互作用信息进行评价赋分,由此可以得到黄芪-女贞子药对治疗AD中排名前列的核心作用基因。
1.4 核心作用基因的富集分析
运用R语言将得到的关键作用基因进行基因本体(GO)功能富集分析及京都基因与基因组百科全书(KEGG)通路富集分析。GO功能富集分析描述了基因产物可能形式的分子功能,参与的生物过程和所处的细胞环境。KEGG通路富集分析是指通过将已知的基因组注释信息进行分类,得出最显著的生物学过程。由此可以预测黄芪-女贞子活性成分治疗AD的可能作用机制。
1.5 分子对接分析
先用ChemOffice 16.0软件将主要活性成分的3D结构保存为mol2格式并使其能量最小化。从PDB数据库(https://www.rcsb.org/)下载主要靶点的3D结构PDB格式,运用PyMOL软件(www.pymol.org)对蛋白质进行去水、加氢等操作,利用Auto Dock 4.2软件将化合物及靶蛋白格式转换为pdbqt格式,最后进行对接,能量范围设置为3,精度为8,输出9个预测结果,并选取其中结合能最小的对接模型。一般认为结合能小于-5 kJ/mol时[7],配体与受体可以较好结合。
2 结果
2.1 药物活性成分筛选与作用靶标预测
通过TCMSP数据平台得到黄芪、女贞子的活性成分及预测靶点,辅以手工检索,删除重复或暂无靶点的活性成分后,共计获得活性成分26个,挖掘作用靶点213个,药物活性成分详见表1。
2.2 阿尔茨海默病的相关靶点的收集
基于GSE28146的GEO基因原始数据,以Log2(FC)的绝对值大于1.5和P<0.05为筛选条件,总共得出372个差异基因(见图1和图2)。同时检索GeneCards数据库中AD的预测靶点,与GEO筛选出的差异表达基因合并,删除重复项后共计挖掘出阿尔茨海默病的靶点937个。
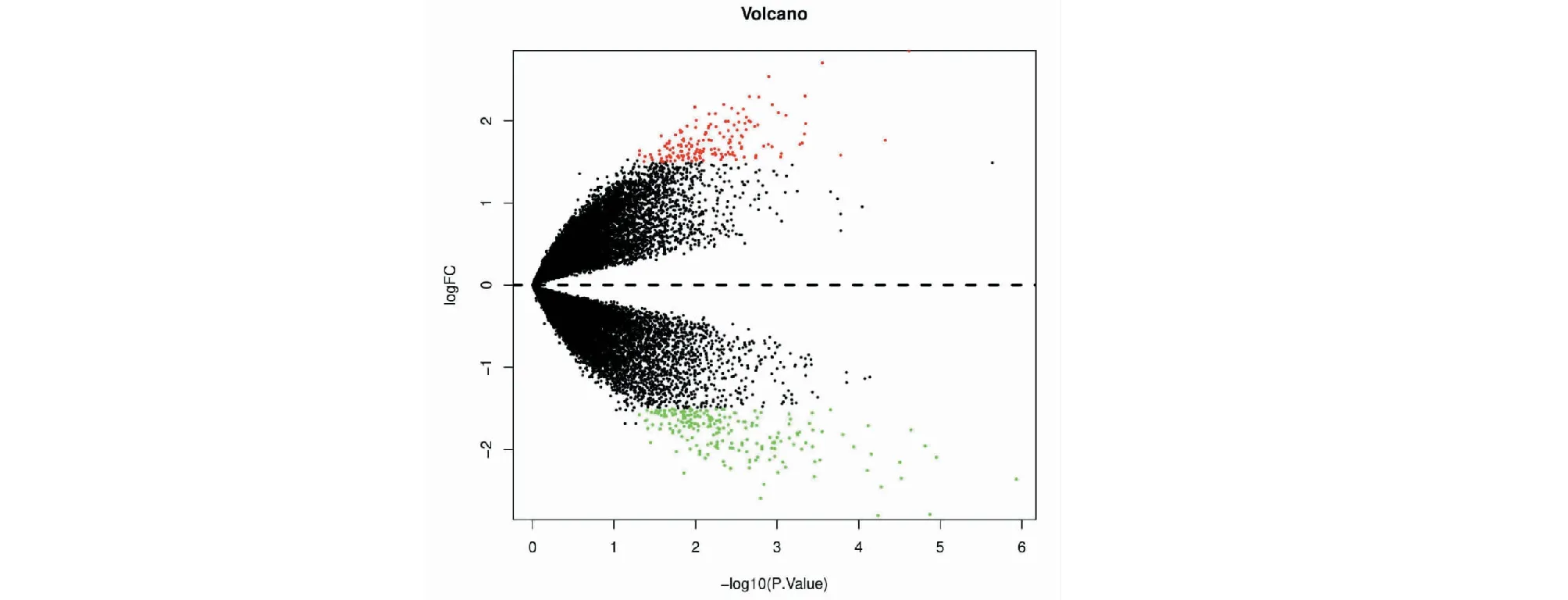
图1 差异表达基因的火山图Fig.1 Volcano map of differentially expressed genes
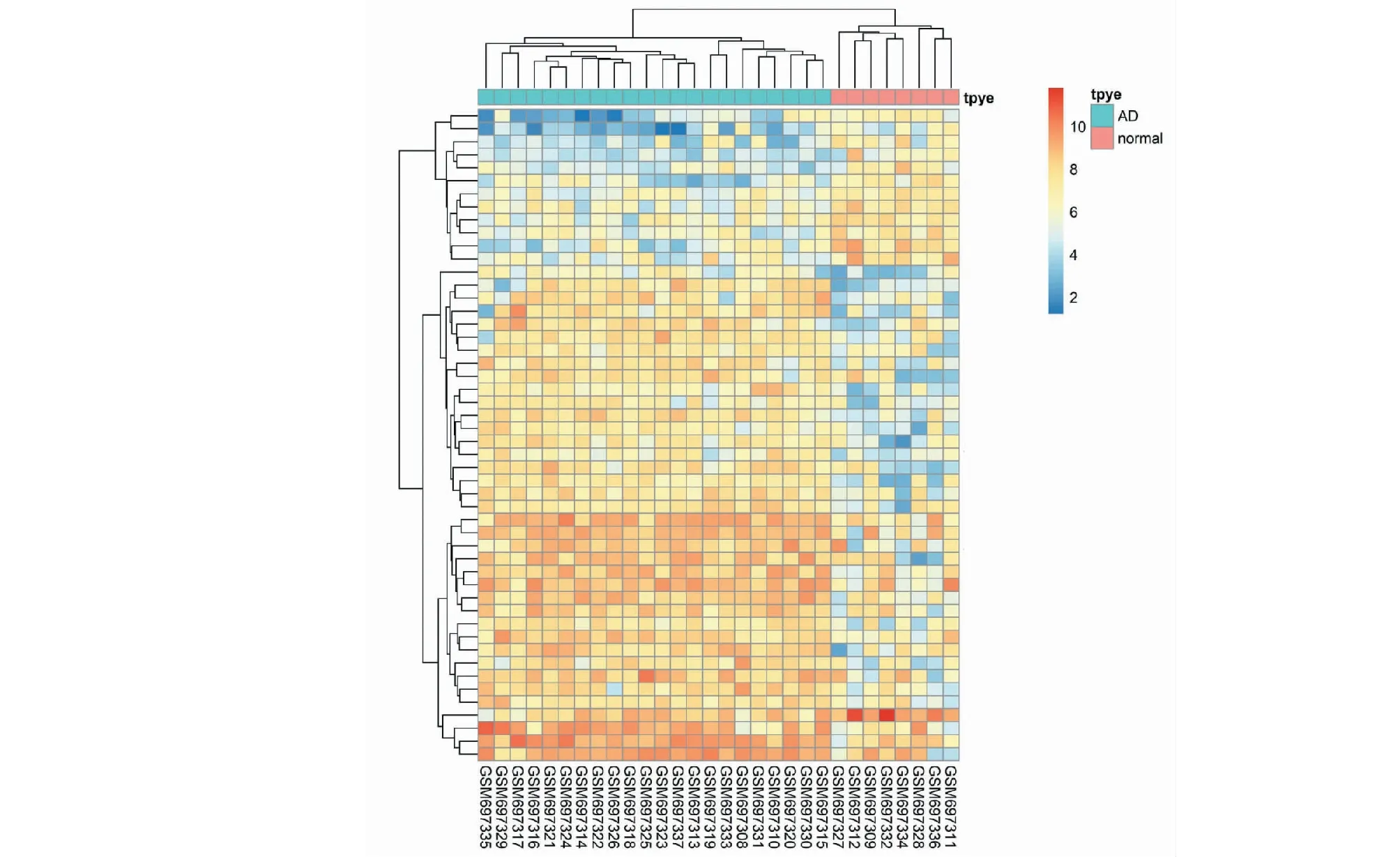
图2 差异表达前50位基因的热图Fig.2 Heat map of top 50 differentially expressed genes
2.3 筛选药物-疾病核心基因
运用Perl软件,将AD的疾病相关基因与黄芪、女贞子的预测作用靶点取交集,获取有效成分21个,疾病-药物关键作用基因41个。运用Cytoscape软件创建包含62个节点及144条边的活性成分-靶点网络图,见图3。其中,活性化合物的节点度排名依次为槲皮素(quercetin,MOL000098)、山奈酚(kaempferol,MOL000422)、木犀草素(luteolin,MOL000006)及芒柄花黄素(formononetin,MOL000392)(见表2)。借助String数据库,输入上述已获得的关键作用基因,绘制包含41个节点及330条边的蛋白互作网络图,见图4。另外节点度排名前列的核心作用基因依次为AKT1、IL6、CASP3、JUN、IL1B、MAPK1、PTGS2、VEGFA、MAPK8、CCL2等(见图5)。
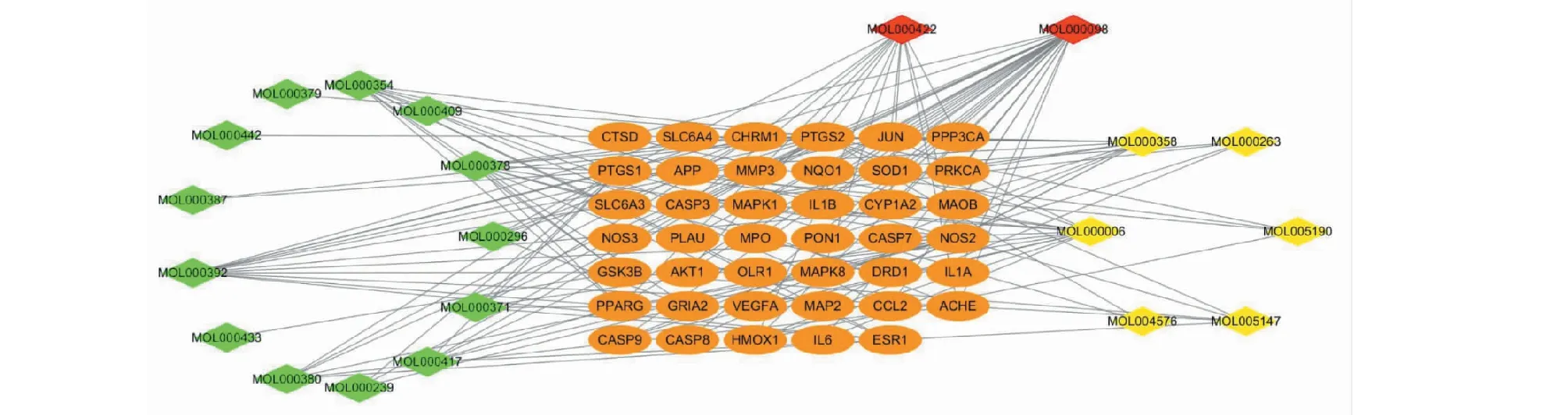
图3 活性成分-靶点网络图Fig.3 Active component-target network注:图中绿色代表黄芪的有效成分;黄色代表女贞子的有效成分;红色为共有的有效成分;橙色代表基因。 Note:Green:Astragalus Radix;Yellow:Ligustri Lucidi Fructus;Red:Multidrug;Orange:Gene.

表2 主要活性成分的节点度排名Table 2 Node ranking of main active ingredients
2.4 关键作用基因的富集分析
将筛选出的41个关键作用基因进行GO功能及KEGG通路富集分析,共获得1 205个GO功能富集与136个KEGG通路富集,富集的分子功能为血红素结合、辅因子结合及四吡咯结合等(见图6);生物过程主要富集在对脂多糖、细菌及氧化应激的反应(见图7);细胞组成主要富集在细胞膜、细胞膜膜筏及细胞膜小窝上(见图8)。KEGG主要富集在阿尔茨海默病通路、糖尿病并发症中的晚期糖基化终末产物及其受体(AGE-RAGE)信号通路、肿瘤坏死因子(TNF)信号通路、白介素-17(IL-17)信号通路及细胞凋亡等(见图9)。最后将排名前20的KEGG富集结果可视化(见图10)。
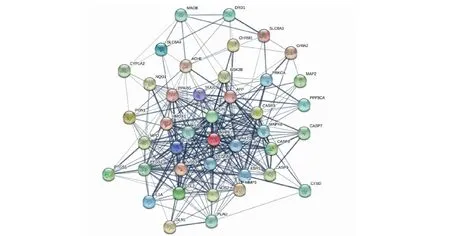
图4 蛋白互作网络图Fig.4 Protein-protein interaction network map
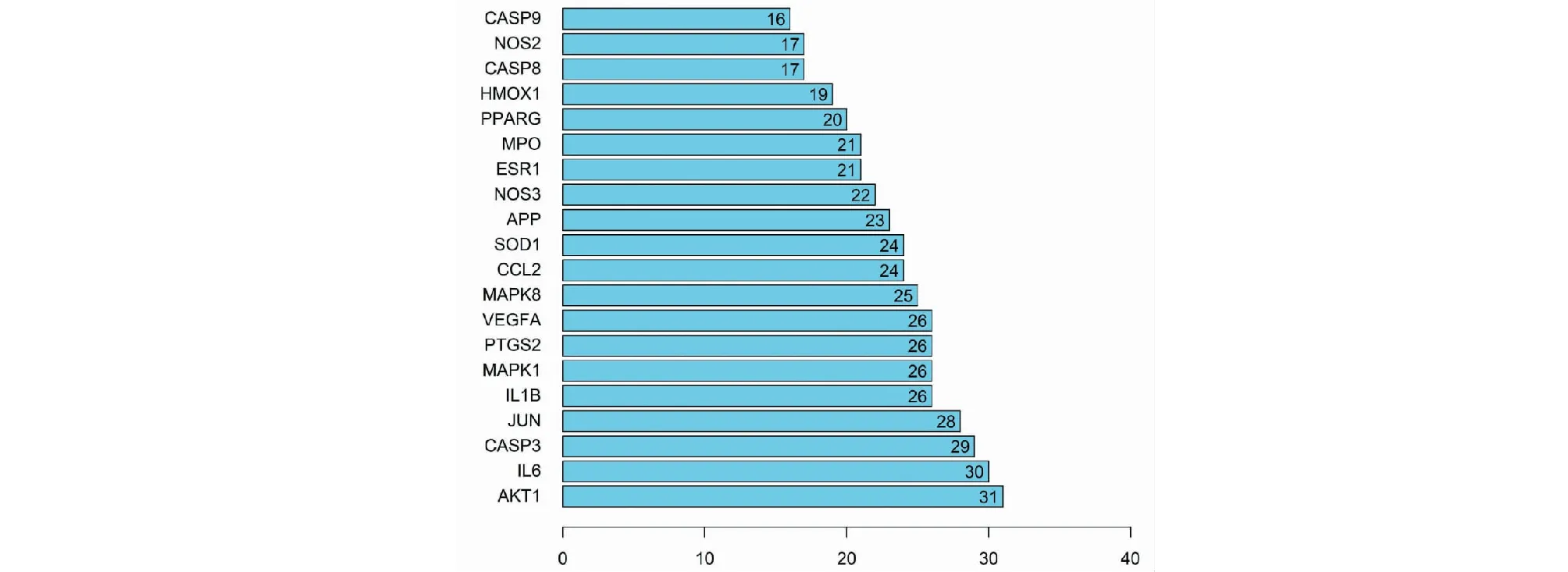
图5 核心作用基因排名Fig.5 Core gene ranking
2.5 分子对接分析
依据活性成分-靶点网络图的节点度值排名并查阅相关文献,课题组将主要活性成分黄芪甲苷、齐墩果酸、山奈酚、槲皮素、木犀草素及芒柄花黄素分别与治疗AD的公认靶点AChE(PDB ID:1B41)、NMDAR(PDB ID:2HQW)进行分子对接。分子对接结果可知,各化合物与目标受体蛋白对接的结合能均小于-5 kJ/mol,说明各分子与目标受体均能较好结合,结果见表2。其中主要活性成分黄芪甲苷和齐墩果酸的分子对接图见图11~14。
3 讨论
网络药理学通过构建“药物-靶点-疾病”多层次网络,来观察药物对疾病的干预和影响,具有整体性和系统性特点;而生物信息学则在基因组学的基础上系统的分析了疾病的基因变化,这与中医辨证论治的整体思想不谋而合。本研究筛选出黄芪-女贞子药对的有效成分21个,主要包括黄芪甲苷、齐墩果酸、山奈酚、槲皮素、木犀草素及芒柄花黄素等,关键靶点有AKT1、IL6、CASP3、JUN、IL1B及MAPK1等。相关基础研究也证实了上述成分及靶点的作用,如黄芪甲苷能够通过减轻氧化应激和神经炎症,改善AD患者的记忆能力[10];齐墩果酸能够改善AD大鼠的突触可塑性,且对AChE有很好的抑制作用[9];山奈酚能够调控MAPK通路的活性,降低AD模型的氧化应激并抑制AchE活性,从而改善其认知功能[11]。槲皮素能够延缓Aβ沉积速度,促进神经干细胞发生,并改善AD大鼠记忆功能[12]。木犀草素能通过减轻大脑神经炎性病变,降低细胞凋亡及抑制Aβ和Tau的聚集[13],从而改善AD大鼠的记忆功能。芒柄花黄素可通过MAPK、TNF及PI3K/Akt等信号通路,抑制AD脑内炎症因子IL-1β和TNF-α的表达,并改善海马区血管内皮细胞结构[14],发挥神经保护作用。分子对接结果亦表明黄芪甲苷、齐墩果酸、山奈酚、槲皮素、木犀草素及芒柄花黄素均能与AD标志性靶点AChE和NMDAR结合,一定程度上验证了本研究的准确性。此外,通过图2,发现黄芪与女贞子在治疗过程中既有自己单独的活性成分与作用靶点,亦有共同的活性成分与作用靶点,并且不同活性成分可以作用于共同的靶标,同一活性成分亦可同时从网络上影响不同的靶点,体现出了两药具有多成分、多靶点,可协同治疗的作用特征。
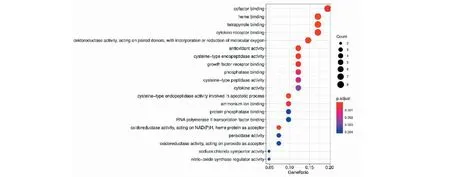
图6 GO富集分析(分子功能)Fig.6 GO enrichment analysis (molecular function)
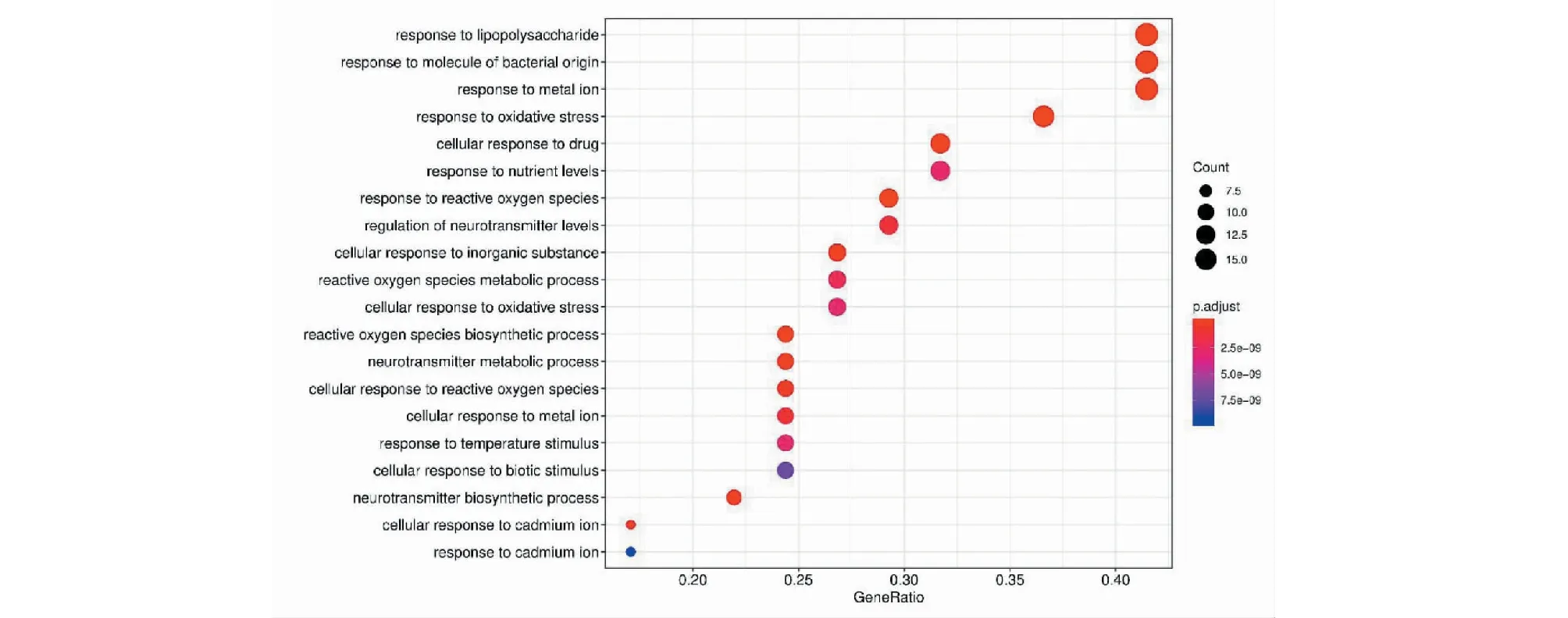
图7 GO富集分析(生物过程)Fig.7 GO enrichment analysis (biological process)
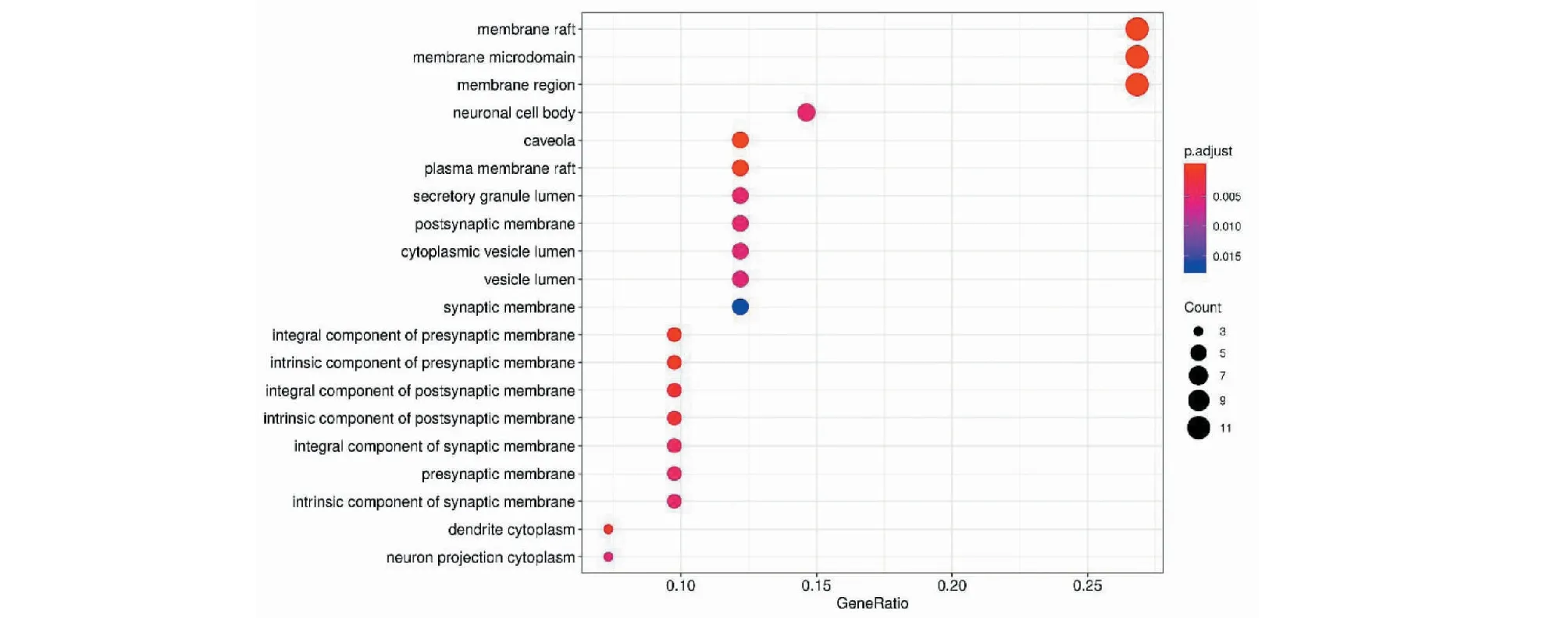
图8 GO富集分析(细胞组成)Fig.8 GO enrichment analysis (cellular component)
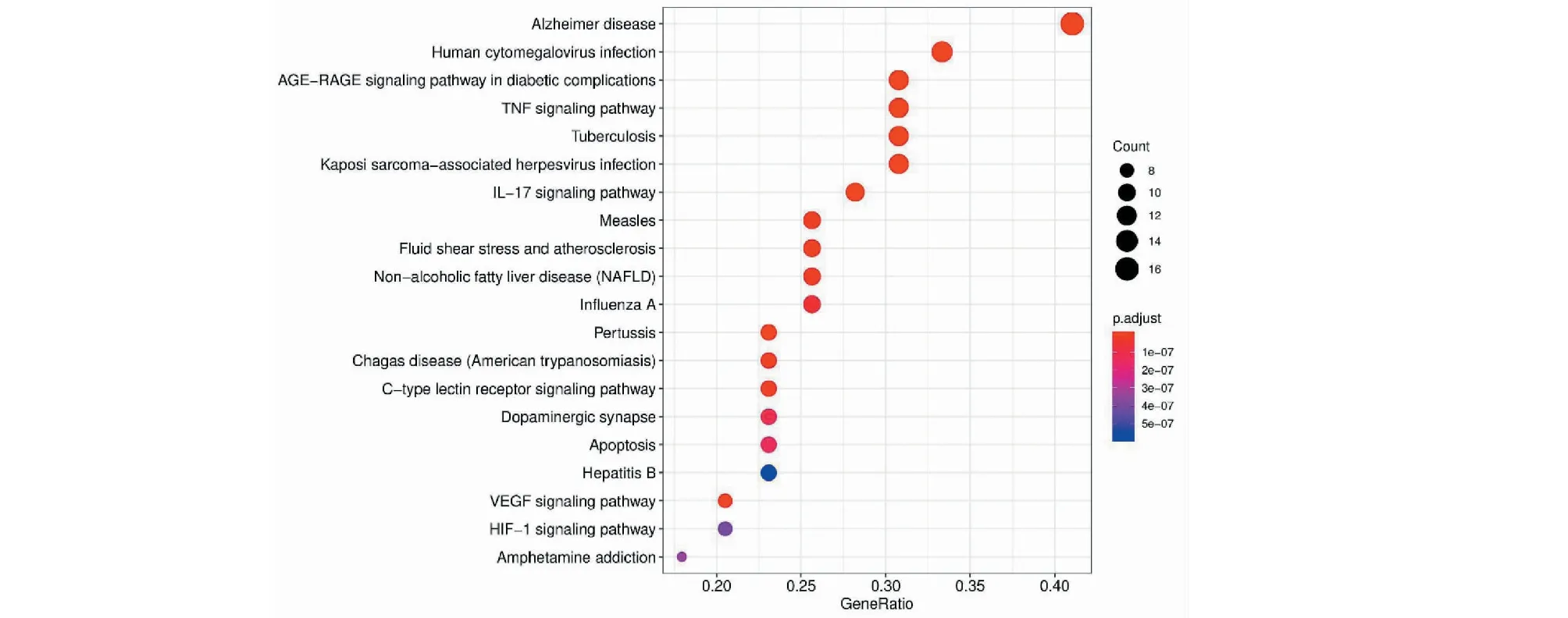
图9 KEGG富集分析Fig.9 KEGG enrichment analysis
图10 KEGG富集分析的可视化图Fig.10 Visualization diagram of KEGG enrichment analysis
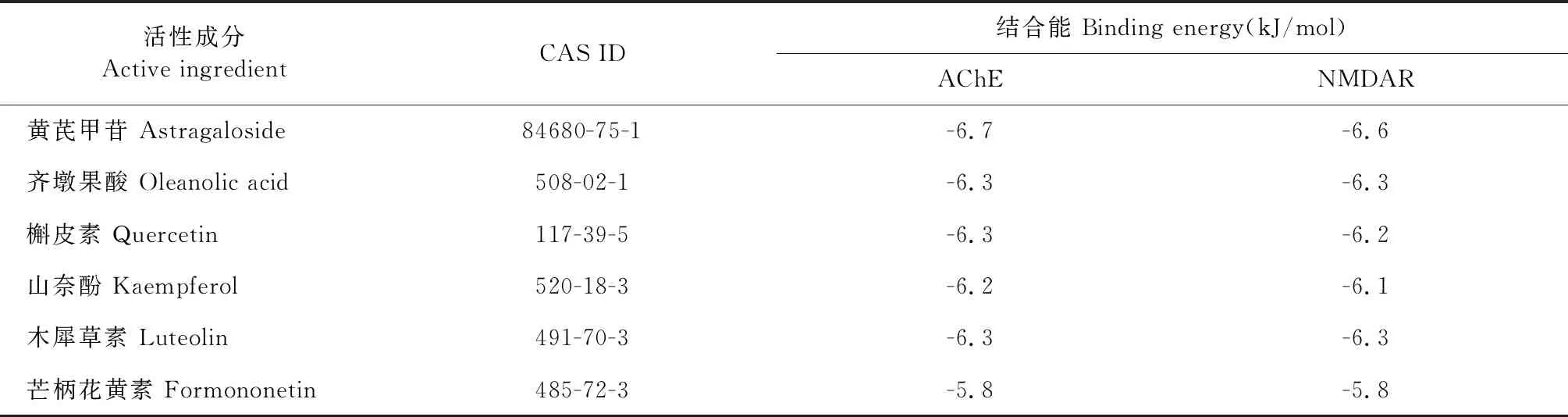
表3 主要有效成分分子对接的结合能Table 3 The binding energy of active molecules and related core targets
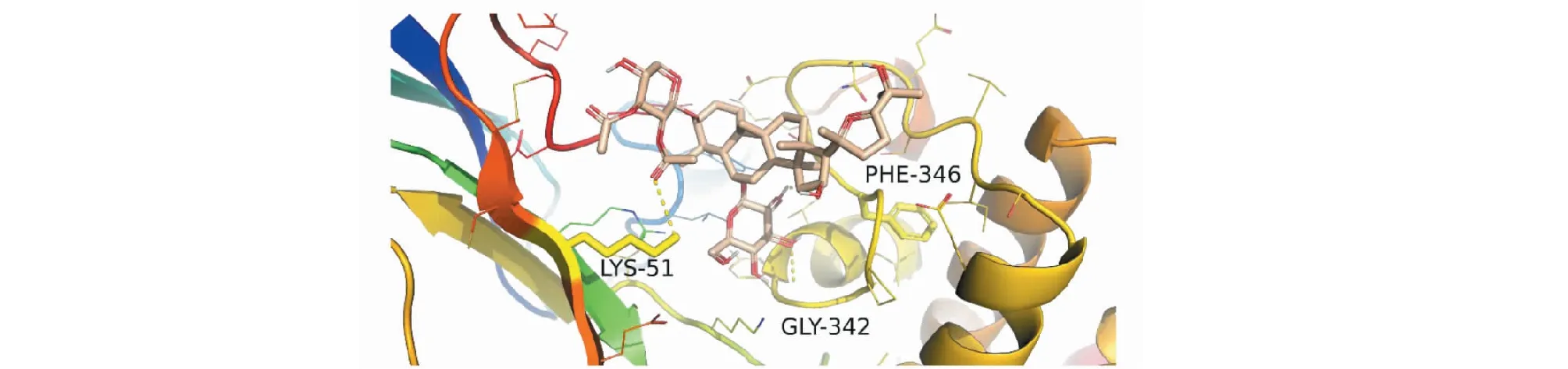
图11 黄芪甲苷-AChE分子对接图Fig.11 Molecular docking pattern map of astragaloside-AChE
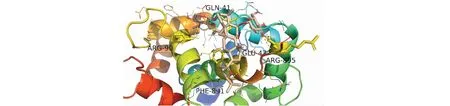
图12 黄芪甲苷-NMDAR分子对接图Fig.12 Molecular docking pattern map of astragaloside-NMDAR
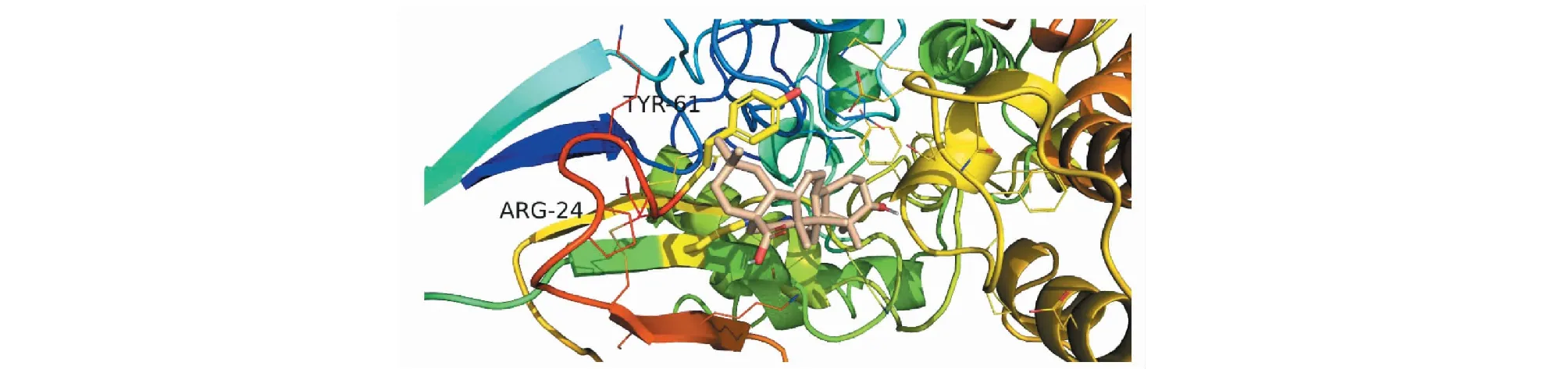
图13 齐墩果酸-AChE分子对接图Fig.13 Molecular docking pattern map of oleanolic acid-AChE
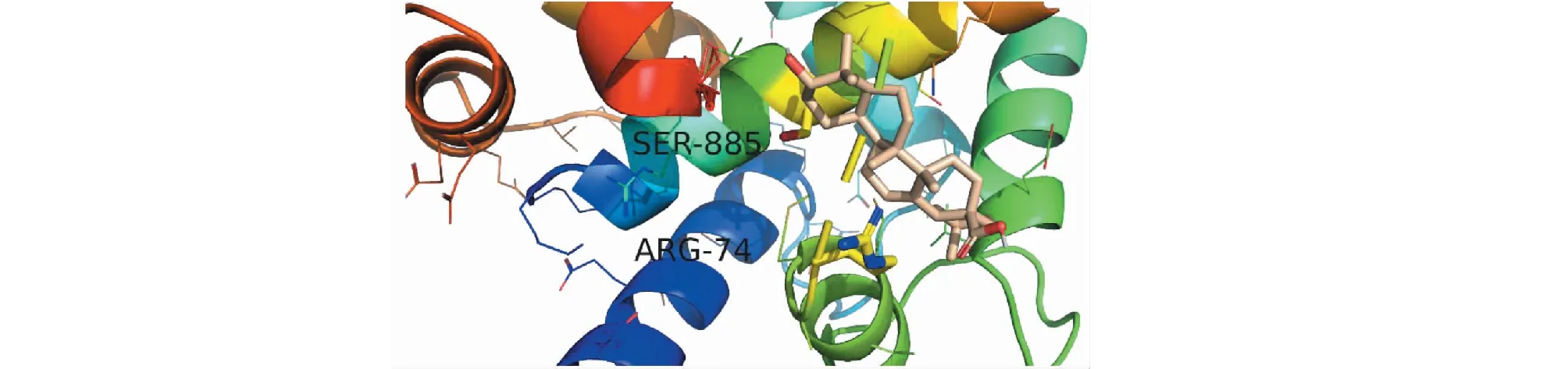
图14 齐墩果酸-NMDAR分子对接图Fig.14 Molecular docking pattern map of oleanolic acid-NMDAR
本研究通过GO功能富集分析和KEGG通路富集分析,发现生物过程主要与血红素结合、辅因子结合、四吡咯结合及对脂多糖的反应等有关,而排名最前的KEGG通路富集结果即为阿尔茨海默病相关信号通路,体现出黄芪-女贞子配伍治疗AD具有较强的靶向性。此外其他主要富集的AGE-RAGE信号通路、TNF信号通路及IL-17信号通路均与炎症反应密切相关。有关研究表明,AD的主要病理特征为大脑出现Aβ蛋白沉积所形成的神经炎性斑即老年斑,而AD患者脑内所存在的免疫和炎症反应,是Aβ蛋白沉积所致的慢性非可控性炎症过程。目前,炎症因子与老年斑之间的相互作用已经被证实:AD患者大脑中存在大量的炎症介质,特别在老年斑块周围可见TNF-α与IL-1β炎症因子大量表达;使用TNF-α、IL-1β抑制剂干预后,可显著改善AD大鼠的运动认知功能,并抑制小胶质细胞活化,减少老年斑聚集[15]。AGE-RAGE信号通路是“损伤反应基因”的十字路口,研究发现AD患者大脑内老年斑中有AGEs聚积,同时与AD病理改变有关的异常结构成分如极低密度脂蛋白、C反应蛋白及载脂蛋白E均存在糖基化现象,此外AGE-RAGE信号通路可通过影响炎症反应、细胞自噬及氧化应激等多种途径促进AD的发生和发展[16];而阻断AGE-RAGE信号通路可以降低NF-κB的活性,抑制炎症反应,并减少氧化应激,改善认知功能障碍[17]。此外,AD患者症状严重程度与脑内TNF-α的表达水平呈正性相关,相反抑制TNF-α的表达可以有效改善AD患者的认知功能[18]。IL-17是炎症反应的早期启动因子,AD患者大脑中IL-17的表达会显著升高[19]。IL-17可通过影响下游NF-κB信号通路,进而激活小胶质细胞及促进细胞凋亡的方式,参与AD的神经炎症反应,而封闭IL-17受体后可以降低炎症反应并抑制细胞凋亡,产生神经保护作用[20]。综上,课题组推测降低炎症反应可能是黄芪女贞子配伍治疗AD的作用机制之一。
此外,本研究亦发现抑制细胞凋亡可能是黄芪女贞子潜在治疗途径。细胞凋亡是神经元丢失的主要形式之一,也是AD的重要病理变化,有研究表明,Aβ蛋白会诱导大脑神经元的凋亡,加重脑损伤。近年来的研究也证实黄芪、女贞子的活性成分可以通过减少细胞凋亡,发挥其在治疗AD上的优势[21]。值得注意的是,本研究主要富集的AGE-RAGE信号通路、TNF信号通路也均是调控细胞凋亡的上游信号位点[22]。而本次蛋白互作网络中排名前列的核心作用基因如AKT1、CASP3、JUN、MAPK1与PTGS2等亦均与细胞凋亡密切相关[23]。这表明黄芪-女贞子药对的治疗靶标具有多网络、多环节、相互交叉的协同作用特点,也体现出中医“整体治疗理念”的科学内涵。
综上所述,本研究利用网络药理学的方法,辅以生物信息学与分子对接技术,初步探讨了黄芪-女贞子药对治疗AD的潜在分子机制。发现其治疗机制涉及到有效成分21个和关键作用基因41个,主要与抑制炎症反应和细胞凋亡等多个病理过程有关,并通过分子对接初步验证了其主要有效成分黄芪甲苷、齐墩果酸、山奈酚、槲皮素、木犀草素及芒柄花黄素等均能与靶点结合,能够为今后的临床运用和药物开发提供依据。但考虑中药煎煮及在体内活性成分可能发生变化的复杂性,故仍有必要通过后续实验进一步验证。
