西妥昔单抗联合SOX方案治疗大肠癌患者的效果及对血清miR-29b和miR-92a-1水平的影响
2020-01-17于登峰张文俊张福杰程卫东
于登峰, 张文俊, 张福杰, 程卫东, 孙 哲
大连大学附属新华医院肛肠科,辽宁 大连 116021
大肠癌为临床高发肿瘤,WHO报告显示[1],全球每年至少有100万大肠癌新发患者。该病起病隐匿,部分患者确诊时已失去手术机会,化疗是其主要治疗手段,且有研究[2]表明,SOX化疗是胃肠癌的主要化疗方案之一。随着医疗技术的进步,分子靶向药物应运而生,并在提高化疗的近期疗效与延长生存时间方面显示出较高价值。西妥昔单抗为典型分子靶向药物,已被证实可使恶性肿瘤患者明显获益,但其与SOX方案联合治疗大肠癌的报道仍较为缺乏。miRNA与肿瘤发生、发展、预后的关系已获得临床认可,其中miR-29b和miR-92a-1被认为与大肠癌的相关性较高,但西妥昔单抗联合SOX方案治疗大肠癌患者对血清miR-29b和miR-92a-1的影响研究仍鲜有报道。本研究以84例大肠癌患者为例,观察西妥昔单抗联合SOX方案治疗大肠癌的近期疗效、远期生存、不良反应及对血清miR-29b和miR-92a-1水平的影响,现报道如下。
1 资料与方法
1.1 一般资料收集大连大学附属新华医院2016年3月至2018年3月共收治的84例大肠癌患者,按随机数表法分为SOX组和联合组,每组42例。SOX组,男25例,女17例;年龄(53.77±6.18)岁(46~78岁);肿瘤部位:直肠癌24例、结肠癌18例;临床分期:Ⅲ期31例、Ⅳ期11例。联合组男22例、女20例;年龄(52.69±6.63)岁(44~76岁);肿瘤部位:直肠癌26例、结肠癌16例;临床分期:Ⅲ期29例、Ⅳ期13例。两组基线资料的差异无统计学意义(P>0.05),具有可比性。
纳入标准:(1)符合《中国结直肠癌诊疗规范(2017年版)》[3]中诊断标准,并经病理确诊;(2)有≥1个的可测量病灶,且直径≥1 cm,临床分期Ⅲ、Ⅳ期;(3)美国东部肿瘤协作组(ECOG)评分≤2分;(4)KPS评分≥70分;(5)预计生存期在半年以上;(6)首诊,无放化疗史;(7)K-RAS野生型;(8)研究经医院伦理委员会同意,患者均签署知情同意书。
排除标准:(1)多部位肿瘤者;(2)伴其他部位恶性肿瘤者;(3)脏器功能异常者;(4)有盆腔放化疗史或直肠手术史者;(5)存在放化疗禁忌证者;(6)入组前1个月内有抗肿瘤治疗史;(7)伴心肌梗死、心率失常者;(8)对化疗药物过敏者;(9)妊娠与哺乳期女性。
1.2 方法SOX组采取SOX方案化疗:替吉奥(山东新时代药业,20 mg×42粒):80 mg/m2,d1~14;奥沙利铂(江苏恒瑞医药,100 ml:0.1 g):静脉滴注135 mg/m2,d1。21 d为1个周期,共8个周期。联合组在SOX方案基础上联合西妥昔单抗(Merck KGaA生产,100 mg:20 ml):静脉滴注,500 mg/m2,滴注时间约1 h,每2周1次。间隔至少1 h再输注其他化疗药物。化疗期间给予相应预防措施,如呕吐者予昂丹司琼止吐;粒细胞减少者予重组人粒细胞刺激因子。
1.3 观察指标
1.3.1 近期疗效:于化疗结束后4周参照《实体瘤化疗疗效评价标准-RECIST》[4]评估患者疗效,疗效评级分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。CR:病灶完全消失且维持至少4周;PR:病灶最大径缩小 50%且维持至少4周;SD:病灶最大径减小不足50%或维持不到4周;PD:病灶最大径增加25%以上或出现新病灶。有效率(%)=(CR+PR)/总病例数×100%;疾病控制率(%)=(CR+PR+SD)/总病例数×100%。
1.3.2 血清miR-29b与miR-92a-1水平:分别于化疗前、化疗结束后抽取两组患者3 ml静脉血,离心(3 000 ×g,10 min)后留取血清。取1 μg提取的RNA,按miRNA cDNA Synthesis试剂盒(Omega公司)的说明书步骤进行反转录,引物序列:上游5′-GGACTAGTTTTGAGGAGGGCTTTTA-3′,下游5′-CCCAAGCTTGGCTATTGTGACCTTTTTATCTGA-3′。反应条件:37 ℃ 30 min、85 ℃ 5 s。所得反转录产物参照SYBR Premix Ex TaqTMⅡ试剂盒说明书用RT-PCR法测定miR-29b、miR-92a-1水平。通过反转录体系进行反应,先将5 μl cDNA加入RNA中,扩增至20 μl,递减扩张40个循环:94 ℃ 30 s、60 ℃30 s、72 ℃ 60 s,72 ℃ 7 min,目标miRNA相对表达水平用2-ΔΔCt表示。
1.3.3 不良反应:记录两组不良反应(骨髓抑制、胃肠道反应等)发生情况,参照文献[5]判定严重程度,分为Ⅰ~Ⅳ级。其中胃肠道反应、神经毒性、皮肤反应、脱发通过观察患者症状确定,骨髓抑制与肝肾功能损伤通过血常规检查确定。
1.3.4 随访结果:两组患者均以化疗开始作为起点,通过电话+门诊复查的形式进行随访,截至2019年4月,随访第1年间隔3个月回院复查1次(共4次),后间隔6个月复查,终点事件为死亡。比较两组无进展生存时间与总生存时间。无进展生存期:开始化疗至肿瘤进展的时间。总生存时间:开始化疗至死亡或末次随访时间。随访期间脱落的病例进行生存分析时予以剔除。

2 结果
2.1 近期疗效两组的整体疗效和有效率的差异无统计学意义(P>0.05)。联合组疾病控制率高于SOX组,差异有统计学意义(P<0.05,见表1)。
2.2 两组血清miR-29b和miR-92a-1水平比较两组化疗前的血清miR-29b和miR-92a-1表达水平比较,差异无统计学意义(P>0.05)。化疗后,两组血清miR-29b和miR-92a-1表达水平均较化疗前降低(P<0.05)。联合组化疗后的血清miR-29b和miR-92a-1表达水平低于SOX组,差异有统计学意义(P<0.05,见表2)。
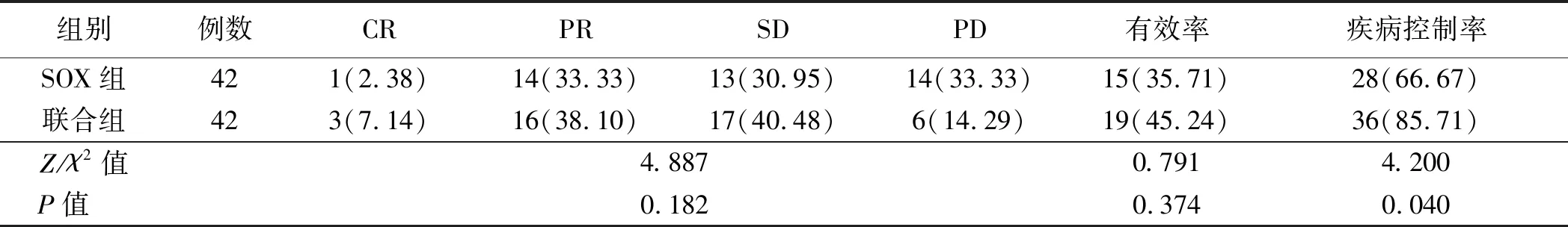
表1 两组近期疗效的比较
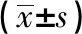
表2 两组化疗前后血清miR-29b与miR-92a-1水平的比较
2.3 不良反应两组化疗期间未见心脏不良反应,骨髓抑制、胃肠道反应、周围神经炎、皮肤反应、脱发、肝肾功能损伤均为Ⅰ~Ⅲ级,各项不良反应发生率比较,差异无统计学意义(P>0.05,见表3)。
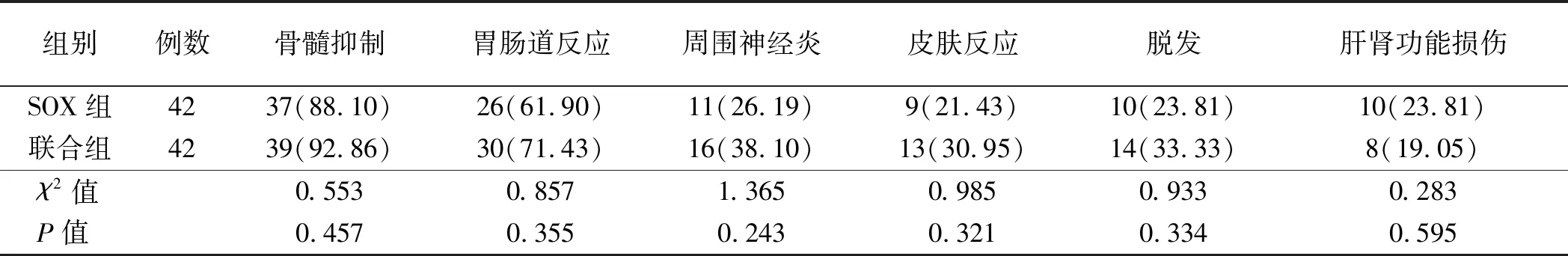
表3 两组不良反应的比较
2.4 远期随访截至2019年4月,SOX组失访2例、联合组失访1例。SOX组随访时间(22.14±5.02)个月(13~34个月)。联合组随访时间(23.26±5.40)个月(14~36个月)。两组随访时间比较,差异无统计学意义(t=0.966,P=0.337)。SOX组无进展生存期(10.21±1.58)个月(8~13个月),联合组无进展生存期(11.20±1.66)个月(8~14个月),差异有统计学意义(t=2.748,P=0.007)。SOX组总生存期(20.28±6.03)个月(11~34个月),联合组总生存期(24.11±5.66)个月(13~36个月),两组Kaplan-Meier生存函数比较,差异有统计学意义(P=0.039<0.05,见图1)。
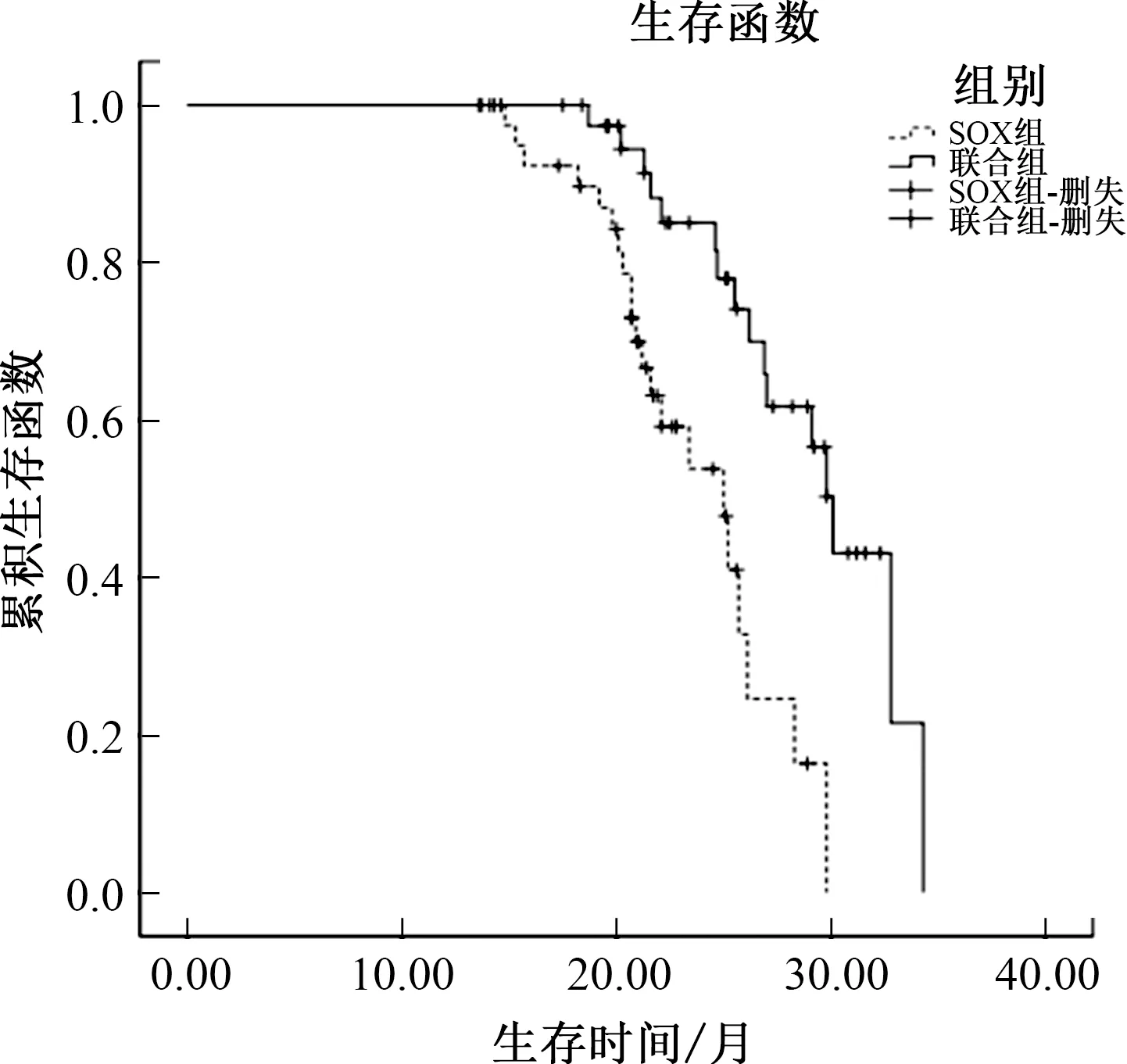
图1 两组患者的Kaplan-Meier生存函数图
3 讨论
大肠癌发病与遗传、环境、肠道炎症、大肠腺瘤等多种因素有关,早期多无明显症状,后期会出现腹痛、便血等,30%的患者确诊时已进入进展期[6]。5-氟尿嘧啶是大肠癌化疗治疗的首选药物,但半衰期短,不良作用明显。替吉奥是第4代氟尿嘧啶衍生物,生物利用度高,口服进入体内后5-氟尿嘧啶可长时间维持高浓度,化疗指数远高于 5-氟尿嘧啶,但毒性更低,这是本研究中大肠癌患者采取SOX方案进行化疗的主要理论基础[7]。
近年研究发现[8],血管内皮生长因子可通过对血管内皮细胞的作用参与肿瘤播散、转移及新生。也有专家认为[9],大肠癌肿瘤细胞株中表皮生长因子的高表达会诱导肿瘤生长、转移,促使肿瘤恶化进展。因此,如何通过有效手段抑制血管内皮生长因子与表皮生长因子从而抑制肿瘤生长成为当前研究热点。本研究中联合组在SOX化疗基础上应用西妥昔单抗,结果显示两组有效率虽然差异无统计学意义,但联合组疾病控制率高达85.71%,高于对照组的66.67%,提示西妥昔单抗的应用在肿瘤控制方面显示出良好作用,这一结果考虑与西妥昔单抗可阻断血管内皮生长因子与表皮生长因子的结合,从而对血管生成与肿瘤生长发挥强大的抑制作用有关。此外,西妥昔单抗属于抗表皮生长因子受体单抗,可抑制表皮生长因子信号传导,且具有一定的细胞毒效应,与SOX化疗联合可在一定程度上提高肿瘤细胞对化疗的灵敏性,从而强化SOX化疗对肿瘤细胞的杀伤力,使疾病控制率提高[10-11]。专家发现,表皮生长因子通路参与肿瘤内分子生物学的动态变化与放疗抵抗[12-13]。故西妥昔单抗的应用可阻断表皮细胞生长因子受体通路,抑制新生血管生成与癌细胞侵袭,同时也可有效提高大肠癌细胞对化疗的灵敏性,最终改善患者预后,与本研究结论一致。
miRNA属于非编码RNA,可调控DNA转录,其在肿瘤发展、侵袭、转移中的重要作用也逐渐引起重视[14]。有研究[15]发现,大肠癌患者血清miR-29b和miR-92a-1与健康人群相比均存在异常高表达,且与疾病预后有关。本研究中,两组患者化疗后的血清miR-29b与miR-92a-1表达水平均大幅下降,且联合组下降幅度更明显,提示西妥昔单抗在下调血清miR-29b与miR-92a-1表达方面也起到积极作用,考虑与西妥昔单抗联合SOX化疗后更强的抗肿瘤作用有关,而西妥昔单抗对血清miR-29b和miR-92a-1表达的直接影响机制则尚不明确,有待后续探讨。
在不良反应方面,两组的骨髓抑制和胃肠道反应发生率非常高,均在60%以上,肝肾功能损伤和皮肤反应相对较低,且两组各项不良反应发生率的差异均无统计学意义,提示西妥昔单抗是一种较为安全的药物,与化疗药物联用不会大幅增加不良反应,患者耐受性较高。随访至2019年4月,联合组的无进展生存期与总生存期均明显长于SOX组,提示西妥昔单抗的应用有利于延长大肠癌患者的生存时间。余峰彬等[16]研究表明,西妥昔单抗联合化疗治疗结直肠癌可有效延长患者生存时间,与本研究结果相符。另外,本研究随访时间尚短,缺乏5年生存率数据,有待进一步延长随访时间并后续报道。
综上所述,西妥昔单抗联合SOX方案治疗大肠癌可提高疾病控制率,延长生存时间,并下调患者血清miR-29b和miR-92a-1表达,且不会增加不良反应,患者可耐受,值得推广。
