肠道子宫内膜异位症2例报道并文献复习
2020-01-17石保平胡宜涛向培正
杨 娟, 朱 玲, 傅 燕, 石保平, 胡宜涛, 向培正, 彭 玲, 袁 佳
昆明医科大学第二附属医院消化内科,云南 昆明 650101
病例1患者,女,45岁,因反复周期性便血就诊于我科,便血与月经伴随,月经结束便血停止,无痛经史,已婚已育,子女体健。否认盆腹腔手术史,家族中数位近亲属有消化道肿瘤病史。结肠镜提示距肛门10~15 cm见1/2环状黏膜肥厚面,表面粗糙,FICE染色见血管紊乱,质硬,易出血,取材送检(见图1)。盆腔平扫+弥散+增强提示距肛门13 cm处直肠前壁增厚软组织影,考虑子宫内膜异位症可能性大,间质瘤待排;子宫内膜增厚;子宫腺肌症(见图2~4)。病理提示,免疫组化CK7(+),ER(+),PR(+),CD10(+)(见图5~6),考虑(直肠)子宫内膜异位症。
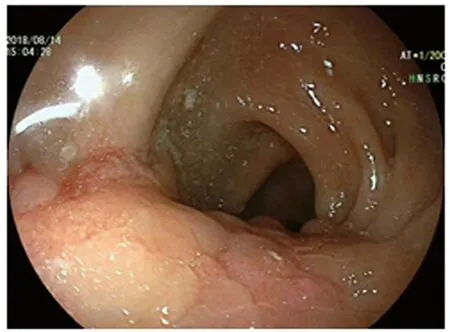
图1 肠镜:距肛门10~15 cm见1/2环状黏膜肥厚面,表面粗糙,质硬

图2~4 盆腔核磁共振:直肠前壁增厚软组织影,T1等信号;T2低信号;增强后强化不明显
病例2患者,女,43岁,因反复周期性腹痛就诊,腹痛与月经周期一致,长期误认为痛经未诊治。已婚已育,曾行卵巢囊肿手术,家族中无类似疾病及消化道肿瘤病史。结肠镜提示,距肛门15~18 cm见一连续环状扁平隆起,占据肠腔1/2~3/4环,表面光滑,中央凹凸不平,见不规则片状增生,质软、易出血,NBI染色病变表面血管紊乱(见图7)。超声内镜提示肠壁结构层次清晰完整,病变隆起处黏膜明显增厚,界清,后方无回声区,取材送检,考虑固有肌层或肠壁外囊肿可能(见图8)。子宫附件超声(经腹)提示子宫肌瘤声像,子宫颈纳氏囊肿声像。结肠镜病理组织活检提示(直肠黏膜)固有层见腺体结构和间质成分,免疫组化:CD10(+),CK7(+),ER(+),PR(+),CEA(+),支持子宫内膜异位(见图9~10)。超声内镜病理组织活检:增生性息肉(见图11)。
2例患者明确诊断肠道子宫内膜异位症,后均至妇科就诊,查女性激素水平正常,考虑到2例患者均无生育要求且临绝经,未给予特殊治疗;我科予促进黏膜修复等治疗并建议至外科就诊,患者未遵医嘱,目前我科随访中。
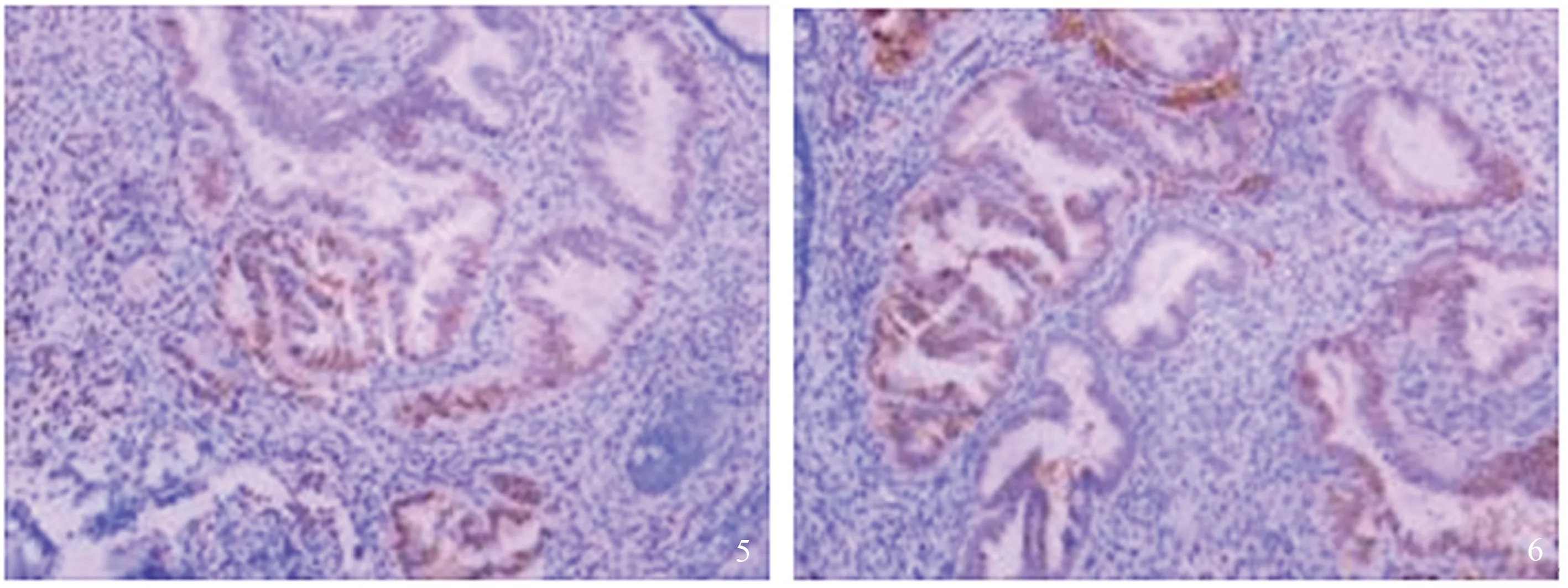
图5~6 病理免疫组化(HE染色,放大40倍):PR(+)(图5),ER(+)(图6)
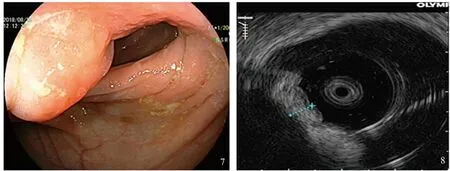
图7 肠镜:距肛门15~18 cm见1/2~3/4环状扁平隆起,表面光滑,周围不规则增生,质软;图8 超声内镜:探及一低回声结节,边界清,后方无回声

图9~10 病理:固有层见腺体结构和间质成分;免疫组化:CD10(+)(见图9),ER(+)(见图10)(HE染色,放大40倍);图11 病理(超声内镜下取材):结肠腺体样增生(HE染色,放大40倍)
讨论肠道子宫内膜异位症是指具有生长功能的子宫内膜异位至肠道组织产生的一种非癌性病理变化,为一种深部浸润型子宫内膜异位症,浸润深度常超过5 mm,发病率占子宫内膜异位症患者的3%~37%,直肠、乙状结肠是好发部位[1]。因子宫内膜剥脱存在周期性,因此该病相关的症状常有周期性的规律,但在炎症性病变和肠易激综合征病变上亦可出现相同的周期性的临床表现,且有研究称,肠道子宫内膜异位症与炎症性病变在病理上也难以区分[2]。该病往往临床表现不明显,很大一部分患者常因后期肠壁增厚、变形并出现梗阻症状而就诊,这是误诊为肠道肿瘤的原因。关于肠道子宫内膜异位症的发病机制及病因尚未阐明,CZYZYK等[3]将目前较为流行的理论进行综述,其中较为经典的是异位内膜种植学说,种植途径与经血逆流有关,但不能解释绝经妇女及男性的此现象。此外还包括体腔上皮化生、干细胞理论、免疫失衡、分子机制、氧化应激、表观遗传、基因突变、环境等。目前较常规的检查手段包括超声、MRI、肠镜等,其中MRI影像表现为受累肠壁明显增厚,磁共振T1WI呈等信号,T2WI常呈低信号,若增强后轻度强化,表明累及肌层,通过观察子宫直肠凹处间隙是否清晰,可推断病变是否累及邻近组织及直结肠浆膜面[4]。超声检查分为经阴道超声(TVS)和经直肠超声(TRS),表现为位于肌层内或累及肌层的形态不规则低回声结节。三者对该病的诊断灵敏性和特异性分别为85.4%vs75.7%vs67.8%,93.9%vs92.8%vs89.8%[5]。EXACOUSTOS等[6]报道对位于结肠上部的病变MRI比TVS诊断更精确,但超声对结直肠定位的诊断较盆腔核磁更敏感[7],且增强超声并不提高诊断率[8]。结肠镜检查因其直观且能取材活检存在其特殊的优势,镜下常表现为病变隆起或隆起凹陷,可伴表面糜烂,或存在肠腔局部狭窄,其特异性高达98%,但灵敏性只有7%[9],又因ROSSINI等[10]指出镜下表现与病灶浸润深度无明显相关性,这使得镜下的检出率大大降低,不建议结肠镜作为诊断及随访手段。本组2例患者多次肠镜表现及活检结果不一致,说明此病的检出不仅极大程度依赖检查者水平,还猜想是否本病的镜下表现也随月经周期而变化,但目前基于结肠镜检查时机的研究无人开展,结合本病病变部位较深,活检可能阴性,我们猜想月经周期中增生期或分泌期行肠镜检查或许能提高活检率,有待进一步研究证实。此外,一些标志物如CA125、CA19-9等也被研究用于早期诊断及筛查[11],但最终诊断应依据病理及免疫组化。IE的治疗方式目前尚不统一,但应认识到深部病变是良性的,通常不是渐进性的[12],选择治疗应集中于改善症状和生育期望,而不是根除该疾病。对于病变导致肠腔狭窄的患者,治疗首选外科手术,方式主要为肠切除术[13],SERACCHIOLI等[14]建议手术中应用静脉吲哚青绿评估肠灌注情况并选择横断线。术后10%~14%的患者可出现再狭窄[15]。现有数据表明,手术治疗与药物治疗对疼痛的改善效果相当[16],常见的药物均属于避孕疗法,存在体质量变化、头痛、高血压、静脉血栓形成或抑郁症等一系列并发症[17],主要用于临绝经期、无生育要求的患者[18]。有生育要求的患者应考虑辅助生育技术,在重复试管受精失败时,应考虑手术治疗,有研究称,手术是增加受孕机会的唯一途径[19]。新型研究发现,在IE患者中低密度脂蛋白受体的mRNA水平过表达,将有望成为靶向治疗的靶点[20]。本病复发的主要原因认为是残留病灶,并认为复发风险在手术后长达2年,其他因素还包括用药疗程、年龄、助孕、盆腔其他病史等[21]。
