TACE联合RFA治疗前血清ApoA1水平对肝细胞癌预后的影响
2020-01-17魏建莹刘晓民陈京龙
魏建莹, 孙 巍, 刘晓民, 陈京龙
首都医科大学附属北京地坛医院肿瘤内科,北京 100015
肝细胞癌(hepatocellular carcinoma,HCC)的发病率在逐年上升,全球范围内,每年约有782 000例新发病例,且每年约有746 000病例死亡[1]。在过去10年中,虽然各种检查及治疗手段不断出现,但HCC仍是第三大常见肿瘤致死原因[2]。目前HCC的主要治疗方法包括外科手术、肝动脉灌注化疗栓塞(transcatheter arterial chemoembolization,TACE)、射频消融(radio-frequency ablation,RFA)、微波消融等多种治疗手段。经局部治疗后,HCC的复发率及死亡率仍然很高。甲胎蛋白(alpha-fetoprotein,AFP)是最常见的预测HCC发生及复发的指标,但仍有约1/3 HCC患者AFP阴性。尽管现在有研究证实,热休克蛋白70[3]、人半乳糖凝集素-3[4]、细胞因子信号传导抑制因素3(suppressor of cytokine signaling,SOCS3)[5]、miR-802[6]可作为HCC的预后指标。但由于其复杂的检查设备及昂贵的花费,因而迫切需要简便、快捷的指标,预测HCC的发生、复发及预后。
血脂代谢异常在肿瘤的发生、发展及预后中发挥重要作用,目前多项研究证实,血脂代谢异常与非小细胞肺癌(NSCLC)[7]、鼻咽癌[8]、食管癌[9]、结直肠癌[10]、乳腺癌[11]的发生、发展及预后相关。JIANG等[12]研究证实,在HCC中,低水平的胆固醇(CHO)及高密度脂蛋白(HDL)预示较差预后。载脂蛋白是血浆脂蛋白中的蛋白质成分,能够结合和运输血脂到机体各组织进行代谢及利用的蛋白质,载脂蛋白A(apolipoprotein A,ApoA)是构成HDL的重要组分。MA等[13]研究指出,在根治性手术切除后,ApoA1可以降低HCC患者的复发,可预测HCC患者的无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)。在ZHANG等[14]Meta分析中指出,低水平ApoA1可能为NSCLC、胃癌、胆囊癌、HCC等多种恶性肿瘤的不利预后指标,ApoA1可成为预测肿瘤预后的非侵袭性指标。但关于HCC经TACE联合RFA治疗前血清血脂水平与预后关系的研究极少,本文为进一步探讨治疗前血脂成分对HCC预后影响。
1 资料与方法
1.1 一般资料回顾性分析2010年8月至2016年7月在首都医科大学附属北京地坛医院就诊的164例HCC患者的资料,患者均经病理诊断,或伴有肝硬化并符合HCC典型影像学诊断,并进一步经肝动脉造影证实。患者满足以下纳入标准:(1)所有患者诊断明确;(2)既往无其他肿瘤病史;(3)所有患者均行TACE联合RFA;(4)所有血清学资料采集前均未进行任何治疗。搜集内容包括:年龄、性别、是否合并乙肝、是否合并肝硬化、是否合并糖尿病、是否合并高血压、巴塞罗那分期(BCLC分期)、Child分级、治疗前AFP、CHO、甘油三酯(TG)、HDL、低密度脂蛋白(LDL)、ApoA1、ApoB。主要观察指标为总生存期OS、PFS。BCLC分期依据2018年欧洲肝病协会制定的最新版本指南[15],主要包含四类预后因素,包括患者的一般状况;肿瘤的状态;肝功能状态;可供选择的治疗方法。Child分级是对肝功能储备功能进行量化评估的分级标准,一般包括以下指标:是否有肝性脑病、是否有腹水、血清胆红素水平、凝血酶原的时间。
1.2 统计学分析采用SPSS 19.0软件进行统计分析,采用Kaplan-Meier法计算生存曲线,采用Log-Rank检验法比较两者差异。采用COX比例风险回归模型确定影响生存的危险因素,ApoA1与各临床指标关系检验采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况在本研究中,共纳入164例患者,中位年龄56岁(31~86岁),>50岁者120例(73.2%);男性患者(78.0%)明显多于女性;大多数合并有乙肝(87.8%)及肝硬化(63.4%);但合并有高血压(19.5%)、糖尿病(21.3%)的患者相对较少;纳入患者中以A期(43.2%)、B期(31.7%)为主;大部分患者肝功能较好(Child A级 82.3%);59.8%的患者AFP升高>20 ng/ml;在各血脂成分中,除HDL外,其余各成分中大部分患者高于设定的界限值(见表1)。
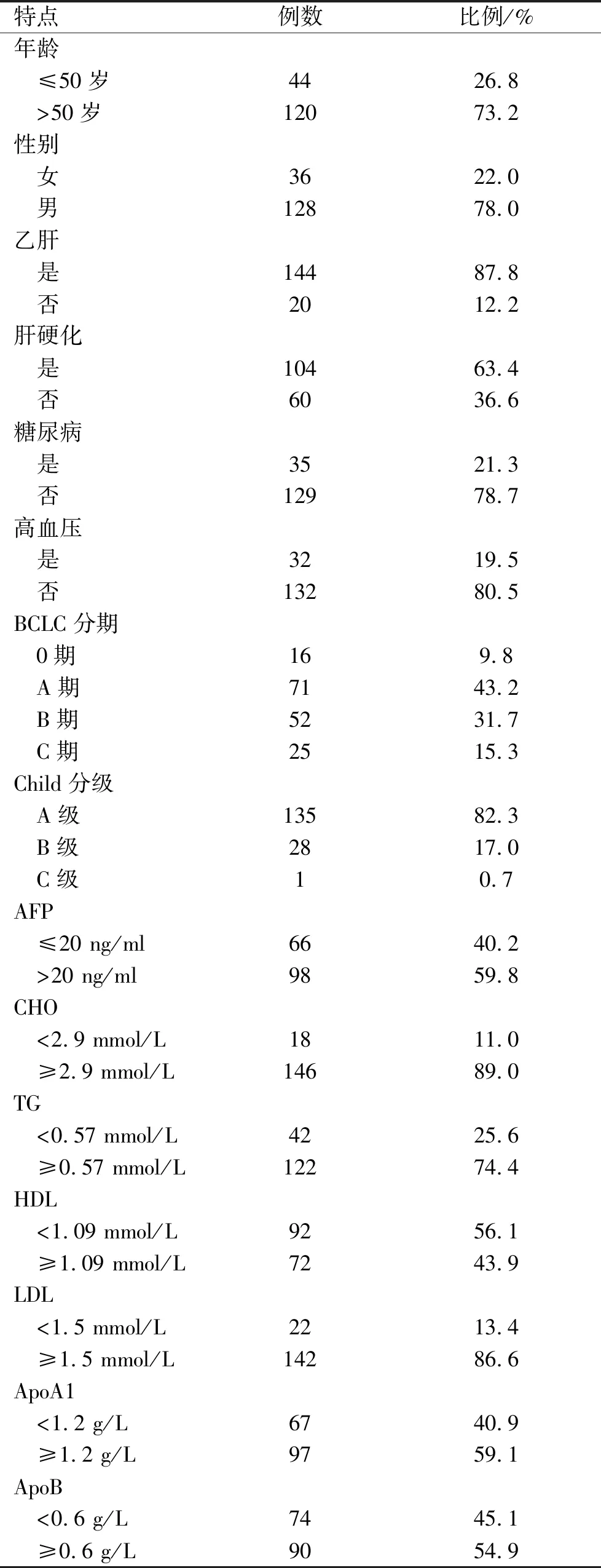
表1 病例一般特点
2.2HCC患者临床特征对预后的影响
2.2.1 HCC患者临床特征对PFS的影响:单因素分析结果显示,BCLC分期、Child分级、AFP、HDL、ApoA1与PFS有相关性(P<0.05)(见表2);将上述有统计学意义的因子进行多因素分析,结果显示,BCLC分期、Child分级、ApoA1与PFS有相关性(P<0.05)(见表2)。生存分析可见两者之间有显著性差异,高水平ApoA1可提高患者PFS(见图1)。
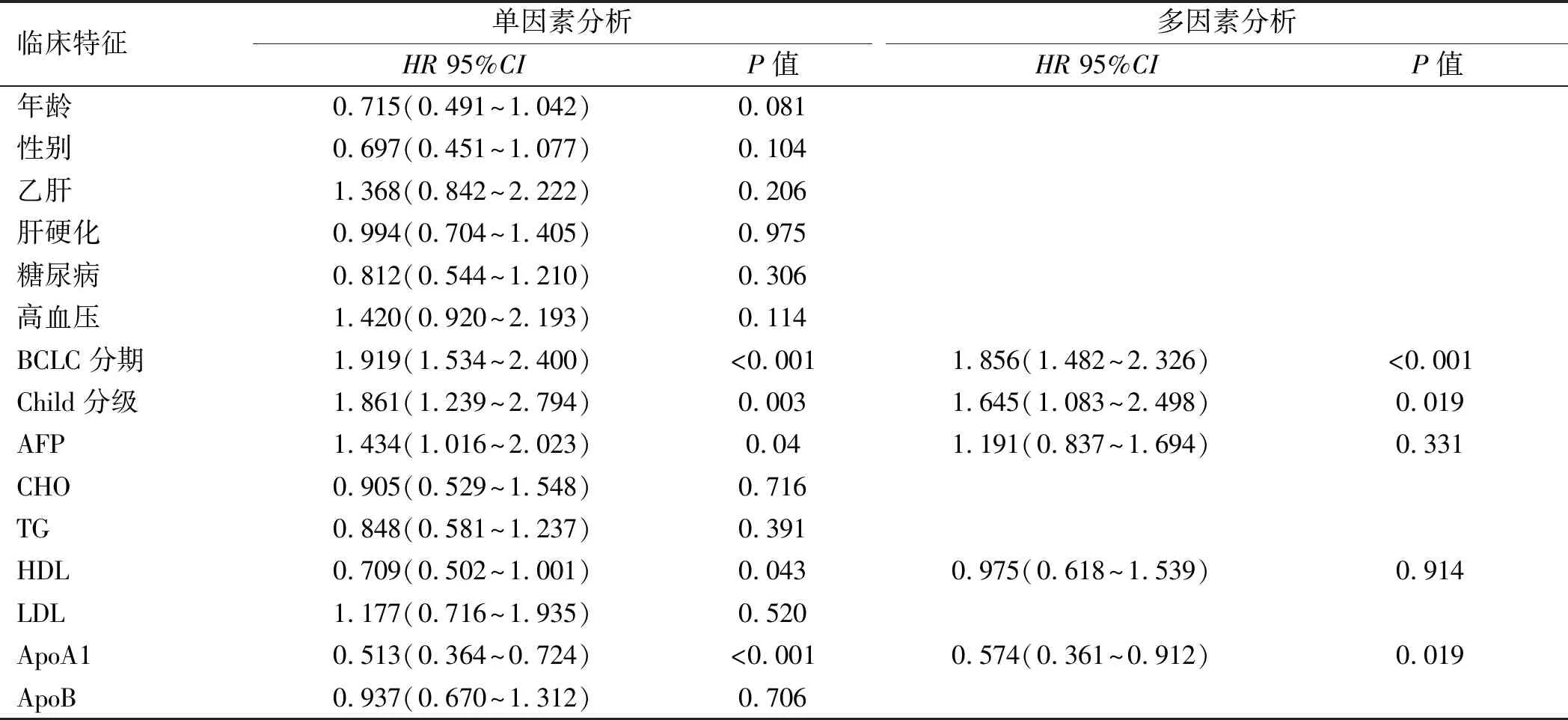
表2 影响HCC患者PFS的单因素及多因素COX比例风险回归模型分析
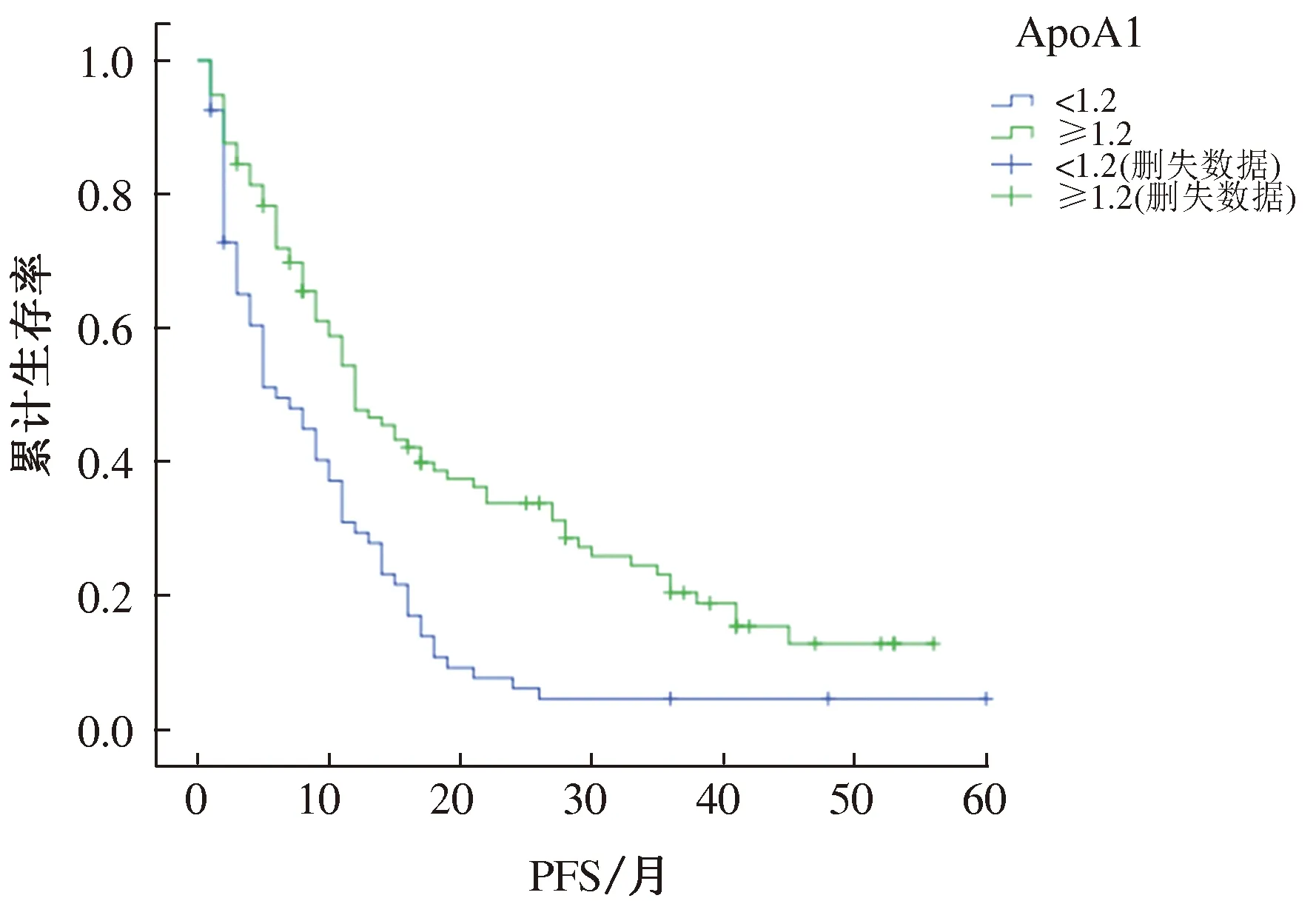
图1ApoA1高剂量组与低剂量组HCC患者生存分析
Fig1AnalysisofthesurvivaloftheApoA1high-dosegroupandthelow-dosegroupofHCC
2.2.2 HCC患者临床特征对OS的影响:单因素分析结果显示,BCLC分期、Child分级、AFP、ApoA1与OS有相关性(P<0.05),但对上述有统计学意义的因素进行多因素分析后,可见BCLC分期与OS有相关性(P<0.05),而ApoA1、Child分级、AFP与OS无相关性(P>0.05,见表3)。
2.3HCC患者治疗前ApoA1与各临床特征的相关性分析ApoA1与年龄、性别、是否合并乙肝、是否合并肝硬化、是否合并糖尿病、是否合并高血压、BCLC分期、Child分级、AFP水平均无明显相关性(P均>0.05,见表4)。
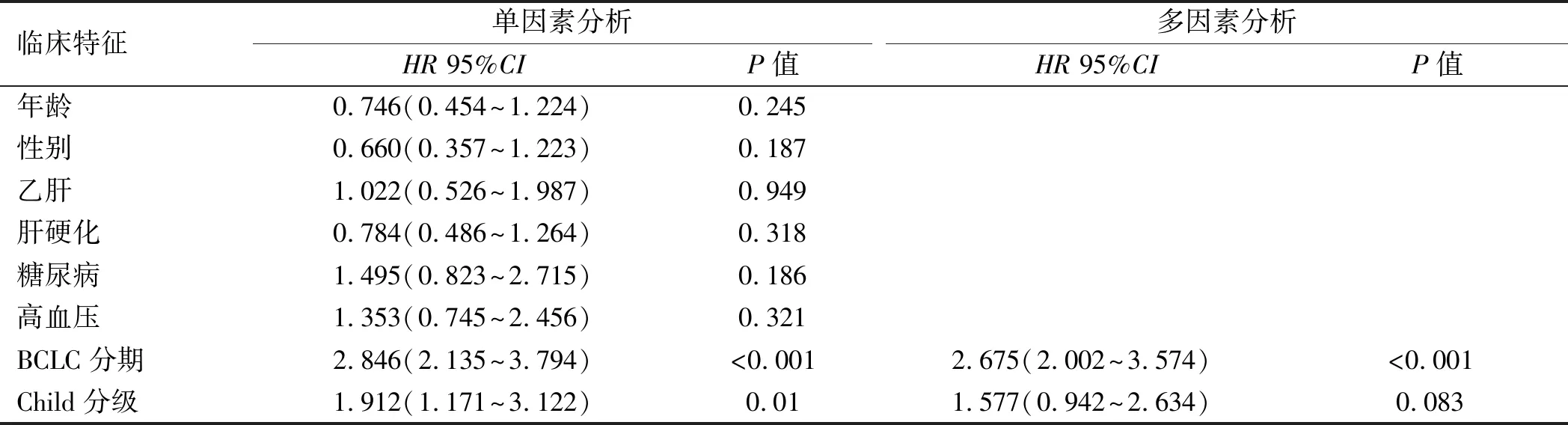
表3 影响HCC患者OS的单因素及多因素COX比例风险回归模型分析
续表3
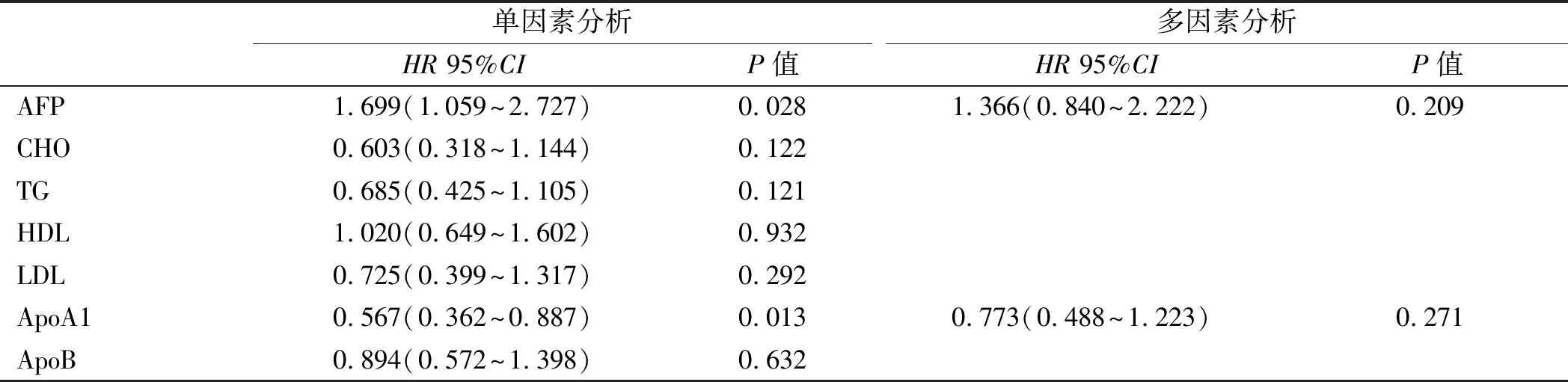
单因素分析HR 95%CIP值多因素分析HR 95%CIP值AFP1.699(1.059~2.727)0.0281.366(0.840~2.222)0.209CHO0.603(0.318~1.144)0.122TG0.685(0.425~1.105)0.121HDL1.020(0.649~1.602)0.932LDL0.725(0.399~1.317)0.292ApoA10.567(0.362~0.887)0.0130.773(0.488~1.223)0.271ApoB0.894(0.572~1.398)0.632
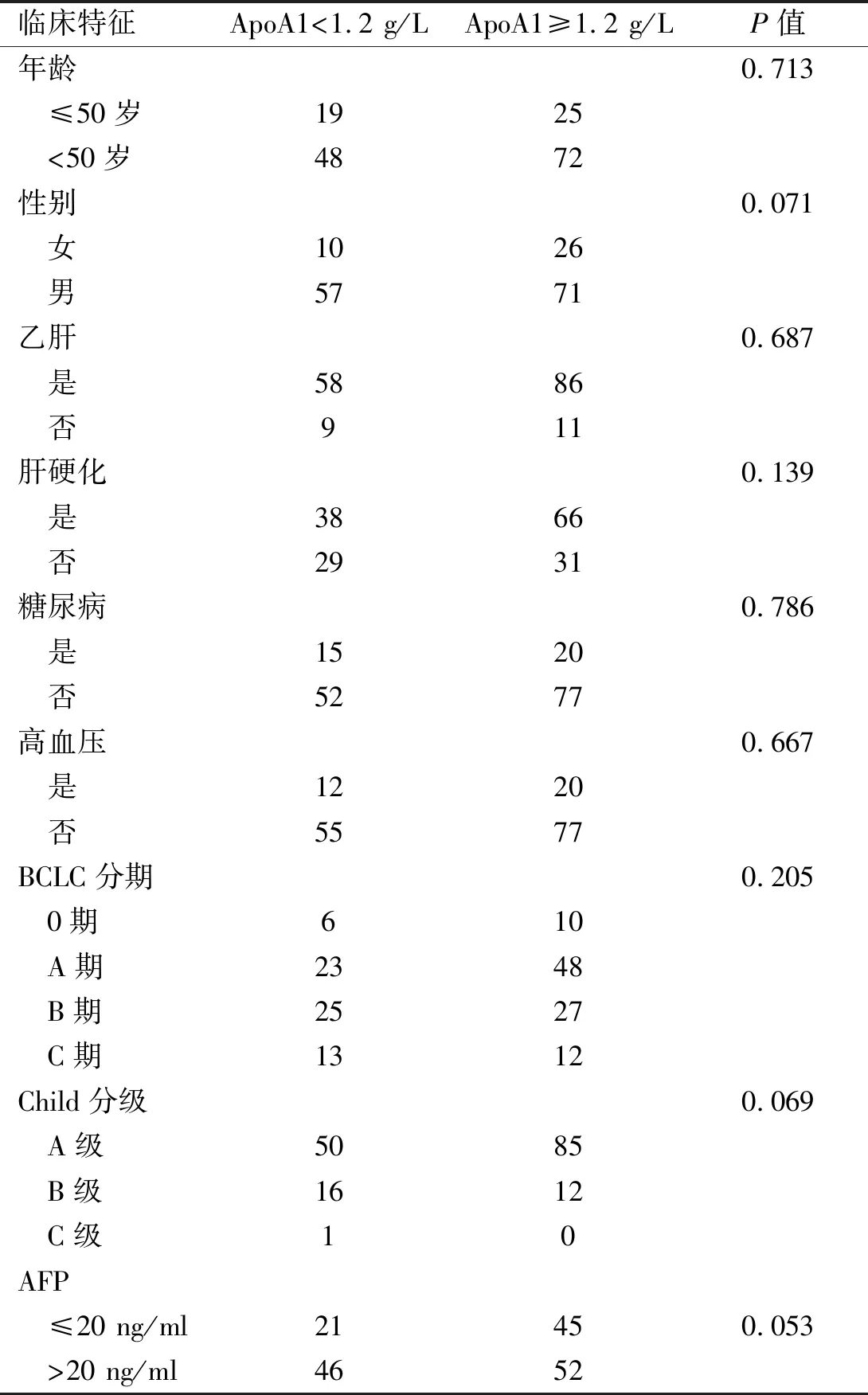
表4 HCC患者治疗前ApoA1与临床特征的相关性
3 讨论
ApoA1作为HDL的重要组成成分,在心血管疾病中作为重要保护因素,同样证实在肿瘤的进展中发挥独一无二的作用。ApoA1被证实在多种肿瘤中具有抑制肿瘤发生、发展的作用,例如黑色素瘤[16]、结直肠癌[17]、卵巢癌[18],同样在动物模型中也可以看到ApoA1抗肿瘤作用,在带有黑色素瘤细胞、肺癌癌细胞的小鼠模型中,ApoA1的过度表达可以抑制肿瘤细胞的生长,皮下注射ApoA1可以降低肿瘤负荷,抑制肿瘤转移,延长小鼠的生存期[16]。在HCC中,有报道显示,ApoA1可以作为丙肝相关HCC的早期诊断指标,低水平ApoA1可以促进门脉癌栓形成,加快肿瘤的进展[19-20]。以上均与本文的研究结论相符合。
ApoA1是如何抑制肿瘤的发生、发展,目前已有多项研究探讨其机制,ApoA1通过调节肿瘤微环境,抑制肿瘤血管生成;ApoA1能够捕获循环中的肿瘤细胞,并且通过下调MAPK通路促进肿瘤细胞凋亡,进而达到抑制肿瘤细胞增殖的作用[13]。ApoA1通过信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)通路调节炎症信号,降低基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9),而MMP-9是促进肿瘤扩散转移的重要因子[21]。LPA是促进炎症反应,促进肿瘤发生的溶血磷脂酶。
在临床工作中,我们迫切需要简便、快捷的指标预测HCC患者的复发及生存期。到目前为止,AFP作为重要指标,在临床中广泛用于监测HCC的发生及复发。但仍有30%~40%属于AFP阴性,无法用AFP监测这部分患者HCC的发生及复发。本研究中,ApoA1以1.2 g/L为临界值将164例HCC分为两组,经局部微创治疗后,ApoA1≥1.2 g/L组PFS明显高于ApoA1<1.2 g/L组,但两组之间在OS方面却无显著性差异。根据本研究结果可以得出,TACE联合RFA治疗前血清ApoA1水平可以作为预测HCC复发的指标。临床医师可以根据治疗前血清ApoA1水平识别出具有复发高风险的患者,进而对这部分患者制定更合理有效的治疗策略。在目前临床检验中,ApoA1作为血脂检测指标之一,ApoA1检测很容易标准化,为HCC患者的治疗提供有效信息。
本研究也存在不足之处,为回顾性研究,缺乏前瞻性。同时本研究纳入的病例数偏少,可能会导致偏倚的存在,后期需要扩大样本量,进一步论证。
