公民逝世后器官捐献肝移植保存液污染:基于78例单中心对照研究
2020-01-16赵纪强汪邵平郑于剑谭晓宇何朝辉中国人民解放军南部战区总医院肝胆外科肝移植中心广东广州5000中山大学附属第八医院泌尿外科广东深圳58033
赵纪强,霍 枫,汪邵平,郑于剑,谭晓宇,何朝辉中国人民解放军南部战区总医院肝胆外科/肝移植中心,广东 广州 5000;中山大学附属第八医院泌尿外科,广东 深圳 58033
移植后感染是移植患者医院内发病和死亡的主要原因,尤其是术后第1月[1-2]。器官保存液(PS)污染是术后感染的潜在来源。PS不但可以保持污染菌存活,而且有利于其生长,从而提供了直接感染器官受者的传播途径[3]。有研究显示,总PS培养阳性率为37%(95%CI:27%~49%),PS培养致病菌阳性的受者发生PS相关的感染为10%(95%CI:7%~15%),培养阳性PS相关的感染增加移植受者术后早期死亡率[4-5]。为研究移植物PS污染并提高移植术后感染相关并发症的早期诊断和管理,许多器官移植中心已常规进行术中器官PS培养。然而目前还没有广为接受的指南用于PS评估或预防性抗生素应用[6]。
本研究拟对所在医院肝移植供受者临床资料进行回顾性分析,研究公民逝世后捐献肝脏的器官保存液的污染发生率、病原微生物类型和术后感染发生情况,总结公民逝世后捐献器官保存液污染和术后感染防控工作的经验教训,从而为肝移植临床疗效的提高和肝移植术后感染的防控工作提供依据。
1 资料与方法
1.1 一般资料
选择2016年3月~2017年11月中国人民解放军南部战区总医院(原广州军区广州总医院)共78例中国公民逝世后器官捐献供肝肝移植患者为研究对象。纳入标准:成年男性或女性;公民逝世后器官捐献供肝;受体行原位肝移植术或背驮式肝移植术;临床资料完整。排除标准:多器官联合移植;再次肝移植;跨血型肝移植;临床资料不完整者。采用回顾性调查的方法,汇总肝移植供者和受者一般资料、器官获取和移植手术信息、肝移植术后免疫抑制剂方案、急性排斥反应、术后感染、病原学培养结果等因素进行统计学分析。所有器官捐献者家属均签署知情同意书,符合医学伦理学规定。按照中国心脏死亡器官捐献分类标准,采取相应的捐献流程[7]。本项研究严格遵循赫尔辛基宣言(1975),并获医院伦理委员会批准。
1.1.1 供者资料 78例公民逝世后器官捐献供肝均由器官获取组织提供。其中保存液培养阳性组男性29例,女性3例;培养阴性组男性41例,女性5例。培养阳性组供者年龄16~61岁,平均39岁;培养阴性组供者年龄14~61岁,平均38岁。根据中国心脏死亡器官捐献分类标准,属于中国一类,即脑死亡器官捐献(DBD)供者47例;中国二类,即心脏死亡器官捐献(DCD)5例;其余26例为中国三类,即脑-心双死亡器官捐献(DBCD)供者(图1)。供者死亡原因包括严重脑外伤66例,脑血管意外10例和脑部神经系统疾病2例(图2)。
1.1.2 受者资料 接受公民逝世后器官捐献肝移植受者78例,所有受者均签署由医院伦理委员会批准的患者知情同意书,符合医学伦理学规定。培养阳性组男29例,女3例,年龄28~69岁,平均49.72岁;培养阴性组男41例,女5例,年龄31~72岁,平均50.35岁。全组受者基础肝脏原发病包括:原发性肝癌(肝癌),乙型病毒性肝炎(乙肝)后肝硬化,慢性重型肝炎,胆管细胞癌(肝内胆管细胞癌)等(表1)。

图1 纳入研究的供者器官捐献类型构成

图2 纳入研究的供者死亡原因构成

表1 纳入研究的肝移植受者基础肝脏疾病构成比[n(%)]
1.2 快速规范化器官获取
所有器官捐献手术均在手术室实施,采用经腹主动脉和门静脉联合灌注和腹部肝肾联合切取方式获取供肝,患者腹主动脉插管灌注高渗枸橼酸盐腺嘌呤溶液3 000 mL+威斯康星大学PS液1 000 mL,灌注高度100 cm。肠系膜上静脉插管,灌注高渗枸橼酸盐腺嘌呤溶液3 000 mL+威斯康星大学PS液500 mL,灌注温度0~4 ℃。供肝获取后应用器官保存袋逐层密封后0~4 ℃保存。供肝在手术室完成修整后分别留取供肝保存液100 mL送我院检验科进行需氧菌、厌氧菌和真菌培养。保存液有任何种类细菌生长时,则培养阳性保存液,不考虑细菌种类。
1.3 手术方式及免疫抑制剂方案
肝移植采取非转流经典原位肝移植或背驮式肝移植术。受者术中及术后4 d应用巴利昔单抗(Simulect®,Novartis Pharma Schweiz AG)20 mg/d进行免疫诱导。无肝期静脉应用甲基强的松龙(5~10 mg/kg)。术后第1天起,甲基强的松龙从5 mg/(kg·d)递减至0.3 mg/(kg·d),术后第8天停用。术后第1天开始口服麦考酚钠肠溶片(540 mg,1次/12 h),术后第4天开始口服他克莫司胶囊,他克莫司谷浓度维持在10~15 ng/mL。
1.4 围手术期抗生素预防及分组
患者麻醉成功后开始静脉滴注厄他培南(1 g,输注时间为1 h)。肝移植术后常规转入ICU,清醒后拔除气管插管,病情稳定后转入肝移植病房进行专科治疗。术后当日转换应用亚胺培南-西司他丁钠(1 g,静脉滴注,1次/8 h),伏立康唑(200 mg,静脉滴注,1次/12 h)。术后第3天根据PS培养结果将肝移植受者分为培养阳性组和培养阴性组。阳性组维持原抗菌素方案,疗程为1周。阴性组停用亚胺培南。伏立康唑静脉滴注1周后改为口服,培养阴性组,疗程2周;培养阳性组,疗程4周。
1.5 肝移植患者围手术期管理
术后第1周每日检查肝功能、肾功能、电解质、血常规、降钙素原、尿常规等指标,腹腔引流液、尿液、呼吸道分泌物细菌培养,移植肝及各吻合管道彩超检查、床边胸部X线摄片。当患者出现2项或2项以上炎症反应综合征症状或体佂时,则立即采集血液、尿液、痰等标本进行细菌培养,并增加培养次数。炎症反应综合征包括:发热(>38 ℃)或低体温(<36 ℃);呼吸急促(>20次/min)或过度通气,PaCO2<32.3 mmHg;心动过速(>90次/min);白细胞>12×109/L或<4×109/L,或未成熟白细胞>10%。肝移植术后感染诊断参照2001年中华人民共和国卫生部发布的《医院感染诊断标准》[8],根据患者临床症状、体征、实验室及影像学结果确定。术后患者一旦发生感染则进行相应治疗,并依据细菌学培养和药物敏感结果调整抗生素方案。依据移植肝穿刺活检诊断急性排斥反应。
保存液细菌培养结果与供者和肝移植受者细菌培养结果进行对比。病原菌匹配的标准是依据细菌种类及其相应的药敏谱[9]。
1.6 统计学方法
数据使用SPSS 22.0软件进行数据统计分析。年龄分析应用均数、最大值和最小值表示,计数资料以例数或百分比表示。使用描述性统计和χ2检验进行统计分析,P<0.05为差异具有统计学意义。
2 结果
2.1 供肝保存液污染情况
本研究78例公民逝世后器官捐献者,肝脏保存液病原菌培养阳性32例,阳性率41.03%,分离33株病原菌(表2)。其中革兰阳性球菌16株(48.48%),革兰阴性杆菌9株(27.3%),酵母菌5株(15.15%),革兰阳性杆菌3株(9.09%)。凝固酶阴性葡萄球菌、棒状杆菌、草绿色链球菌群等系腐生菌群共14株,占42.42%;而革兰氏阴性杆菌、金黄色葡萄糖球菌、草绿色链球菌之外的链球菌属、肠球菌和酵母菌等系致病菌,共19株,占57.58%。
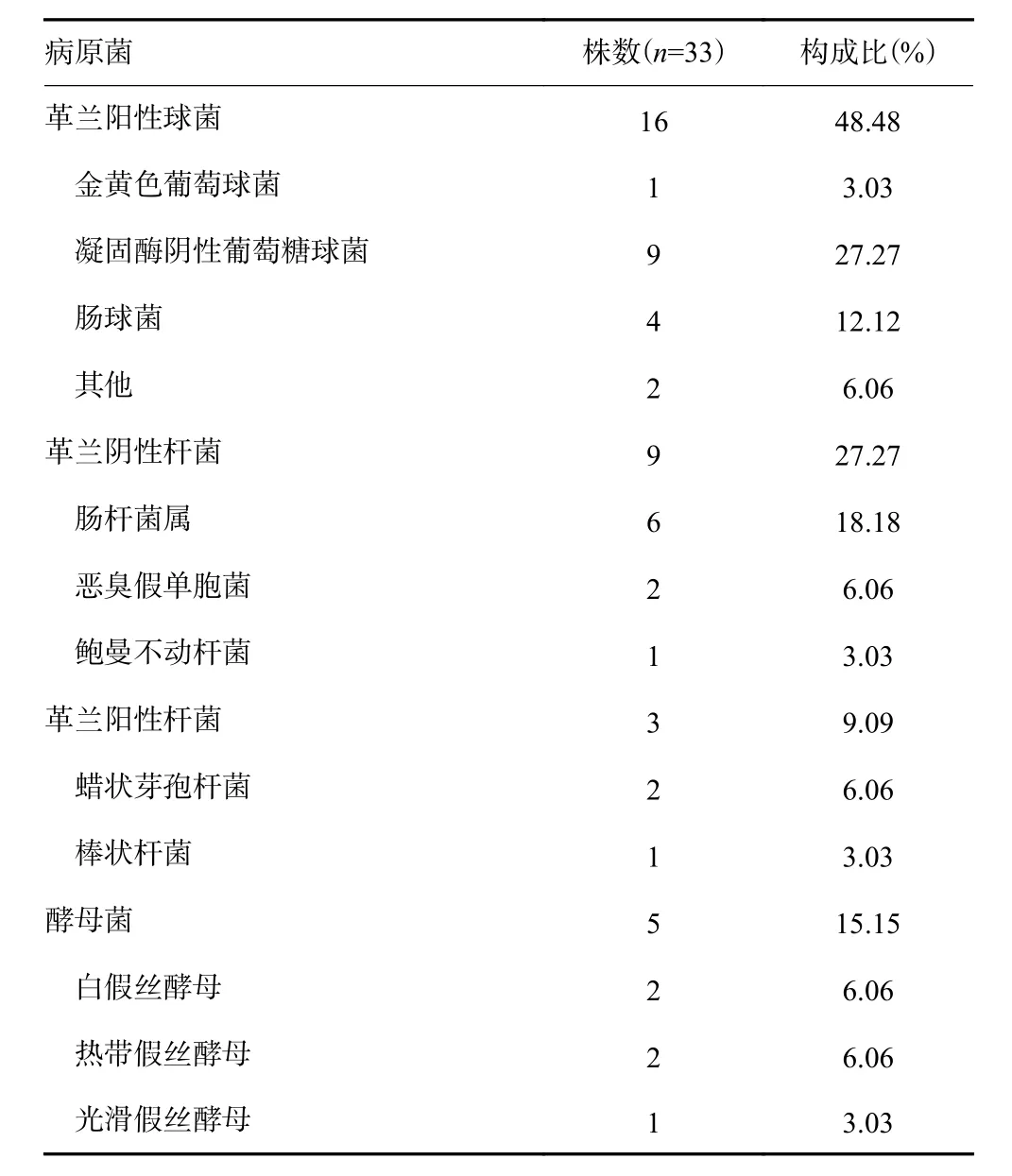
表2 保存液培养病原菌构成比
2.2 术后感染发生率及死亡率
78例肝移植患者中术后3月内,16例发生感染,感染率为20.51%。其中,培养液阳性组10例术后发生感染,感染率为31.25%,阴性组6例发生感染,感染率为13.04%,阳性组感染率高于阴性组(χ2=3.837,P=0.048)。78例患者中,死亡7例,总死亡率8.97%。发生感染的16例患者中,死亡3例,死亡率18.75%,未发生感染62例患者中死亡4例,死亡率6.45%,死亡率比较差异无统计学意义(χ2=2.355,P=0.148)。
培养阳性组32例患者中死亡2例,死亡率6.25%,均死于术后感染;阴性组46例患者死亡5例,死亡率10.87%,其中死于术后感染1例,术后腹腔出血2例,病理证实的移植物超急性排斥反应和围手术期多次心跳骤停致移植物功能衰竭各1例,死亡率比较差异无统计学意义(χ2=0.493,P=0.391)。
培养阳性组13例受者术后至少出现1次发热,发生率40.63%,阴性组9例受者术后至少出现1次发热,发生率19.57%,阳性组明显高于阴性组(χ2=4.133,P=0.042)。术后两组患者3月内发生经穿刺证实的急性排斥反应分别为1例和2例,排斥反应率之间的差异无统计学意义(P>0.05,表3)。

表3 肝移植受者术后3月感染率、急性排斥发生率、术后发热率和死亡率分布[n(%)]
2.3 术后感染部位分布
由不同部位术后感染例次分布情况得知,感染患者感染例次最多的部位是下呼吸道和腹腔,均为5例(31.25%,表4),其次是手术切口,为4例(25.00%)。

表4 术后不同部位感染例次数构成比[n(%)]
2.4 供者一般资料和临床资料比较
为观察肝移植受者术后感染的影响因素,对供者一般资料进行统计分析。结果显示,器官获取前培养阳性组供者ICU住院时间分别为2~7 d,平均4 d;培养阴性组供者ICU住院时间为2~5 d,平均3 d,差异具有统计学意义(χ2=29.938,P=0.000)。而性别比、平均年龄、器官获取时间之间的差异均无统计学意义(P>0.05,表5)。
2.5 肝移植受者临床指标和手术指标的比较
为明确肝移植受者因素对术后感染的影响,对受者和手术资料进行统计分析。结果显示,两组间各项指标差异无统计学意义(P>0.05,表6)。1例严重脑外伤捐献者捐献前ICU住院6 d,病原菌培养阴性,肝脏PS培养出鲍曼不动杆菌。该培养液阳性供肝受者术后2周内肝功能恢复正常。术后第3周发生发热,考虑“移植物抗宿主病”,血培养分离出鲍曼不动杆菌,并于术后第4周因重症肺部感染、多脏器功能衰竭死亡。1例脑血管意外捐献者,器官捐献前ICU住院6 d,痰培养分离嗜麦芽寡养单胞菌,肝脏PS培养分离头状葡萄糖球菌。该阳性受者术后4周因发热入院,行内镜下逆行胰胆管造影术检查,胆汁培养分离出鲍曼不动杆菌,治疗后症状缓解,后胆管炎反复发作,随访至术后30月,肝内胆管已经出现广泛节段性狭窄性病变。其他PS培养阳性受者术后恢复顺利,随访至今,人/移植物生存良好。

表6 PS培养阳性组与阴性组受者手术指标比较(Mean±SD)
2.6 不同肝移植手术方式的术后感染情况
78例肝移植患者中,经典肝移植55例,14例发生感染,感染率25.45%;背驮式肝移植23例,2例发生感染,感染率8.70%,不同手术方式患者的感染率比较差异无统计学意义(χ2=2.794,P=0.082)。
2.7 不同CTP或MELD评分的患者术后感染情况
78例肝移植患者中,术前肝功能CTP评分,其中A级肝功能29例,B级肝功能22例,C级肝功能27例(表7)。其中B级肝功能感染率最高,为26.67%,但不同肝功能CTP评分患者的感染率比较,差异无统计学意义(χ2=5.044,P=0.080)。术前MELD评分,其中<20分51例,20~30分10例,30~40分15例,>40分2例。MELD评分>40分患者感染率最高,为50%,<20分患者感染率最低,为15.69%。不同MELD评分患者的感染率比较差异无统计学意义(χ2=2.696,P=0.441)。

表7 不同CTP或MELD肝功能分级患者的术后感染率
3 讨论
本研究中有78例公民逝世后捐献肝脏,PS培养阳性32例,阳性率41.0%,PS相关感染率为1.28%,与国外相关文献报道一致[4]。肝移植受者发生术后感染16例,总感染率为20.51%,低于国内相关文献报道(54%~83%)[10]。培养阳性受者术后感染10例,感染率31.25%,而培养阴性受者术后感染6例,感染率13.04%。可见,一旦PS污染,肝移植受者术后发生感染风险显著增加。肝移植术后3月内总死亡率8.97%,发生感染的患者死亡率为18.75%,无感染患者死亡率为6.45%。发生感染患者与无感染患者死亡率的差异无统计学意义,故推断与本研究样本量少、随访时间短有关。
目前,国内对PS污染病原菌情况及其对移植后早期并发症的影响罕有报道。而污染的PS病原菌,其可能来源于器官获取时捐献者,尤其是感染性捐献者,以及腹部手术切口、消化道管腔创口或肝脏修整等多个环节。污染的病原菌可通过移植器官传播至受者而引起相应的术后感染等并发症。由于培养时机、次数等因素影响,器官获取前捐献者的血、尿、呼吸道分泌物等细菌学培养,并不能全面评估捐献器官的感染状态。因此,获取前器官捐献者各种标本与器官PS病原学培养结果并不完全一致,这与国外研究结果相似[11-12]。因此,器官PS病原菌培养对捐献器官评估、术后抗生素选择、抗排斥药物使用等具有重要指导意义。
鉴于PS污染发生率很高,但有理由推断,术后无发生PS污染传播与早期使用有针对性抗生素有关。国外文献中,很少有报道,通过污染的PS引起供者至受者的传播性感染[4, 6, 13]。一旦发生经PS污染引起的感染传播案例,其死亡率非常高[5, 14]。此外,现有的文献表明,通过保存液污染传播的疾病总是与已知的人类病原菌有关。当前研究结果与其他研究相似,78例公民逝世后捐献肝脏肝移植患者,1例(1.28%)术后发生与PS培养病原菌(鲍曼不动杆菌)相同病原菌的感染,发生率1.28%,且患者于术后4周因重症肺部感染死亡。培养阳性肝移植患者术后虽然具有较高的术后感染率,但死亡率没有增加。我们推断其原因:一方面,肝移植患者术后无一例外均转入ICU监护治疗;另一方面可能与术中和术后序贯性应用长效、广谱抗菌药物有关。培养阳性受者具有较高的发热率,原因不明,可能与循环中内毒素和其他细菌产物有关[15]。已有研究发现,PS培养阳性受者更易发生急性排斥,原因是受者感染,降低了免疫抑制剂强度而诱发排斥反应。但本研究中,由于围手术期序贯性使用碳青霉烯类广谱抗菌药物,有效预防和治疗PS污染及其他病原菌引起的受者感染,可能降低了移植肝急性排斥风险。
与其他研究结果相似,本研究中PS培养最常见病原菌是凝固酶阴性葡萄糖球菌和肠杆菌属。较高凝固酶阴性葡萄糖球菌检出率,提示细菌是外源性污染(器官获取或者供肝修整期间)而非内源性(来自肾或肝脏的细菌),提示在器官获取、保存、运输和供肝修整等任何一个环节中非无菌操作均是PS污染的潜在来源。更重要的是,与其他研究相似,PS中分离到更多的是致病菌,包括肠杆菌、假单胞菌和鲍曼不动杆菌等,提示更应关注住院时间长,尤其是ICU存留时长的潜在器官捐献者的感染问题。一旦PS出现致病菌生长时,就应该考虑其受者的可能风险,高度重视PS致病菌污染可能引起的受者感染。
抗感染方面,相对于传统供肝肝移植,公民逝世后供肝肝移植的感染更为严重,常导致大出血等恶性并发症。鉴于现阶段我院器官捐献供体来源多为严重脑外伤和脑血管意外,获取前入住ICU时间长,存在气管插管、留置尿管、深静脉置管或有创手术操作等医院内感染危险因素,甚至部分供者发生多重耐药菌感染并接受广谱抗生素治疗[16]。因此,在前期研究基础上,我中心在肝移植手术期间采用厄他培南静脉滴注,时间为1 h。厄他培南具有覆盖需氧的革兰氏阳性和阴性以及厌氧菌的广谱抗菌活性,以及独特的更长的半衰期,允许每日仅需使用1次,术中无需再次追加,可保证手术期间有效的药物浓度,从而便于手术管理[17]。术后当日转换应用碳青霉烯抗生素——亚胺培南-西司他丁钠,它不仅具有与前者相似的抗菌活性,还具有良好的性价比;同时,大量临床和实验研究显示,厄他培南单独或与第二种碳青霉烯类抗生素在治疗器官移植后复杂感染,甚至耐碳青霉烯类细菌感染中显示了良好的抗菌效果[18-20]。供肝PS细菌药物敏感谱显示,该序贯性抗生素方案可完全覆盖器官PS污染病原菌,并不需要根据供肝PS培养结果再做针对性抗生素调整,为术后治疗可能来源于器官PS污染或术后受者感染争取了时间。结果也显示,培养阳性组受者死亡率、急性排斥发生率与阴性组差异无统计学意义。因此,我们推断,序贯使用厄他培南和亚胺培南方案能有效预防和治疗器官PS污染和术后可能其他来源病原菌引起的受者感染。
本研究中,5例公民逝世后捐献肝脏PS分离出酵母菌,发生率6.4%,较其他研究结果稍高。通过移植物传播的念珠菌症引起的真菌性动脉瘤炎与肾移植术后高患病率和高死亡率具有相关性[21]。然而,在肝移植患者中鲜有相关研究和报道。在本研究中,5例PS培养阳性受者术后恢复顺利,未发生来自于器官PS污染的酵母菌感染,可能与我中心早期、足量和长疗程应用抗真菌药物有关。
总之,公民逝世后捐献肝脏PS具有较高的细菌污染率。随着我国公民逝世后器官捐献的开展,捐献器官数量和移植数量已经跃至世界第2位。但由于我国特有的器官捐献模式,器官捐献者多为严重脑外伤、脑血管意外,住院时间尤其是ICU存留时间长,潜在感染风险高。因此,优化器官捐献和移植前的病原菌培养流程,完善器官获取、保存和移植前器官修整流程,严格无菌操作,有助于降低器官PS细菌污染风险。围手术期序贯使用厄他培南和亚胺培南可有效预防和治疗供肝PS污染和其他来源的病原菌引起的术后受者感染。由于研究样本少,随访时间短,且属于单中心研究,PS污染对肝移植受者远期移植物功能和胆道并发症影响需要进一步研究。
