基于多壁碳纳米管增敏材料的辣根过氧化物酶分子印迹电化学传感器的制备及对H2O2的检测
2020-01-16杨绍明柏朝朋
滕 渝, 杨绍明, 柏朝朋, 张 剑
(华东交通大学材料科学与工程学院, 南昌 330013)
分子印迹聚合物(MIPs)作为一种模拟型抗体, 不仅保留了抗体和抗原识别专一性的优点, 而且克服了抗体和抗原受环境影响大、 不稳定及可重复利用性差等的缺点[1]. 将MIPs作为识别单元与具有灵敏度高、 分析速度快及仪器设备简单等特点的电化学方法结合构建的分子印迹电化学传感器, 兼具MIPs和电化学方法两者的优点, 受到了广泛关注. 目前, 分子印迹电化学传感器已被用于检测槲皮素[2]、 多巴胺[3]、 双酚A[4]等小分子物质以及牛血清白蛋白[5]、 血红蛋白[6]等蛋白质大分子物质.
对于检测蛋白质的分子印迹电化学传感器, 因蛋白质的尺寸较大、 功能基团的结构复杂和多样, 导致其传质受阻和洗脱困难等问题. 电聚合表面分子印迹方法因其分子印迹识别位点处于MIPs的表面薄层中, 可有效克服蛋白质的传质受阻和洗脱困难等问题, 而成为用于检测蛋白质的分子印迹电化学传感器中的常用方法[7]. 电聚合吡咯[8]、 邻氨基酚[9]、 多巴胺[10]、 邻苯二胺(o-PD)[11]和铬黑T[12]等已被用于构建检测牛血清白蛋白、 肌红蛋白、 前列腺特异抗原及人绒毛膜促性腺素等多种蛋白质的分子印迹传感器. 其中,o-PD具有较低的成膜电位, 易通过电聚合形成聚邻苯二胺(POPD)分子印迹膜, 而且其具有氧化还原活性, 存在一对明显的氧化还原峰, 可以作为蛋白质检测的分子印迹传感器的电化学探针. 以分子印迹膜充当电化学探针, 可以精简探针的引入和简化电极的制作过程. 此外, 利用电化学聚合形成的POPD分子印迹膜与目标分子蛋白质有特异性的相互作用, 可为蛋白质的固定化提供一种有效的方法, 且此方法便捷、 稳定不易脱落.
在蛋白质检测的分子印迹电化学传感器中, 为了增强传感器的检测信号, 提高传感器的电子传输速率, 纳米材料如碳材料[13,14]、 金属纳米材料[15,16]、 量子点[17,18]及复合材料[19]等被引入到传感器的表面作为增敏材料. 碳材料中的碳纳米管(CNTs)是其中的典型代表, 它是一种由碳原子形成的石墨稀片层卷成的无缝、 中空的一维新型碳结构, 具有优良的力学、 电学和电化学性能[20~22], 且其比表面积大、 催化效率高[23,24].
辣根过氧化物酶(HRP)是一种糖蛋白, 由单个多肽链组成, 包括308个氨基酸残基、 1个正铁原卟啉(血红素)和2个Ca2+, 相对分子质量约为44000. 因其价格相对便宜、 催化活性和稳定性高, HRP常用于酶联免疫吸附测定(ELISA)、 免疫传感器、 酶传感器和DNA传感器等生物分析中催化放大检测信号, 以提升检测的性能, 而且HRP的量与生物分析的性能密切相关. 本文选用HRP为蛋白质的典型代表, 将羧基化多壁碳纳米管(MWCNTs)作为增敏材料, 以电聚合形成的POPD分子印迹膜为电化学探针, 构建了灵敏度高、 选择性和稳定性好的HRP分子印迹传感器. 此外, 以POPD分子印迹膜为固定化HRP的载体和电子介体, 构建基于HRP催化活性的H2O2传感器, 对该传感器进行表征的同时还对基于POPD分子印迹膜的传感器检测HRP和H2O2的性能进行了研究.
1 实验部分
1.1 试剂与仪器
辣根过氧化物酶(HRP, 250 U/mg, 上海三杰生物技术有限公司); 邻苯二胺(分析纯, 天津市大茂化学试剂厂); 碳纳米管(CNTs, 纯度≥97%, 深圳纳米港有限公司); 30%过氧化氢(H2O2, 西陇科学股份有限公司); 葡萄糖氧化酶[100 U/mg, 生工生物技术(上海)有限公司]; 凝血酶(THR,Mw=36700 g/mol, 上海生物工程有限责任公司); 半胱氨酸(纯度99%, 上海山浦化工有限公司); 酪氨酸(纯度99%, 上海蓝季发展有限公司); 磷酸盐缓冲溶液(PBS, pH=6.8).
CHI660E型电化学工作站(上海辰华仪器有限公司), 三电极体系: 铂电极为对电极, Ag/AgCl 为参比电极, 玻碳电极为工作电极; Nova NanoSEM 450型场发射扫描电子显微镜(SEM, FEI捷克有限公司); X-Max20型能谱仪(英国牛津仪器公司).
1.2 实验过程
称取0.2 g MWCNTs, 加入40 mL H2SO4/HNO3(体积比为3∶1)混合酸溶液, 超声8 h后抽滤, 滤液用去离子水洗涤至中性, 滤渣于80 ℃烘干[25]. 将裸玻碳电极置于1 mg/mL羧基化MWCNTs溶液中, 采用阶跃电位法先于2.0 V恒电位下电沉积240 s, 再于-0.4 V恒电位下电沉积80 s, 制得 MWCNTs/GCE修饰电极[26]. 将该电极置于含0.1 mg/mL HRP, 0.3 mg/mLo-PD, 0.1 mol/L KCl和PBS缓冲液(pH=6.8)的电沉积液中, 采用循环伏安扫描法于0.8~-1.0 V电位范围内聚合30圈, 扫描速率为50 mV/s, 即在MWCNTs/GCE电极上制得印迹有HRP的POPD分子印迹聚合膜. 将该电极置于甲醇/乙酸(体积比2∶3)混合洗脱液中洗脱20 min, 除去聚合膜中的模板分子HRP. 另制备非分子印迹(NIP)传感器, 其制备过程与MIPs传感器相同, 只是在电聚合沉积液中不加模板分子.
2 结果与讨论
2.1 电极表面的形貌表征和能谱分析

Fig.1 SEM images of MWCNTs/GCE(A), POPD/GCE(B) and MIPs/MWCNTs/GCE before(C) and after(D) extracting HRP
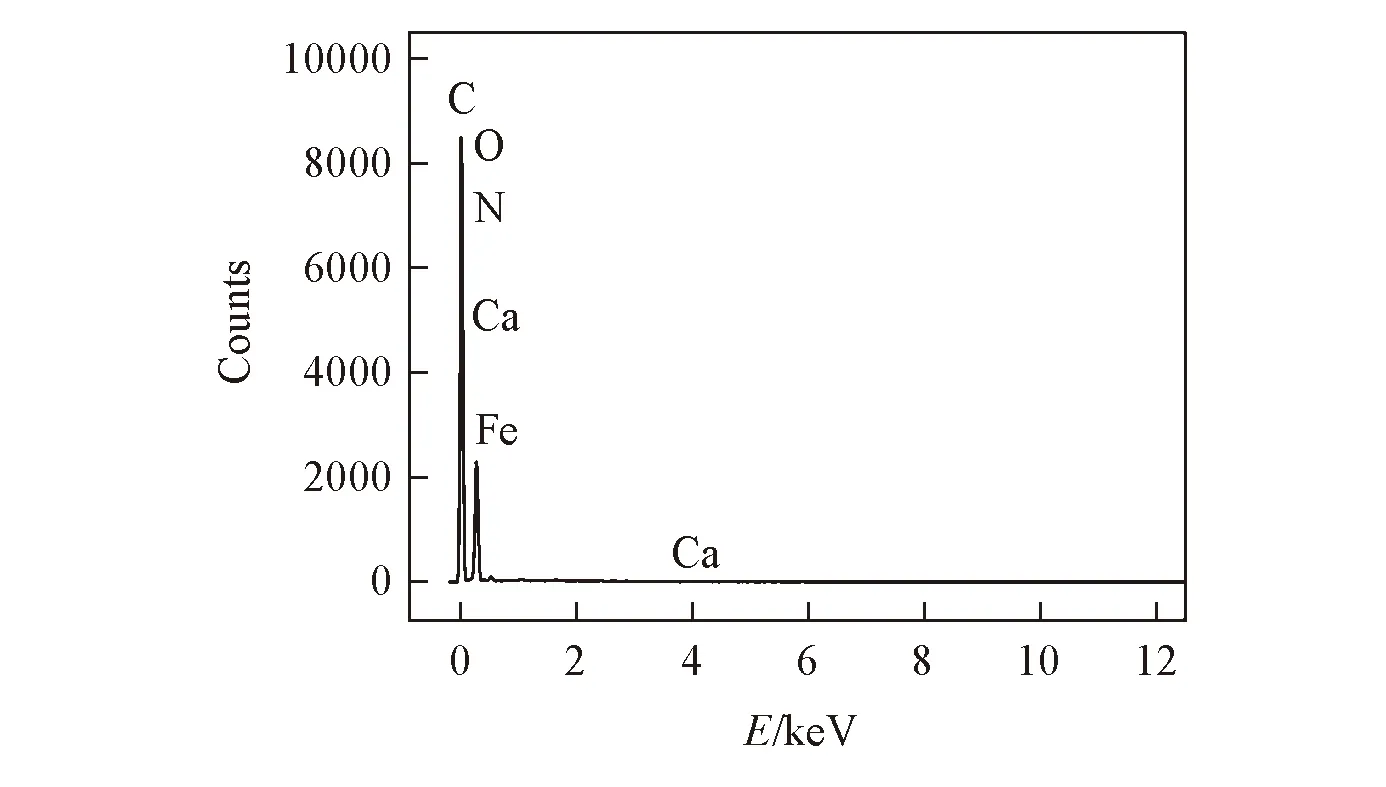
Fig.2 EDS spectrum of MIPs/MWCNTs/GCE before extracting HRP
图1(A)~(D)分别示出了MWCNTs/GCE电极, POPD/GCE电极及MIPs/MWCNTs/GCE电极洗脱HRP前、 后的表面形貌. 由图1(A)可见, MWCNTs均匀地覆盖在玻碳电极表面, 形成了一个多孔的框架结构, 且管径分明、 形状规则, 管径分布在40~70 nm之间. 由图1(B)可见, POPD在电极表面形成了一层致密的聚合膜. 由图1(C)和(D)可见, MIPs均匀附着于MWCNTs表面, 与单纯的MWCNTs相比, 附着有MIPs的MWCNTs管径增大, 说明比表面积大的MWCNTs有利于MIPs的附着, 且形成的MIPs粒径较小, 分散性好. 通过对比去除模板分子前后的聚合膜发现, 洗脱模板分子HRP后电极表面形貌变得粗糙、 疏松, 呈现出多孔隙的形貌, 这是由于模板分子HRP离开聚合物膜后, 会在聚合膜上留下与模板分子结构相匹配的印迹空穴, 印迹聚合膜根据印迹空穴的形状及识别位点可特异性识别、 再吸附HRP.
对未洗脱模板分子的MIPs/MWCNTs/GCE修饰电极进行了能谱分析, 如图2所示, 可见C, O, N, Ca和Fe元素的峰, 结合图1可知, 增敏材料MWCNTs已附载在玻碳电极表面. Ca和Fe元素峰为HRP的特征峰, N主要是邻苯二胺的组成元素, 说明在电聚合邻苯二胺的过程中, HRP与o-PD之间通过分子间作用力聚合在电极表面.
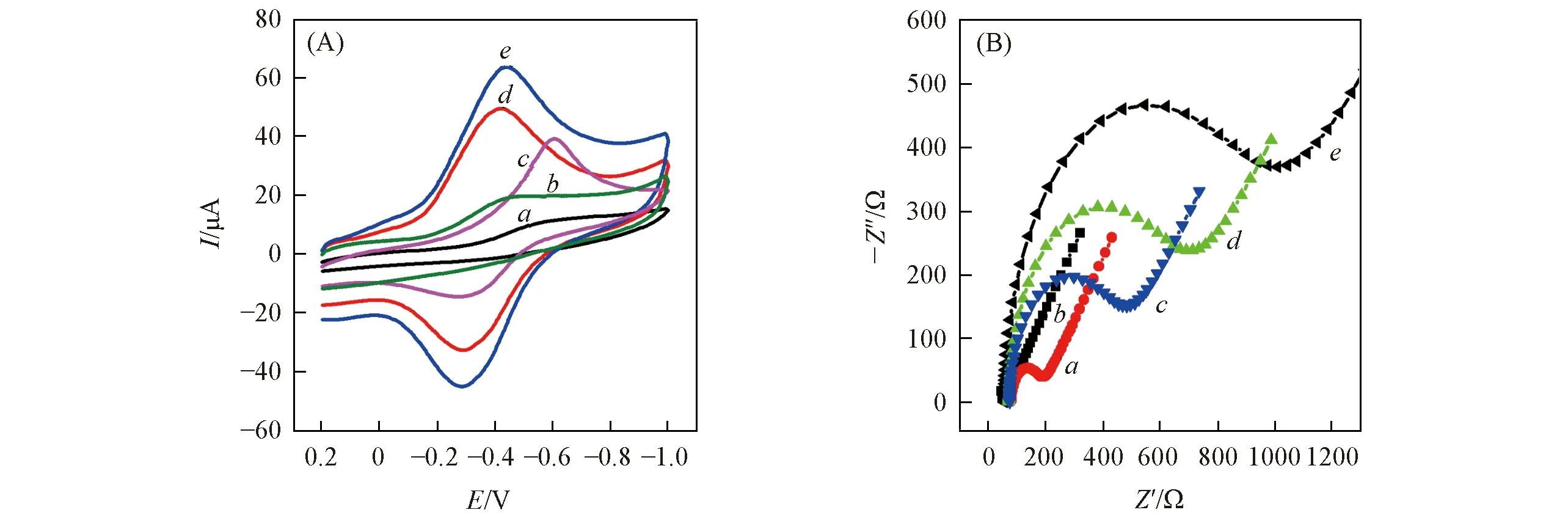
Fig.3 CV(A) and EIS(B) profiles of HRP molecularly imprinted sensor assembly process a. Bare GCE; b. MWCNTs/GCE; c. MIPs/MWCNTs/GCE before extracting HRP; d. MIPs/MWCNTs/GCE after rebinding HRP(1.0×10-7 mg/mL); e. MIPs/MWCNTs/GCE after extracting HRP.
2.2 修饰电极组装过程的表征
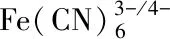
2.3 MWCNTs的增敏作用及MIPs的特异性识别
为了验证MWCNTs的增敏效果及MIPs的特异性识别性能, 对相同条件下制备的MIPs/GCE, MIPs/MWCNTs/GCE和NIPs/MWCNTs/GCE 3种传感器洗脱HRP前后的CV图进行了对比, 如图4所示. 对比图4谱线a,b和c,d可知, MIPs/GCE传感器除去模板分子前后氧化还原峰电流和阻抗值变化幅度比MIPs/MWCNTs/GCE传感器小, 说明MWCNTs可有效增大MIPs/MWCNTs/GCE传感器的比表面积, 提高印迹膜中HRP的印迹位点数量, 从而促进POPD膜与基底电极间的电子传递; MIPs/GCE的CV电位间距比MIPs/MWCNTs/GCE的大, 说明MWCNTs的引入更利于电子转移; 且对比谱线b和d的峰电流(分别为63.25和50.19 μA)可知, 引入MWCNTs后会起到一定的信号增强作用. 由谱线e和f可知, NIPs/MWCNTs/GCE传感器在模板分子洗脱前后氧化还原峰电流、 电位间距和阻抗值变化均较小, 这是由于NIPs/MWCNTs/GCE传感器的印迹膜中不存在HRP分子, 洗脱前后不会出现印迹空穴所致.
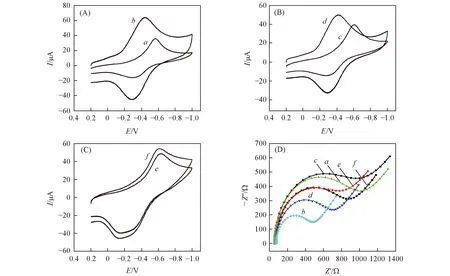
Fig.4 CV(A—C) and EIS(D) profiles of different molecularly imprinted sensors a. MIPs/MWCNTs/GCE before extracting HRP; b. MIPs/MWCNTs/GCE after extracting HRP; c. MIPs/GCE before extracting HRP; d. MIPs/GCE after extracting HRP; e. NIPs/MWCNTs/GCE before extracting HRP; f. NIPs/MWCNTs/GCE after extracting HRP.
2.4 扫描速率对MIPs/MWCNTs/GCE传感器的影响
采用循环伏安法考察了MIPs/MWCNTs/GCE传感器在0.01~1.0 V/s的扫描速率范围内对POPD峰电流的影响, 结果见图5. 以氧化还原峰电流对扫描速率作图, 通过线性拟合可知, 氧化还原峰电流(Ip/μA)与扫描速率呈正比, 线性方程为Ipa=-18.52-183.70ν(相关系数为0.986),Ipc=32.26+
187.80ν(相关系数为0.991), 可见POPD在电极上的氧化还原是一个受吸附控制的过程.
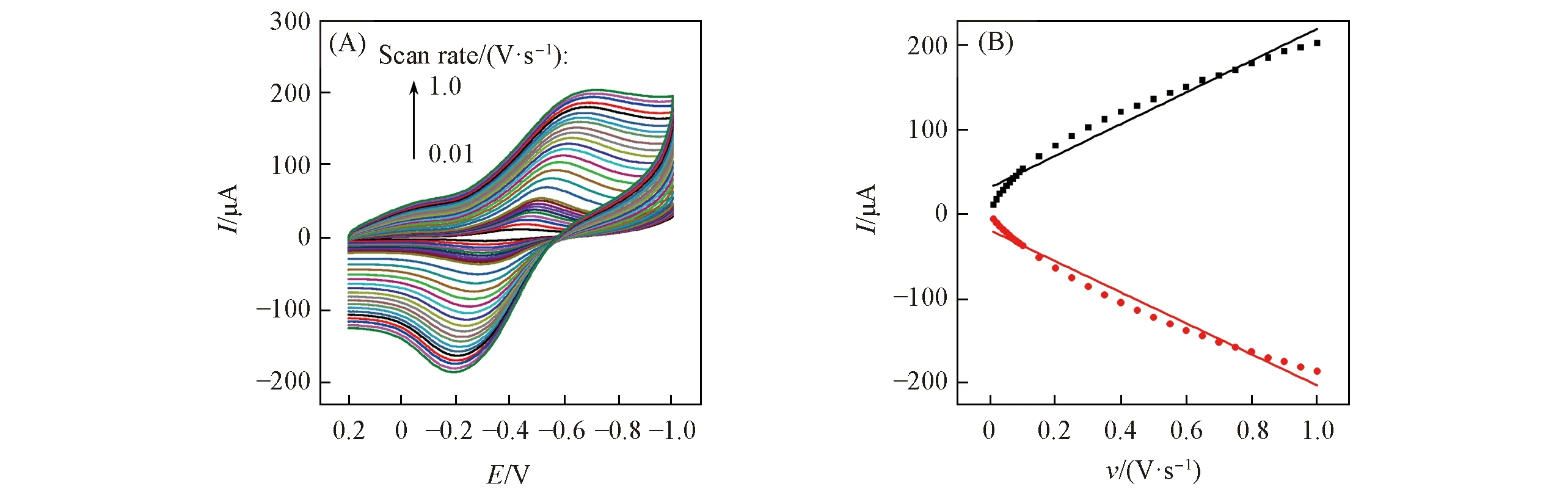
Fig.5 CV responses of MIPs/MWCNTs/GCE sensor with scan rates from 0.01 V/s to 1.0 V/s(A) and linear fitting curve between peak current to scan rate(B)
2.5 实验条件的优化
适量的功能单体更有利于印迹膜的形成, 但过多单体会导致非特异性结合位点数量增加, 降低印迹膜对目标分子的特异选择性. 为确定功能单体和模板分子的最佳浓度比, 固定聚合液中HRP浓度为0.1 mg/mL, 改变o-PD的浓度, 使聚合单体和模板分子的浓度比分别为1∶1, 2∶1, 3∶1, 5∶1和10∶1, 采用差分脉冲法测量模板分子洗脱前后电极峰电流的变化ΔΙ(ΔΙ=Ι-Ι0,Ι0和I分别为洗脱模板分子前、 后的峰电流值)来确定最优浓度比. 如图S1(A)(见本文支持信息)所示, 当o-PD与HRP的浓度比为3∶1时, 峰电流差ΔΙ达到最大值, 说明由此浓度比制备的印迹膜中HRP的特异性结合位点最多, 印迹效果最好.
模板分子的去除效率对传感器的检测效果有着直接影响, 也是分子印迹传感器制备过程的关键步骤之一. 如图S1(B)(见本文支持信息)所示, MIPs/MWCNTs/GCE传感器在甲醇/乙酸(体积比为2∶3)混合溶液中洗脱前后峰电流差ΔΙ最大, 这可能是由于在此酸性条件下, HRP与POPD之间的分子间作用力被削弱, 致使模板分子从聚合膜中被洗脱.
如图S1(C)(见本文支持信息)所示, 峰电流差ΔΙ随洗脱时间的增加而增大, 在15 min后趋于稳定, 因此选择15 min为MIPs/MWCNTs/GCE传感器的最佳洗脱时间.
考察了不同pH值的测试底液对MIPs/MWCNTs/GCE传感器性能的影响. 如图S1(D)(见本文支持信息)所示, 当pH在5.29~5.8范围内变化时, 峰电流随着pH的增大而增大, 并在pH=5.8时达到最大; 当pH>5.8后, 峰电流随pH的增大而减小. 在整个过程中, 峰电位逐渐负移, 说明聚合膜的活性位点在偏酸性条件下易被还原. 综合以上结果可知, 测试底液的最佳pH=5.8.
模板分子在印迹膜上的吸附过程是影响分子印迹传感器检测效果的重要因素. 由于HRP分子进入印迹空穴并达到吸附平衡需要一定时间, 因此选择合适的孵育时间, 能显著提高MIPs/MWCNTs/GCE传感器对HRP的电化学响应及后续对H2O2的检测效果. 如图S1(E)(见本文支持信息)所示, 孵育前后峰电流差ΔΙ随着孵育时间的增加, 呈先增大然后趋于稳定的趋势, 并于孵育20 min时达到稳定, 这说明HRP分子在印迹聚合膜上已达到吸附平衡, 印迹膜上有效印迹空穴已基本被HRP分子占据, 因而最佳孵育时间为20 min.
2.6 传感器的检测性能
在最优检测条件下, 利用差分脉冲伏安(DPV)法考察了MIPs/MWCNTs/GCE传感器在不同浓度HRP溶液中孵育后的电化学性能, 结果如图6(A)所示. 可见, MIPs/MWCNTs/GCE电极的响应电流随着HRP浓度的增大而逐渐降低, 这是由于随着HRP浓度的增大, 印迹膜中的特异性识别空穴逐渐被HRP分子占据, 阻碍了POPD与基底电极之间的电子传递. 图6(B)为孵育前后传感器对HRP的响应电流差ΔΙ与HRP浓度的对数lgc之间的线性关系图, 可见, MIPs/MWCNTs/GCE传感器的响应电流与HRP浓度在1.0×10-10~1.0×10-5mg/mL范围内有良好的线性关系, 线性回归方程为ΔΙ=-90.40-5.32lgc, 相关系数为0.991, 检出限为1.5×10-11mg/mL(S/N=3).
实验采用计时电流法实现了对H2O2的分析检测. 将制备的分子印迹电极置于1.0×10-8mg/mL HRP溶液中孵育20 min后, 在-0.37 V电位下, 于搅拌下每隔30 s向10.0 mL 0.2 mol/L的PBS缓冲溶液(pH=5.8)中连续滴加40 μL 100 μmol/L的H2O2溶液, 实验结果如图6(C)所示. 可见, MIPs/MWCNTs/GCE电极的响应电流随着H2O2浓度的增大而增大, 表明MIPs/MWCNTs/GCE电极对H2O2有良好的电催化作用. 图6(D)为由图6(C)给出的响应电流对H2O2浓度的线性关系图, 可见, MIPs/MWCNTs/GCE电极的响应电流与H2O2浓度在0.4~14 μmol/L范围内呈良好的线性关系, 线性方程为ΔΙ=-0.88+12.28cH2O2, 相关系数为0.992, 检出限为2.6×10-7mol/L(S/N=3).
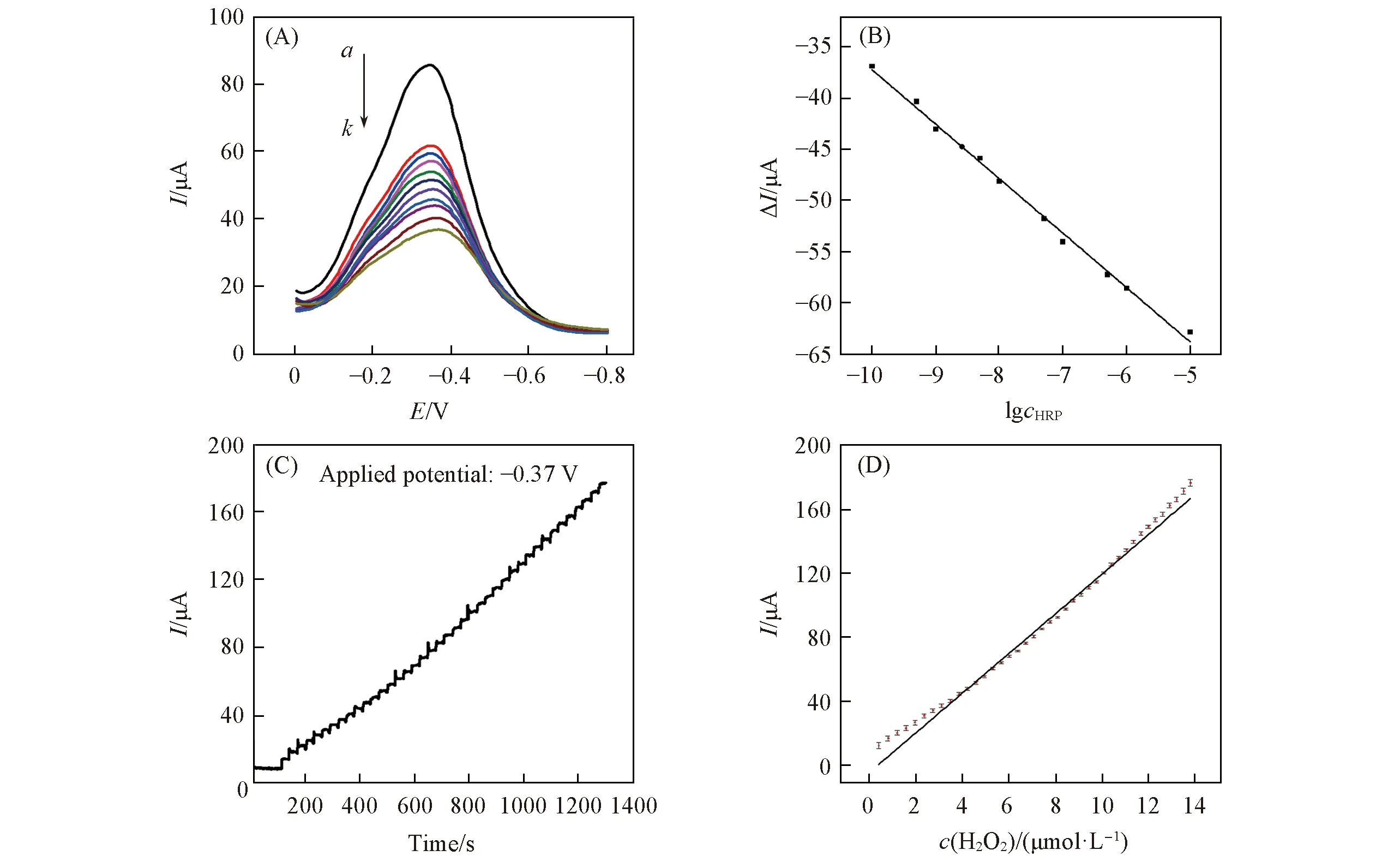
Fig.6 DPV response of MIPs/MWCNTs/GCE sensor to different concentrations of HRP(A) and corresponding linear fitting curve(B), I-t curve of the MIPs/MWCNTs/GCE modified electrode to successive addition of H2O2(C) and corresponding linear fitting curve(D) a. Blank; concentration of curve a—k: 10-10—10-5 mg/mL.
为了进一步证明该传感器检测H2O2的性能, 将其分析性能与其它传感器的性能进行了比较. 由表1数据可见, 本文开发的传感器表现出理想的分析性能, 在检出限和灵敏度方面略优于其它传感器.
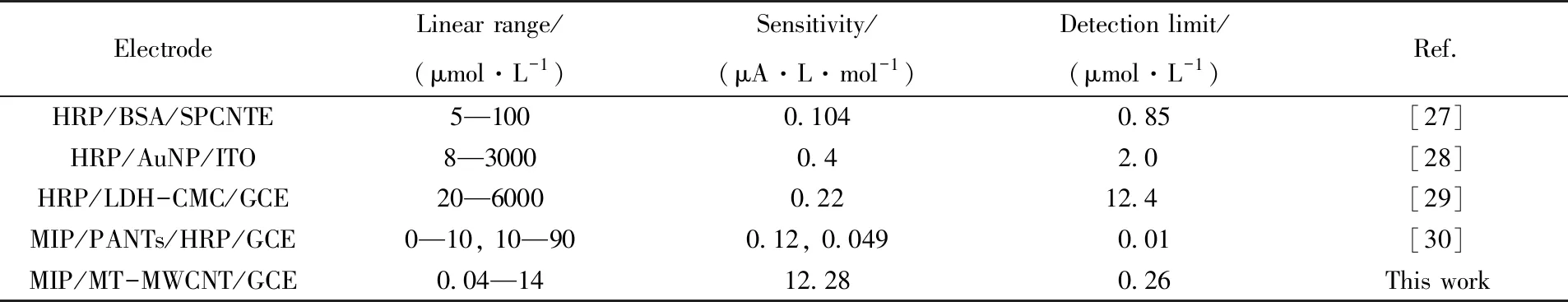
Table 1 Analytical performances of H2O2 sensors based on HRP
2.7 对HRP识别过程的动力学模型
为了进一步验证模板分子在印迹膜上的吸附动力学是分子印迹传感器的一项重要性能指标, 利用DPV法测得MIPs/MWCNTs/GCE和NIPs/MWCNTs/GCE修饰电极在1.0×10-8mg/mL HRP溶液中的吸附图. 如图7所示, 并根据Langmuir吸附模型, 拟合2种修饰电极吸附HRP的动力学曲线得到动力学模型, 动力学方程为
ΔIp=ΔIpmt/(k+t)
式中:t(min)为吸附时间;k(min)为动力学结合常数; ΔIp(μA)为传感器吸附目标分子t时间后的响应电流与空白时的差值; ΔIpm(μA)为平衡时刻响应电流变化值.
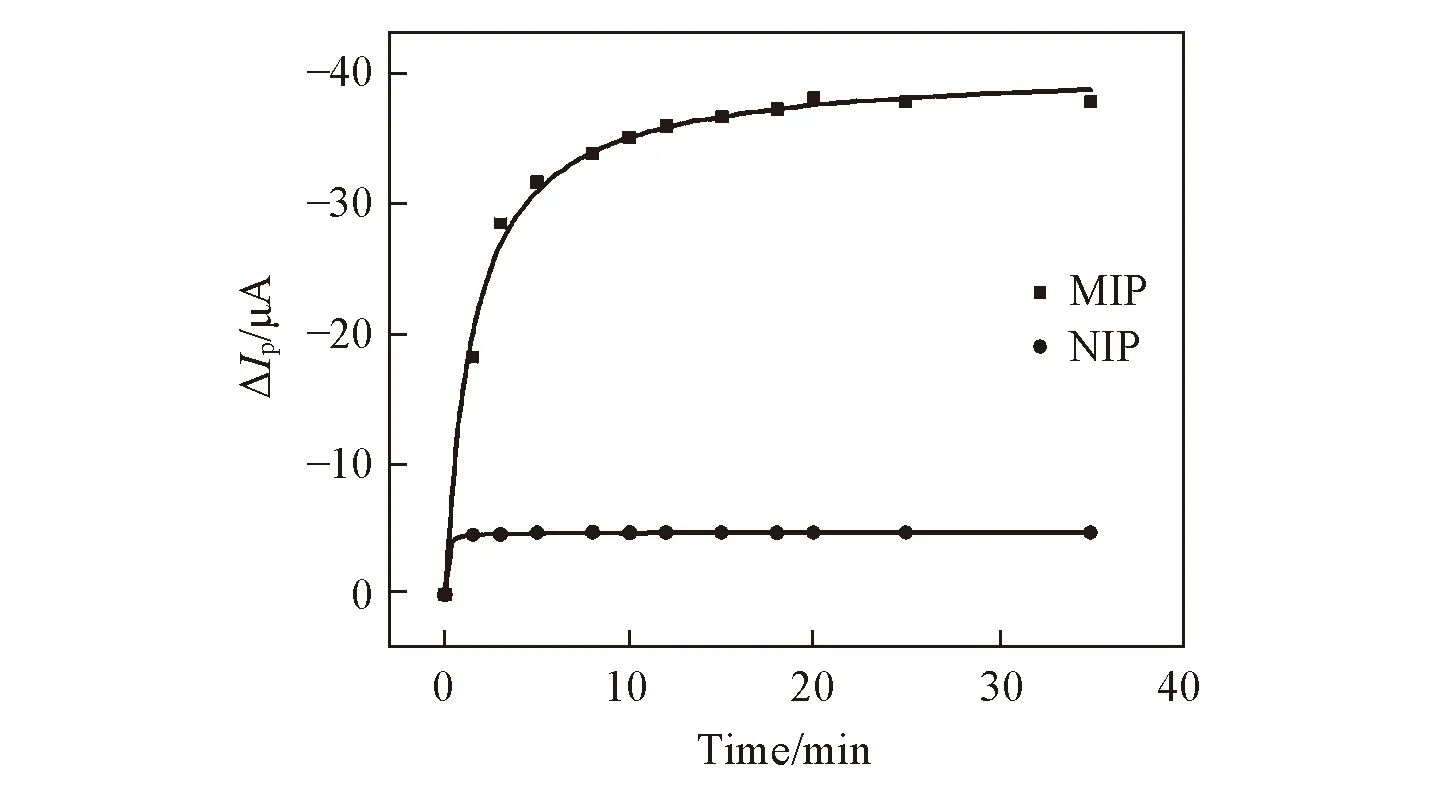
Fig.7 Kinetic response curves of HRP at different sensors
由图7可以看出, MIPs/MWCNTs/GCE传感器结合HRP分子的速率远远大于NIPs/MWCNTs/GCE传感器, 这是由于NIPs/MWCNTs/GCE传感器中没有HRP分子的结合位点所致.
拟合后所得拟合参数如表2所示, 推测得MIPs/MWCNTs/GCE传感器的吸附动力学方程为ΔIp(MIPs)=-4.05×10-5t/(1.52+t), NIPs/MWCNTs/GCE传感器的吸附动力学方程为ΔIp(NIPs)=-4.75×10-6t/(0.06+t). 印迹因子α可以反映MIPs/MWCNTs/GCE与NIPs/MWCNTs/GCE对目标分子特异性识别能力的差别,α数值越大, 则该传感器对目标分子的特异性识别能力越强. 根据拟合参数ΔIpm和计算公式αMIPs=ΔIpm(MIPs)/ΔIpm(NIPs), 计算得出传感器的印迹因子αMIPs=8.53, 说明MIPs/MWCNTs/GCE传感器对HRP分子有较强的特异性识别能力.

Table 2 Adsorption kinetic curve parameters of different sensors
2.8 MIPs/MWCNTs/GCE传感器的选择性、 稳定性和重现性
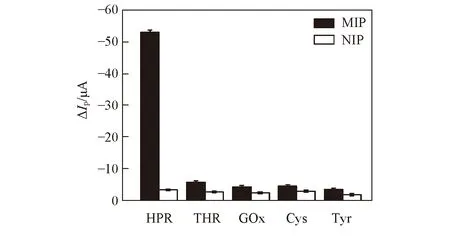
Fig.8 Responses of MIPs/MWCNTs/GCE to different substances
用1.0×10-8mg/mL HRP与浓度为其10倍的凝血酶(THR)、 葡萄糖氧化酶(GOx)、 半胱氨酸(Cys)和酪氨酸(Tyr)进行了选择性测试. 如图8所示, MIPs/MWCNTs/GCE传感器识别HRP前后的DPV峰电流变化值ΔΙ远高于NIP电极, 而其它4种干扰物质在印迹电极上的ΔΙ值远低于HRP, 表明制备的分子印迹电极对HRP有较强的特异性吸附能力, 具有良好的选择性.
实验中采用相同方法制备了6个MIPs/MWCNTs/GCE电极, 分别测定其在1.0×10-8mg/mL HRP溶液中孵育20 min后, 再置于PBS缓冲溶液(含0.1 mol/L NaCl, pH=5.8)中的DPV响应, 所得结果的相对标准偏差(RSD)为2.36%; 使用同1个MIPs/MWCNTs/GCE电极, 在1.0×10-8mg/mL HRP溶液中孵育20 min后, 再置于PBS缓冲溶液(含0.1 mol/L NaCl, pH=5.8)中进行连续5次测定, 所得结果的相对标准偏差(RSD)为1.62%, 表明制备的分子印迹电极具有良好的重现性.
将制备的MIPs/MWCNTs/GCE电极置于1.0×10-8mg/mL HRP溶液中孵育20 min后, 于4 ℃下保存, 7 d其响应电流仅降低2.1%, 表明制备的MIPs/MWCNTs/GCE电极具有良好的稳定性.
为考察该传感器检测H2O2的重复性, 采用6支MIPs/MWCNTs/GCE电极, 在1.0×10-8mg/mL HRP溶液中孵育20 min后, 对浓度为9.8 μmol/L的H2O2进行测试, 所得6次电流值的RSD为4.21%; 用1个电极对浓度为9.8 μmol/L的H2O2重复测试5次所得电流值的RSD为4.57%, 表明该传感器用于检测H2O2有较好的重复使用性.
2.9 传感器对H2O2测定的回收率
取江西鑫隆医药公司生产的H2O2消毒液稀释1×106倍进行实际样品测试, 所得结果如表3所示, 回收率在91.2%~97.1%之间, 表明该传感器可应用于实际样品的检测.

Table 3 Recovery results of hydrogen peroxide
3 结 论
以HRP为模板分子, MWCNTs作为增敏材料, 制备了可同时检测HRP和H2O2的分子印迹电化学传感器. 对单体与模板的比例、 洗脱时间、 洗脱液组成、 测试底液pH值及孵育时间等实验条件进行了优化, 并对传感器进行了表征和监测. 该分子印迹电化学传感器对HRP和H2O2的检测具有较宽的线性范围和较低的检出限, 可作为检测酶及其酶促底物的双分析物传感器.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20190485.
