铁铜合金脱除硝酸盐氮的工艺研究
2020-01-16刘化平吴依玲朱怀志聂兆广胡艳芳
刘化平,吴依玲,朱怀志,聂兆广,胡艳芳
(1.海金山联合环境工程公司青岛分公司,山东,青岛 266033;2.青岛大学 化学化工学院,山东 青岛 266071)
水是生命之源,我国的水资源从总量来看虽然排名为全球第6,但是水资源的人均占有量却非常的少,水资源日渐难以满足我国国民的生活需求[1]。随着社会发展,人类进行的各项生产活动中都会对地下水造成氮污染,其中以工业生产最为严重[2]。工业废水的主要来自钢铁厂、化工厂、皮革厂、和造纸厂等,由于其排放量比较大,而且成分复杂,难以被处理从而成为了水体氮污染的主要原因[3]。
氮污染对生物和环境危害极大,而且难以去除,随着生态链循环到人们体内会造成不可忽视的严重后果。为了营造绿色健康的生态环境,需要对硝酸盐氮的成因以及处理方法进行研究[4-5],将排放的污水中硝酸盐氮的含量降低到最低范围内。处理除硝酸盐比较常用的方法有生物脱氮法、离子交换法、反渗透法、电渗析法和化学还原法等,但是以上的方法均或多或少地存在着缺点和不足,比如可能产生二次污染、操作的成本较高及会有副产物的生成等[6]。相比之下,化学还原法脱除废水中的硝酸盐氮的成本低,效率快,操作简单,利用零价铁来还原硝酸盐氮也因此被广泛地研究和利用了。但是,在使用零价铁还原硝酸盐氮的时候,除了理想生成物氮气外还会产生其他副产物,如亚硝酸盐氮、铵根离子等。因此如何对铁粉进行改性,减少副产物的生成,同时提高化学反应的效率,是目前的研究重点。本文利用铁铜合金作为还原剂,旨在不同实验条件下寻找废水中脱除硝酸盐氮的最佳反应条件。
1 仪器与试剂
1.1 试剂
铁粉(纯度99 %),硫酸铜,硝酸钾,稀硫酸,酚二磺酸,氨水,纳氏试剂,氢氧化钠。
1.2 仪器
紫外可见分光光度计(T6新世纪),电子天平(精密仪器),电子调温电热套(98-1-B型),增力电动搅拌器(JJ-1型),实验室精密pH计(PHS-3BW),扫描电子显微镜(SEM)(日立TM-3000),ICP-MS(ICAP 6000)。
2 研究方法
2.1 实验原理
利用铁铜合金,在酸性条件下与硝酸盐氮反应,生成氮气、铵根离子及亚硝酸盐氮。反应方程式如下:
(1)
(2)
(2)
(4)
与零价铁相比,铁铜合金可以在反应过程中形成了原电池[7],可以加快铁粉的电子转移反应速度,提高铁的还原性,促进系列反应的进行。
2.2 实验方法
采用液相还原法制备金属复合材料,称取0.71 g还原铁粉于玻璃瓶中,加入8.5 mL的8 mmol/L的硫酸铜溶液,再加入60 mL的蒸馏水,在25 ℃的恒温水浴中,1500 rpm条件下反应0.5 h,然后进行真空抽滤,取滤渣在常温下自然干燥3~4 h,就能得到铜的负载率为4 %的二元金属复合材料Fe-Cu合金。称取一定质量的合金与100 mL一定浓度的硝酸钾溶液置于锥形瓶中,在恒温水浴锅中持续搅拌下反应1 h。反应结束之后利用0.22 μm的过滤膜过滤除去固体颗粒,取10 mL样品,测定其硝酸根,铵根的含量,(测定前需稀释一定倍数)。溶液的pH由硫酸或氢氧化钠来调节。硝酸盐氮使用分光光度法进行测定,波长为410 nm,氨氮的测定利用纳氏试剂分光光度法,波长为420 nm。另采用ICP-MS测定样品中的铁离子和铜离子浓度。本实验采用单一变量法的方式,分别检测在不同pH、不同温度以及时间下,硝酸盐氮的脱除率,最终寻找出较佳的反应条件。
3 结果与讨论
3.1 铁铜合金扫描电镜图分析

图1 Fe(左)与Fe-Cu合金(右)扫描电镜图
用扫描电子显微镜(SEM)在15 KV的束流电压下,对Fe、Fe-Cu合金的表面形貌进行了分析。结果如图1所示,可清晰看出纯Fe在负载Cu之前是光滑平整的结构,Fe-Cu合金表面凹凸不平,有明显的絮状物,猜测是生成的铜颗粒附着在铁粉上了,很好的说明了液相制造合金法是有效的。
3.2 铁铜合金的XRD图分析
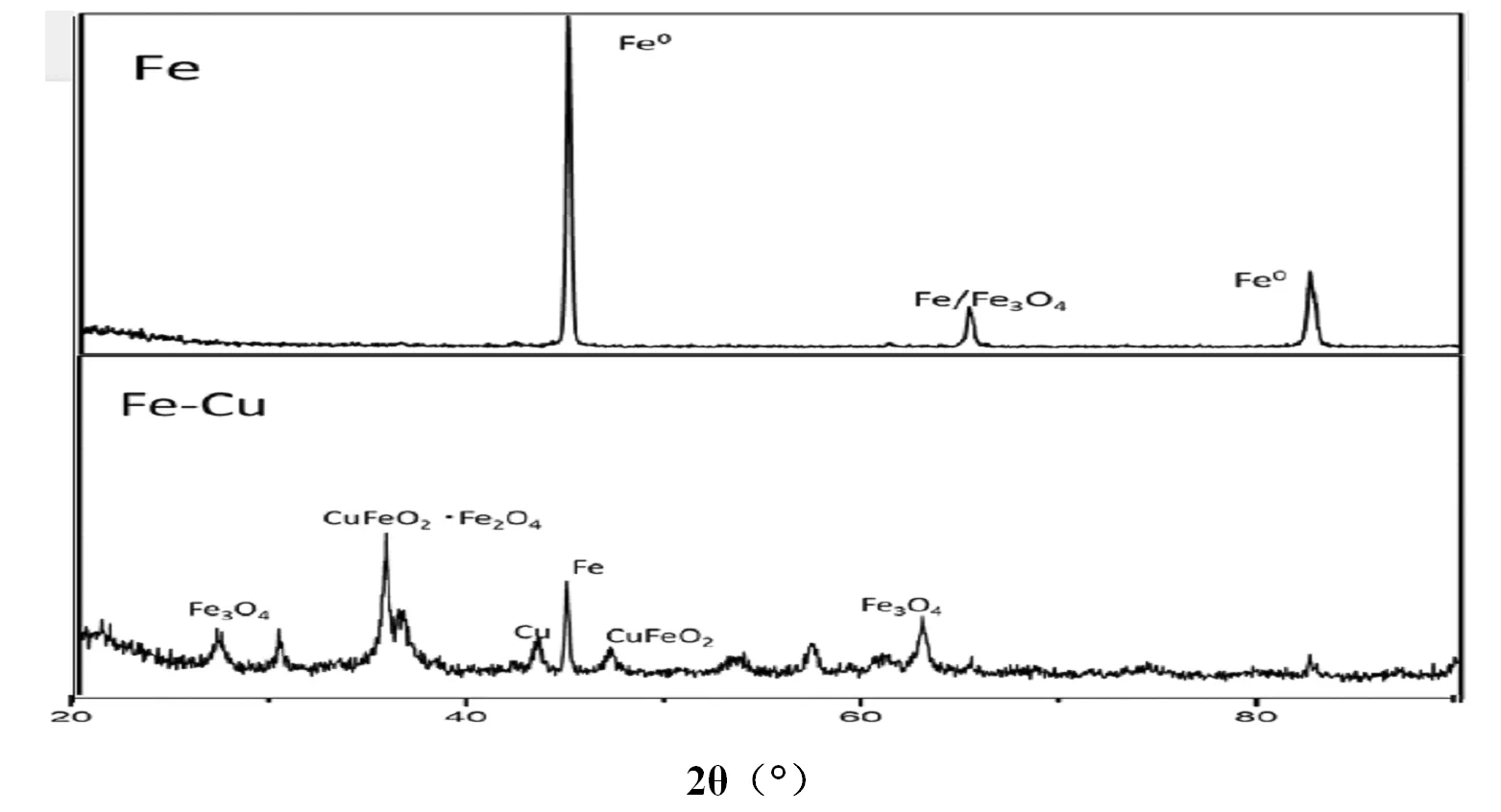
图2 Fe与Fe-Cu合金的XRD对比图
用X射线衍射(XRD)对铁铜合金的结晶度进行了分析,扫描范围为5°到90°,扫描速度为2.2 min-1。从图2中可以看出,铁铜合金的图里均没有明显的杂峰,说明在制作铁系合金时,没有引入其他杂质,晶型结构稳定。本次制造合金所用的的铁粉在65°左右发现Fe3O4的反射峰,可能是暴露空气中导致铁粉被氧化了一部分,Fe的反射峰主要在44.8°,而在Fe-Cu合金的XRD图里除了未反应的铁粉外,可以看出在43°左右明显有单质Cu的反射峰,而且CuFeO2·Fe2O4在35.5°也有明显的反应。
3.3 反应时间对脱硝效率的影响
在温度为20℃时,pH值为3左右,用0.3g的负载率为4%的铁铜合金与100mL浓度为100mg/L的硝酸钾溶液分别反应10min、20min、30min、40min、60min、90min、120min等,测其硝酸根脱除率和剩余溶液中的铵根量如下图所示。
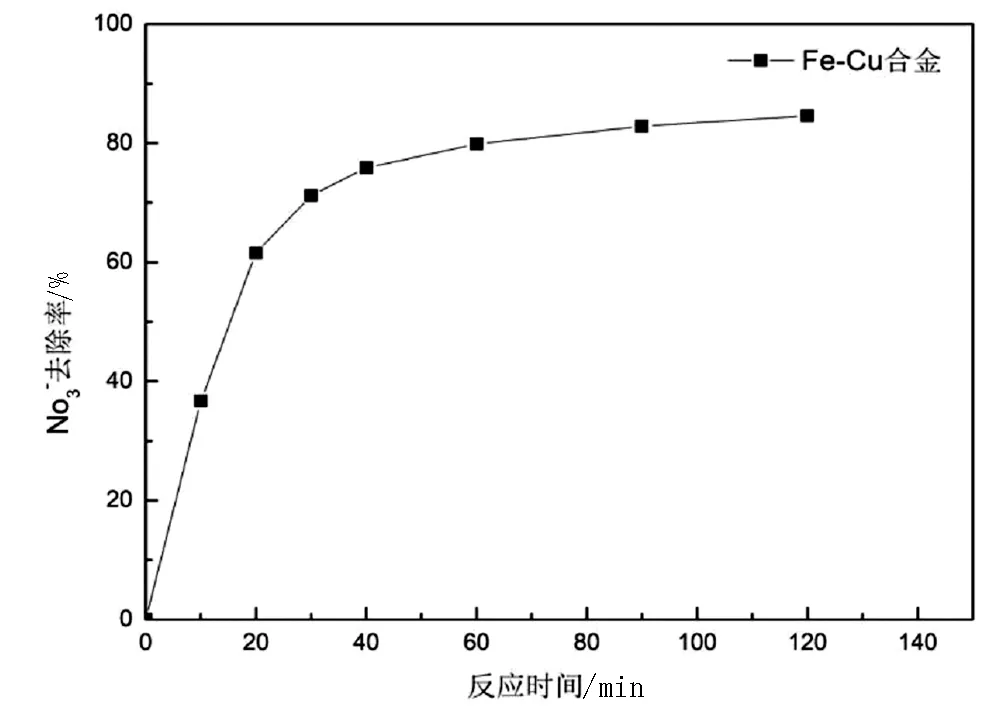
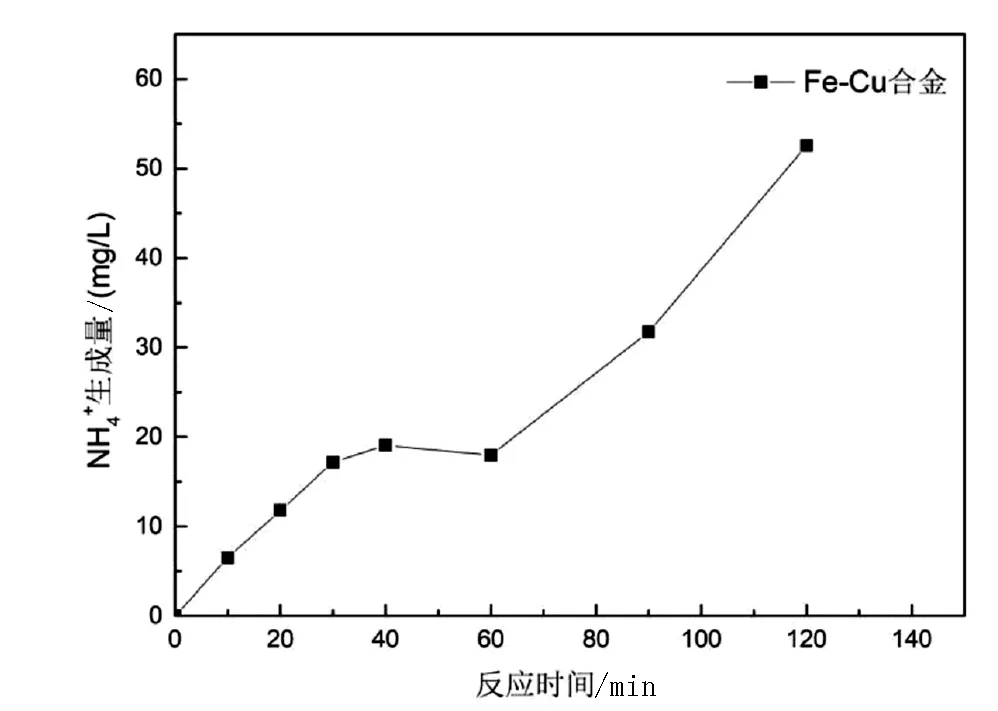
图3 不同反应时间下硝酸根的脱除率和铵根离子的生成量
由图3可知,硝酸根离子的去除率呈现出了随时间增长而逐渐增大的趋势,当反应到60min左右时,时间对硝酸根去除率的影响逐渐降低,可能是由于反应物剩余量较少,反应进行到后期相较缓慢。而随着时间的增长,铵根离子的产生量呈现出了明显的上升趋势,在60min以内铵根离子的产生量基本小于20mg/L,反应时间继续增长,铵根离子的产生量也持续增长,反应120min后,溶液内氨根离子的浓度可高达50mg/L,这可能是由于反应时间太长会使溶液中被转化为氮气或亚硝酸根的产物再次反应变成铵根离子。
3.4 pH对脱硝效率的影响
一般来说,铁需要在酸性条件下(pH值<4)能较好的去除硝酸盐氮溶液,但是强酸或许不适合水溶液中其他成分的处理,且大量的酸液还需要二次处理。因此,本节研究初始pH值对硝酸根的脱除率等的影响,在温度为20℃时,用0.3g的负载率为4%的铁铜合金,分别在pH值为2、3、4、5、6的条件下与100mL浓度为100mg/L的硝酸钾溶液反应1h。测得的硝酸根脱除率和剩余溶液中的铵根量如下图所示。
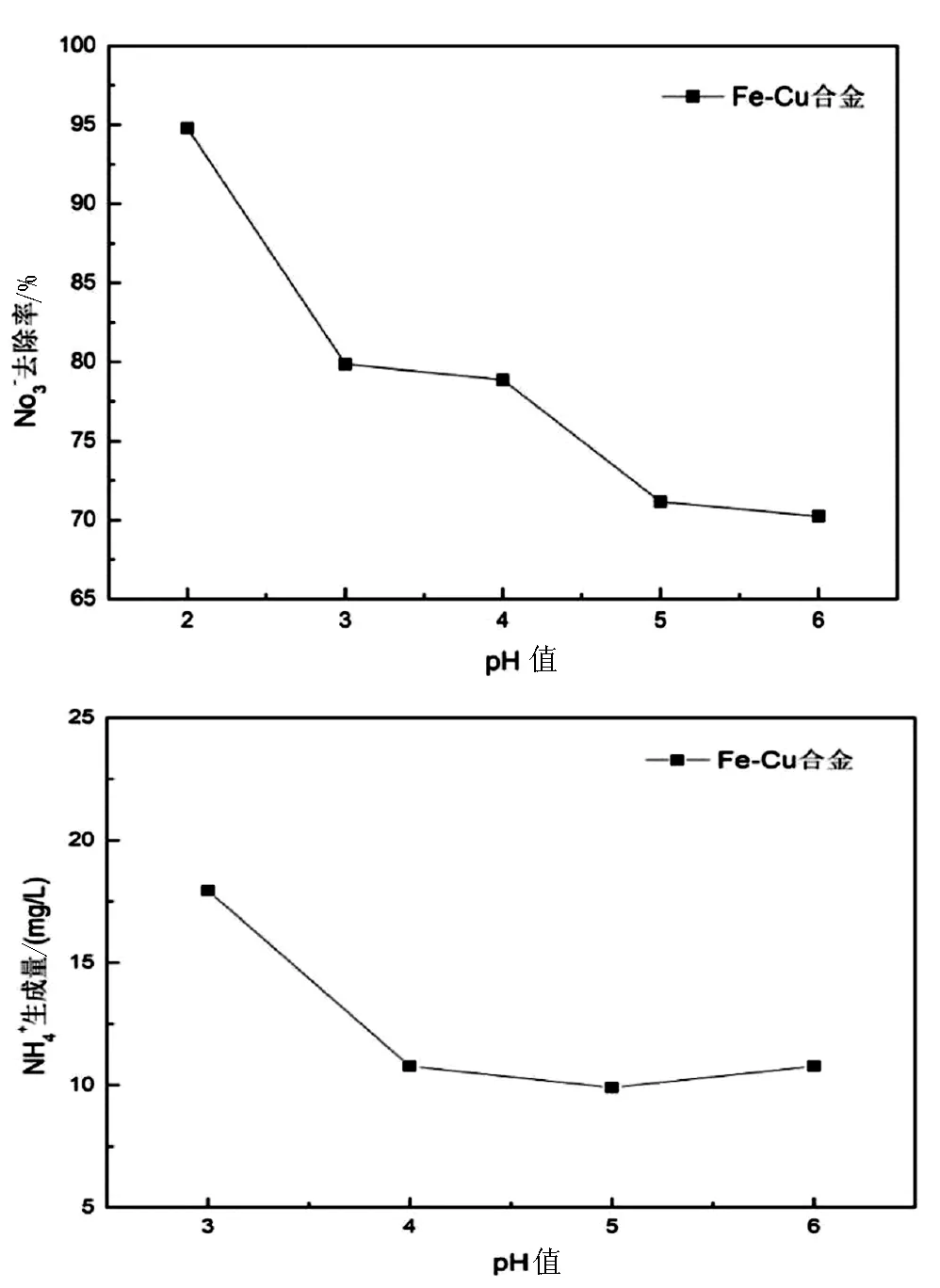
图4 不同初始pH条件下硝酸根的
4 结论
由于零价铁毒性低、廉价、易操作等优点,传统的活泼金属法大部分都利用零价铁去除硝酸盐氮,可是由于铁自身状态不稳定易被氧化,反应环境需要浓酸和高饱和缓冲液,对零价铁进行改性提高零价铁的反应速率是关键。研究表明复合金属颗粒可以大大提高硝酸盐的去除率,引入金属铜作为惰性电极的存在,可以提高零价铁的反应活性。其他条件相同时,溶液酸性越强其硝酸盐氮的去除率越高,但是氨氮生成率也会升高,较佳操作条件为:常温下,铜负载率为4%,pH值为2时,硝酸盐氮脱除率最大能达到94.79%。
