二烯丙基二硫醚对单增李斯特菌毒力基因表达的影响
2020-01-16魏丽娜吴虹燕李鑫鑫郝洪顺万锈琳高美玲侯红漫张公亮
魏丽娜 吴虹燕 李鑫鑫 郝洪顺 万锈琳 高美玲 侯红漫 张公亮 *
(1 大连工业大学食品学院 辽宁大连 116034
2 大连工业大学纺织与材料工程学院 辽宁大连 116034
3 辽宁省水产品加工质量安全与控制重点实验室 辽宁大连 116034)
硫醚类香料在中国具有悠久的历史,它除了赋予食品在感官上的特殊风味及生理保健功能外,还具有抗菌消炎,提高机体免疫力,预防和治疗心血管疾病等保健及药理作用[1-2]。二烯丙基二硫醚(Diallyl disulfide,DADS)是一种典型的在大蒜中含量较高的一种硫醚类香料。它含有两个原子,可溶于脂类,具有挥发性等特性[3]。
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)简称单增李斯特菌,属于革兰阳性无芽孢杆菌李斯特菌属,是四大食源性致病菌之一[4-5]。该菌容易污染食物,引起食物中毒,临床表现为人和动物脑膜炎、败血症及孕妇流产等[6-7]。近年来,有关该菌引起的食物中毒事件频频发生,并造成了人员死亡,引起世界各国高度关注[8-11]。内化素A(inlA)是单增李斯特菌特有的毒力侵袭因子,由inlA基因编码。hlyA基因是单增李斯特菌的毒力标志基因,它所编码的溶血素(listeriolysion O,LLO)是单增李斯特菌的主要毒力因子。转录活化因子(PrfA)由prfA基因编码,在单增李斯特菌感染的过程中,对许多毒力因子均有正调控作用[12-13]。
近年来针对DADS的研究,多侧重于抗癌方面,比如在一些细胞(结肠、乳腺等细胞)癌变早期和晚期阶段可以起到抑制作用。Altonsy等[14]发现DADS可通过干扰细胞循环生长周期的方式,诱导MCF-7乳腺癌细胞凋亡。Nagaraj等[15]研究表明DADS通过影响Bax的线粒体途径而导致人肿瘤细胞半胱天冬酶依赖性凋亡。然而,有关DADS等硫醚类香料对食源性致病菌的研究相对较少。张公亮等[16]考察了DADS等8种常见的硫醚类香料对大肠杆菌等的抑菌活性,结果表明:8种硫醚类香料均具有抑菌效果。前期研究已明确硫醚类香料对常见的致病菌具有良好的抑菌作用,对单增李斯特菌的抑菌机理方面的研究尚不明确。本文选用硫醚类香料DADS为研究对象,以单增李斯特菌为供试菌株,采用RT-qPCR法研究该香料对毒力基因inlA、hlyA、prfA表达的影响。为进一步探索外援物质对单增李斯特菌毒力基因的调控提供一定的参考。
1 材料与方法
1.1 材料与试剂
胰蛋白胨大豆肉汤(TSB)、琼脂粉等,博诺试剂公司;RNAprep pure培养细胞/细菌总RNA提取试剂盒,天根生化科技(北京)有限公司;SYBRPremix Ex TaqTM、Primer ScriptTMRT reagent Kit With gDNA Eraser(Perfect Real Time)等,宝生物工程(大连)有限公司;RNase-free Water、DEPC水、荧光定量PCR引物等,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
01J2003-04型高压灭菌锅,上海博讯实业有限公司;ZHWY-100B型恒温培养振荡器、ZHWY-2102C型双层小容量全温度恒温摇床,上海智城分析仪器制造有限公司;DRP-9162型电热恒温培养箱,上海森信实验仪器有限公司;UV-1750型紫外分光光度计,日本岛津仪器有限公司;MyiQTM2型荧光定量PCR仪,美国BIO-RAD公司。

表1 DADS的结构Table1 The structure of DADS
1.3 抑菌剂的制备和菌种活化
将DADS进行稀释,按照公式求出所需该香料的体积后进行半数稀释,密封备用。计算方法见公式(1):
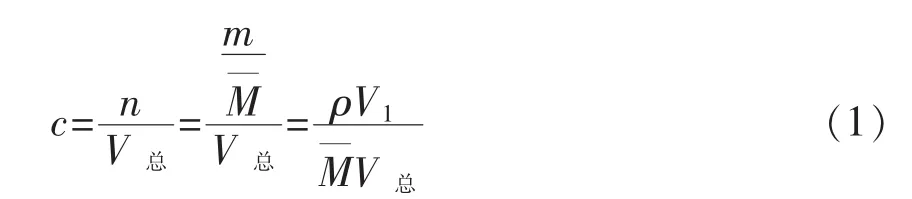
式中,n——摩尔质量,mol/L;M——分子质量;m——原液质量,g;ρ——密度,g/mL;V1——加入硫醚类香料的体积,L;V总-V1——加入溶剂的体积,L。
将-80℃冻存的供试菌取出,吸取50μL菌液至5mL的TSB液体培养基中,37℃,150 r/min摇床培养24 h。将该菌液划平板,37℃下恒温过夜培养。挑取单菌落至液体培养基,摇床培养至菌体终浓度为2×109CFU/mL,备用。
1.4 最低抑菌浓度(MIC)的测定
参照王鑫[17]的方法,采用微量肉汤稀释法测定DADS对单增李斯特菌的最低抑菌浓度。用DMSO将硫醚类香料配成初始浓度为8mmol/L储备液。用液体培养基将硫醚类香料储备液稀释至终浓度为4,2,2mmol/L,直至62.5 μmol/L。无菌条件下,将100μL不同浓度的硫醚类香料对应加在无菌的96孔板中,加菌液至每孔细菌终浓度达5×104CFU/mL。以TSB液体培养基作阴性对照,TSB液体培养基及5μL菌悬液作生长对照孔。每个浓度3组平行,结果取平均值。接种后的96孔板置于37℃恒温培养箱中培养。24 h后测定OD600,以细菌生长的为“+”,无细菌生长的为“-”来确定MIC。
1.5 DADS作用下单增李斯特菌生长曲线的测定
参考Qiu等[18]的方法。根据已测定出的MIC的结果将DADS稀释成适当亚抑菌浓度,吸取菌液1mL于99mL TSB液体培养基,再分别添加30μL不同浓度的DADS,以添加等体积的DMSO作为对照组,摇床培养12 h,每隔4 h,利用紫外分光光度计测定菌液OD600值,以OD600值为纵坐标,时间t为横坐标,绘制试验组和对照组生长曲线。
1.6 RNA的提取
RNA的提取参考Upadhyay等和Anne等[19-20]的方法。在TSB培养基中分别添加不同亚抑菌浓度的DADS,以未添加DADS的作为对照组,培养12 h。吸取1 mL菌液于1.5 mL无菌离心管中,12 000 r/min下4℃离心2min后弃上清。向菌体沉淀物中添加500μL的DEPC水以去除液体培养基的干扰,后续操作按照细菌总RNA提取试剂盒说明书步骤进行,除杂后反转录为cDNA。
1.7 RT-qPCR法研究DADS对单增李斯特菌毒力基因表达的影响
以对照组的cDNA为模板,采用RT-qPCR法对inlA、hlyA、prfA引物进行特异性验证。具体的引物片段如下表2所示。不同试验组的cDNA为模板,利用方程2-⊿⊿Ct计算目的基因的相对表达量[23-24]。

表2 本研究所用引物Table2 List of primers used in this study
2 结果与分析
2.1 DADS对单增李斯特菌MIC的测定
表3为DADS对单增李斯特菌生长影响的结果:当浓度≥2mmol/L时,无单增李斯特菌生长迹象。当浓度低于2mmol/L时,单增李斯特菌仍可以生长。因此DADS对单增李斯特菌的MIC为2 mmol/L。Upadhyay等[19]研究表明,植源性成分反式肉桂醛、香芹酚、麝香草酚作用于单增李斯特菌的MIC 分别为0.90,0.75,0.60mmol/L,抑菌作用显著。同样Rohani等[25]研究发现大蒜精油对单增李斯特菌的MIC为0.10mg/L。

表3 DADS对单增李斯特菌MIC的结果Table3 Results of DADS on MIC of Listeria monocytogenes
2.2 DADS对单增李斯特菌生长曲线的影响
根据上一步的MIC结果,选取不同的亚抑菌浓度的DADS作用于单增李斯特菌,进行生长曲线的绘制。绘制结果如图1所示。MIC~1/16MIC的试验组,不同培养时间,对单增李斯特菌的抑制程度不同。当DADS浓度为MIC时,DADS完全抑制了单增李斯特菌的生长。当浓度为1/2MIC~1/16MIC时,DADS对单增李斯特菌的抑制作用呈现明显的浓度依赖性。与对照组相比,当1/2MIC组在0~9 h的对数生长期过程中,DADS明显地抑制了单增李斯特菌的生长。1/4MIC及其更低浓度的组分在9~12 h过程中进入稳定期,生长曲线几乎与对照组完全重合。

图1 DADS对单增李斯特菌生长曲线的影响Fig.1 DADS on the growth curve of Listeria monocytogenes
2.3 RNA完整性检测
将经不同亚抑菌浓度DADS处理后所提取出单增李斯特菌的RNA,经1%琼脂凝胶电泳检测,结果如图2a,所提出的对照组、1/4MIC、1/8MIC、1/16MIC的总RNA,23S rRNA和16S rRNA条带较清晰,然而有明显的拖尾现象,即各试验组分总RNA中有不同程度的DNA等杂质污染,需进一步处理。如图2b所示,总RNA经DNA酶处理后,DNA等杂质污染情况得到明显改善,条带拖尾程度降低,即RNA除杂处理成功,可进行后续试验。

图2 不同浓度单增李斯特菌RNA的提取及纯化Fig.2 Extraction and purification of Listeria monocytogenes RNA from different concentrations
2.4 毒力基因引物特异性验证
3对毒力基因引物的特异性验证结果如图3所示。图3a为inlA引物的熔融曲线图,结果显示为单峰,说明该引物无二聚体。图3b,3c分别是hlyA,prfA引物的熔融曲线图,结果与图3a相似。综上所述,inlA,hlyA,prfA引物特异性良好,可应用于后续试验。

图3 RT-qPCR法引物验证:熔融曲线Fig.3 RT-qPCR primer validation:the melting curve
2.5 DADS对单增李斯特菌毒力基因inlA、hlyA、prfA表达的影响
采用RT-qPCR的方法来探讨DADS对单增李斯特菌毒力基因inlA、hlyA、prfA表达的影响。对inlA作用的结果如图4所示,较对照组,其它试验组分经DADS处理后,毒力基因inlA的表达均受到抑制作用,且抑制趋势呈浓度依赖性。其中1/4MIC较其它试验组的抑制程度均显著(P<0.05),inlA的表达量为对照组的19%,1/8MIC及1/16MIC组分中inlA的表达量分别为68%,93%。Duodu等[26]采用RT-qPCR法,将经人工污染单增李斯特特菌的鲑鱼分别置于4℃,20℃下贮藏后得出类似结论,经外源因子处理后的inlA表达显著降低。
DADS对hlyA作用的结果如图5。整体与对照相比,不同DADS的亚抑菌浓度下,hlyA的表达均受到显著抑制。浓度为1/8MIC及1/4MIC时,hlyA的表达量分别为对照组的4%,2%,抑制效果极显著(P<0.05)。1/16MIC 较 1/8MIC及1/4MIC 试验组,hlyA的表达量差异显著。DADS对单增李斯特菌毒力基因hlyA的表达整体呈浓度依赖性。这与Xu等[24]研究结论一致,即石榴皮中鞣酸也可显著抑制单增李斯特菌毒力基因hlyA的表达。Miladi等[27]采用RT-PCR法来研究不同贮藏温度对其毒力基因表达的影响,得出类似结论:单增李斯特菌S2,S3均随着温度的降低,其毒力基因的表达量也逐渐降低。同样,Slama等[28]将手工奶酪置于-20℃下贮存6个月后,发现其毒力基因iap的表达量受到了显著抑制,而对hlyA也具有抑制作用,然而抑制程度弱于iap。

图4 DADS对单增李斯特菌毒力基因inlA表达的影响Fig.4 Effect of DADS on the gene expression of inlA in Listeria monocytogenes
DADS对单增李斯特菌毒力基因prfA表达同样具有抑制作用(图6)。经对比发现,添加DADS后的试验组 1/4MIC,1/8MIC,1/16MIC的prfA表达量均下调,下调量差异显著(P<0.05),整体下调趋势呈浓度依赖性。1/4MIC组被抑制程度最大。当浓度为1/8MIC及1/16MIC时,prfA的表达量为对照组的7%,34%。Upadhyay等[19]研究明确了反式肉桂酸、香芹酚、麝香草酚分别作用于单增李斯特菌后,prfA、actA、intA等毒力基因的表达量也显著降低,这与本结论基本一致。同样,Anne等[20]研究证明当500 U/mL的乳酸链球菌素在4℃下作用于单增李斯特菌后,其毒力基因prfA的表达量显著降低,仅为对照组的47%,当作用温度升至37℃时,表达量为对照组的86%。
DADS对单增李斯特菌毒力基因inlA,hlyA,prfA的表达均有抑制作用。同一浓度下,DADS对不同毒力基因的抑制程度不同。与对照组相比,1/16MIC的DADS对inlA,hlyA,prfA的抑制量分别为7%,40%,66%。而经1/8MIC及1/4MIC处理后,inlA的抑制量是对照组的32%,81%,hlyA及prfA的抑制量高达93%~99%。因此,DADS对毒力基因hlyA及prfA的抑制作用更明显,这可能与其分属不同毒力岛有关,inlA属于第二毒力岛(LIPI-2),而hlyA和prfA属于第一毒力岛(LIPI-1)[29-30]。

图5 DADS对单增李斯特菌毒力基因hlyA表达的影响Fig.5 Effect of DADS on the gene expression of hlyA in Listeria monocytogenes

图6 DADS对单增李斯特菌毒力基因prfA表达的影响Fig.6 Effect of DADS on the gene expression of prfA in Listeria monocytogenes
3 结论
本文采用微量肉汤稀释法确定出DADS在96孔板中对单增李斯特菌的最低抑菌浓度为2 mmol/L,并在摇瓶体系下测定其生长曲线,结果显示DADS对单增李斯特菌的抑制作用呈浓度依赖性。当浓度为2mmol/L时,单增李斯特菌完全被抑制,这与96孔板中的抑菌试验结论一致。以RT-qPCR为技术手段,探索不同浓度的DADS对单增李斯特菌毒力基因表达的影响。结果表明:亚抑菌浓度下DADS可显著地抑制单增李斯特菌毒力基因inlA,hlyA,prfA的表达,抑制程度呈浓度依赖性。其中与对照组相比,1/16MIC组的毒力基因inlA的表达量分别被抑制了近81%,而hlyA,prfA的抑制量远超过inlA,毒力基因hlyA和prfA对DADS的作用更敏感。本研究为其它含硫香料对致病菌的作用及毒力基因的表达提供了新思路。
